2. 贵州医科大学附属医院 贵州省肿瘤医院肿瘤科, 贵阳 550004;
3. 贵州医科大学组织工程及干细胞实验中心, 贵阳 550001
2. Affiliated Hospital of Guizhou Medical University, Department of Oncology, Guizhou Cancer Hospital, Guiyang 550004, China;
3. Stem Cell and Tissue Engineering Research Center, Guizhou Medical University, Guiyang 550001, China
非小细胞肺癌(non-small cell lung cancer, NSCLC)生存受多种因素影响,其中,治疗前生存状态是重要的影响因素,其不仅用于判断患者是否具有接受治疗的能力和价值[1],还与生存相关,生存状态越好,越有利于延长生存期[2-5],是重要的预后独立影响因素[6-7]。然而临床工作中,经治疗后患者的自理能力、生活质量等会发生变化,治疗后生存状态(Karnofsky performance status of post-treatment,KPSpost)降低,可能使Ⅳ期NSCLC生存率降低[8-9],但KPSpost改变是否确实影响生存,临床因素、治疗因素、不良反应等是否会导致KPSpost改变,尚未见系统分析。本研究通过回顾性分析,探讨KPSpost变化对生存的影响和导致其改变的相关因素。
资料与方法1.病例资料:来源于Ⅳ期NSCLC同期放化疗的一项单中心[10]和一项多中心前瞻性Ⅱ期临床研究[8],经病理或细胞学确诊的初治Ⅳ期NSCLC;治疗前生存状态为70~100;完成化疗≥2个周期同期原发肿瘤剂量≥36 Gy的研究方案;疗程结束后1个月内完成KPSpost评价。两项研究的322例中279例纳入分析(未完成研究方案40例,KPSpost评价缺失3例);KPSpost<70为23例,70为46例,80为127例,90为82例,100为1例。其他资料见表 1。
|
|
表 1 279例Ⅳ期非小细胞肺癌临床特征分布 Table 1 The characteristics of 279 patients with stage Ⅳ non-small-cell lung cancer |
2.治疗模式:原发肿瘤放疗与化疗同期进行。放疗选择6 MV X射线,三维适形或调强放疗技术,原发肿瘤体积(gross tumor volume,GTV)包括原发病灶、浸润区和引流区转移淋巴结;临床靶区(clinical target volume, CTV)为GTV边缘外三维方向外扩0.6 cm;计划靶区(planning target volume, PTV)为CTV外扩0.5~1.0 cm。计划评估要求100%处方剂量包括100%的GTV,90%处方剂量包括98%~100%的PTV。正常全肺体积为全肺体积减GTV,肺V20≤32%,平均肺剂量≤20 Gy。采用后程加速超分割照射,首程放射治疗1.8 Gy/次,5次/周,36 Gy/20次;后程加速超分割1.35 Gy/次,2次/d,间隔6~8 h。如放射损伤可控前提下,63 Gy后针对残留病灶推量,最高至76.5 Gy。化疗以顺铂或卡铂为基础的两药联合方案,89.4%联合紫杉类药物,其中顺铂80 mg/m2,均分静脉滴注第2~3天,或卡铂300~350 mg/m2静脉滴注第2天,紫杉醇140~170 mg/m2静脉滴注第1天或多西他赛60~75 mg/ m2静脉滴注第1天,长春瑞滨25 mg/m2第1天、第8天, 培美曲塞500 mg/m2静脉滴注,第1天,21~28 d为1个周期。
3.观察指标:末次随访时间为2016年3月,1、2、3、5年随访率分别为100%、100%、99%和99%。KPSpost评价采用治疗前生存状态评估标准[1]。定义KPSpost改善为疗程结束1个月内与治疗前相比生存状态评价升高≥10或稳定,下降≥10为KPSpost降低;同期放化疗治疗模式1、2、3、4分别为化疗4~6个周期同期原发肿瘤剂量≥63 Gy、化疗4~6个周期同期原发肿瘤剂量 < 63 Gy、化疗2~3个周期同期原发肿瘤剂量≥63 Gy、化疗2~3个周期同期原发肿瘤剂量 < 63 Gy;定义治疗获益(disease control rate,DCR)为依据RECIST1.0标准在同期放化疗疗程结束1个月内评价为完全缓解(CR)+部分缓解(PR)+疾病稳定(SD)病例;单、多器官转移分别为转移病灶局限于1个器官、分布于2个或以上器官;总生存(overall survival,OS)为从患者治疗开始直至死亡或末次随访时间,计算中位生存期(median survival time,MST)。
4.统计学处理:OS采用SPSS 16.0软件行Kaplan-Meier并Log-rank检验和单因素分析,Cox回归模型多因素分析。KPSpost变化的相关因素采用χ2检验和logistic多因素回归分析。P < 0.05为差异有统计学意义。
结果1. KPSpost变化对生存的影响:KPSpost改善和降低分别为198和81例,1、2、3、5年OS及MST分别为56.6%和33.3%、18.2%和6.2%、10.6%和3.7%、4.0%和0%及14个月和9个月(图 1, χ2=11.751,P=0.001)。
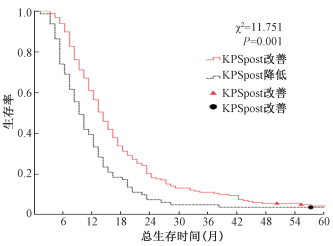
|
图 1 KPSpost改善和降低的总生存 Figure 1 The impact of KPSpost changes on overall survival |
2.相同因素KPSpost改变对生存的影响
(1) 临床因素KPSpost改变对生存的影响:T1~2、T3~4、N2~3、单或多器官转移KPSpost改善延长OS,N0~1差异无统计学意义(表 2)。
|
|
表 2 279例Ⅳ期非小细胞肺癌相同临床因素KPSpost改变对总生存影响 Table 2 The impact of clinical characteristics on the changes of KPSpost and overall survival for 279 patients with stage Ⅳ NSCLC |
(2) 治疗及不良反应因素KPSpost改变对生存的影响:原发肿瘤剂量 < 63 Gy、综合治疗模式4和发生治疗相关不良反应患者KPSpost改善的1、2、3、5年OS及MST延长;其余治疗因素KPSpost改变对生存差异无统计学意义(P>0.05, 表 3)。
|
|
表 3 279例Ⅳ期非小细胞肺癌治疗及相关不良反应因素KPSpost改变对总生存影响 Table 3 The impact of treatment modalities and toxicities on KPSpost and overall survival for 279 patients with stage Ⅳ NSCLC |
(3) 预后Cox模型多因素回归分析:选择KPSpost变化、T和N分期、转移状态、原发肿瘤剂量、血液学和胃肠道不良反应及放射性食管炎和肺炎进入Cox回归模型,结果显示KPSpost改变、N分期、器官转移状态、原发肿瘤剂量对OS有统计学意义(χ2=40.741,P < 0.05,表 4)。
|
|
表 4 279例Ⅳ期非小细胞肺癌预后影响因素的Cox模型多因素分析 Table 4 Multivariate analysis with Cox Model on survival for 279 patients with stage Ⅳ NSCLC |
3. KPSpost变化相关影响因素分析
(1) 单因素分析:完成原发肿瘤剂量≥63 Gy和综合治疗模式1、治疗获益、发生0~2级白细胞和血小板不良反应患者的KPSpost降低显著减少;单器官转移、发生0~2级血红蛋白不良反应和放射性食管炎的KPSpost降低有减少的趋势。而不同性别、年龄、T和N分期、化疗周期和发生不同级别的胃肠不良反应、放射性肺炎的KPSpost变化差异无统计学意义(P>0.05, 表 5)。
|
|
表 5 279例Ⅳ期非小细胞肺癌KPSpost影响因素的单因素分析 Table 5 Univariate analysis of the clinical factors on KPSpost for 279 patients with stage Ⅳ NSCLC |
(2) logistic回归分析:选择KPSpost变化单因素分析有统计学意义和趋势的治疗相关因素、临床因素、不良反应等进行logistic回归分析,结果显示KPSpost降低发生率与完成综合治疗模式1和近期疗效获益呈负相关(β<0,P<0.05),发生3~4级血小板不良反应和放射性食管炎呈正相关(β>0,P<0.05,表 6);白细胞、血红蛋白不良反应、原发肿瘤剂量和器官转移状态与其无关(P>0.05)。
|
|
表 6 279例Ⅳ期非小细胞肺癌KPSpost影响因素的logistic回归分析 Table 6 The logistic multivariate regression analysis of the clinical factors for the KPSpost |
讨论
治疗前生存状态反映了癌症患者接受抗肿瘤治疗的能力和价值、与预后呈正相关,生存状态较好的晚期肺癌患者接受一线化疗后MST为10.8个月,较差病例仅为4.8个月[1, 11];基于药物治疗基础上原发肿瘤放疗的模式显著延长OS的观念逐渐得到认同[8, 12-16]。然而,很少有研究讨论和分析KPSpost对OS的影响,两项关于Ⅳ期NSCLC同期放化疗的前瞻性研究曾分别提示KPSpost改善可能使OS延长,反之则降低[8, 10],但并未进一步分析导致KPSpost改变的相关因素,亦未见其他文献报道。本研究279例同期放化疗结果的再分析显示,KPSpost改善显著延长1、2、3、5年OS及MST,提示对于Ⅳ期NSCLC患者应用同期放化疗后KPSpost改善或保持稳定可能对生存有利。分层分析显示,一方面,相同T和N分期(N0~N1除外)、单和多器官转移等临床因素下因同期放化疗导致KPSpost降低则对生存不利(P<0.05);另一方面,放疗剂量≥63 Gy、足量化疗联合放疗(模式1)、完成4~6个周期化疗或根治剂量放疗等治疗强度时,KPSpost的变化未对生存产生显著影响,而放疗剂量<63 Gy、治疗强度不足(模式4)时KPSpost降低不利于生存,同时,发生治疗相关不良反应并使KPSpost降低者亦不利于生存(P<0.05)。综合上述结果分析认为,KPSpost改变在不同治疗因素下对生存的影响不同,给予足够治疗强度、治疗获益时,可能因为治疗相关不良反应导致KPSpost降低,但肿瘤获得控制的概率增加,使治疗不良反应导致的KPSpost降低更容易修复,而减少对OS的影响;相反,治疗强度不足,疗效降低,治疗不良反应和肿瘤控制率低同时导致KPSpost降低,使KPSpost修复受影响而表现OS的降低。进一步的COX多因素回归分析证实,KPSpost改变显著影响生存,治疗后降低的死亡风险较改善的患者增加46.3%(HR=1.463,P<0.05),是Ⅳ期NSCLC同期放化疗预后的独立影响因素。
KPSpost与治疗前生存状态的形成不同,预示代表的意义不同。治疗前生存状态与患者初诊时已经存在的TNM分期、血红蛋白、白细胞及血小板计数等临床因素有关[17],与任何治疗过程和因素无关。而KPSpost是受到治疗过程及其相关因素影响后产生,与治疗过程相关。因此,KPSpost改变的相关性单因素分析结果显示,与性别、年龄、临床分期和转移状态等临床因素无关,与患者完成治疗模式1、近期疗效获益、原发肿瘤剂量≥63 Gy相关,提示通过获得近期疗效和肿瘤控制率增加可更好地改善和稳定KPSpost而有利于生存[8, 18],剂量提高与生存期延长有非常强的相关性[19],Ⅳ期NSCLC治疗后是否获得疗效与KPSpost改变相关。
同期放化疗的治疗相关不良反应不同程度影响患者的生活质量,白细胞、血小板和血红蛋白等血液学结果显示,发生3~4级不良反应患者的KPSpost降低比率显著增加,乏力、贫血、免疫功能降低等导致生活质量下降明显。而发生3~4级胃肠道不良反应后,可能因为5-HT3受体拮抗剂治疗的有效率高达80%,较快地缓解相关不良反应且易于修复而使KPSpost降低不明显。但Ⅳ期NSCLC纵隔淋巴结转移(N2~N3)发生率约为70%左右[8, 10],放射治疗时难以避开食管而受照射剂量较高,可发生3~4级放射性食管炎且缺乏有效治疗方法,患者出现较为明显的营养不良、疼痛等导致KPSpost降低显著。对于发生不同级别的放射性肺炎未显示KPSpost改变存在差异。进一步多因素相关性分析表明,Ⅳ期NSCLC同期放化疗后KPSpost降低主要与治疗及其相关不良反应因素有关,与完成治疗模式1、治疗获益呈负相关,争取获得疗效可以显著减少KPSpost降低的发生率而有利于延长生存;与治疗相关的3~4级放射性食管炎和血小板不良反应呈正相关,重度不良反应降低生存。
综上所述,Ⅳ期NSCLC同期放化疗后KPSpost变化与OS密切相关,改善延长OS,降低对生存不利;但治疗模式的实施需要动态观察和调整,尽量避免发生3~4级放射性食管炎和血小板不良反应,减少因此带来的生存率降低。
利益冲突 所有作者在进行该研究时,未因执行此研究而获得职务、金钱及其他不正当财务利益作者贡献声明 杨牧野负责数据收集、分析及论文书写;欧阳伟炜、苏胜发、马筑、胡银祥负责放疗计划审核;李青松、耿一超、王羽、罗大先、杨文刚负责治疗计划的设计;栗蕙芹负责统计学方法指导及随访;何志旭、卢冰负责项目的主持及论文指导
| [1] |
Kelly CM, Shahrokni A. Moving beyond Karnofsky and ECOG performance status assessments with new technologies[J]. J Oncol, 2016, 2016(3): 1-13. DOI:10.1155/2016/6186543 |
| [2] |
Firat S, Bousamra M, Gore E, et al. Comorbidity and KPS are independent prognostic factors in stage I non-small-cell lung cancer[J]. Int J Radiat Oncol, 2002, 52(4): 1047-1057. DOI:10.1016/S0360-3016(01)02741-9 |
| [3] |
Movsas B, Moughan J, Sarna L, et al. Quality of life supersedes the classic prognosticators for long-term survival in locally advanced non-small-cell lung cancer:analysis of RTOG 9801[J]. Clin oncol, 2009, 27(34): 5816-5822. DOI:10.1200/JCO.2009.23.7420 |
| [4] |
Jezierska D, Adamska K, Liebert W. Evaluation of results of linac-based radiosurgery for brain metastases from primary lung cancer[J]. Rep Pract Oncol Radiother, 2014, 19(1): 19-29. DOI:10.1016/j.rpor.2013.06.006 |
| [5] |
Schiller JH, Harrington D, Belani CP, et al. Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer[J]. New Engl J Med, 2002, 346(2): 92-98. DOI:10.1056/NEJMoa011954 |
| [6] |
Paesmans M, Lafitte J, Berghmans T, et al. How much can patients, with low Karnofsky performance status and advanced non-small cell lung cancer, benefit from cisplatin-based chemotherapy? A retrospective analysis of a phase Ⅲ randomised trial[J]. J Clin Oncol, 2007, 25(18): 19516. DOI:10.1200/jco.2007.25.18_suppl.19516 |
| [7] |
Kubota K, Mizuno T, Yoh K, et al. Trends in metastatic sites and survival for patients (pts) with stage Ⅳ lung cancer[J].J Clin Oncol, 26(15_suppl): 19029. DOI: 10.1200/jco.2008.26.15_suppl.19029.
|
| [8] |
Su SF, Li T, Lu B, et al. Three-dimensional radiation therapy to the primary tumor with concurrent chemotherapy in patients with stage Ⅳ non-small cell lung cancer:results of a multicenter phase 2 study from PPRA-RTOG, China[J]. Int J Radiat Oncol Biol Phys, 2015, 93(4): 769-777. DOI:10.1016/j.ijrobp.2015.08.012 |
| [9] |
杜燕军, 王小虎, 李涛, 等. Ⅳ期NSCLC化疗同期3DRT前瞻性、多中心Ⅱ期临床研究——临床因素对生存影响(PPRA-RTOG003)[J]. 中华放射肿瘤学杂志, 2016, 25(10): 1045-1050. Du YJ, Wang XH, Li T, et al. An open, multicenter, phase Ⅱ study with concurrent chemotherapy and thoracic three-dimensional radiotherapy for stage Ⅳ non-small cell lung cancer PPRA-RTOG 003(chi CRT-TNC-10001026)-The impact of clinical factors on survival[J]. Chin J Radiat Oncol, 2016, 25(10): 1045-1050. DOI:10.3760/cma.j.issn.1004-4221.2016.10.005 |
| [10] |
Su SF, Hu YX, Ouyang WW, et al. Overall survival and toxicities regarding thoracic three-dimensional radiotherapy with concurrent chemotherapy for stage Ⅳ non-small cell lung cancer:results of a prospective single-center study[J]. BMC Cancer, 2013, 13(1): 474. DOI:10.1186/1471-2407-13-474 |
| [11] |
Salloum RG, Smith TJ, Jensen GA, et al. Survival among non-small cell lung cancer patients with poor performance status after first line chemotherapy[J]. Lung Cancer, 2012, 77(3): 545-549. DOI:10.1016/j.lungcan.2012.04.019 |
| [12] |
Iyengar P, Wardak Z, Gerber DE, et al. Consolidative radiotherapy for limited metastatic non-small-cell lung cancer:a phase 2 randomized clinical trial[J]. JAMA Oncol, 2017, 99(5): e173501. DOI:10.1001/jamaoncol.2017.3501 |
| [13] |
Gomez DR, Blumenschein GR, Lee JJ, et al. Local consolidative therapy versus maintenance therapy or observation for patients with oligometastatic non-small-cell lung cancer without progression after first-line systemic therapy:a multicentre, randomised, controlled, phase 2 study[J]. Lancet Oncol, 2016, 17(12): 1672-1682. DOI:10.1016/S1470-2045(16)30532-0 |
| [14] |
龙金华, 卢冰, 欧阳伟炜, 等. Ⅳ期非小细胞肺癌化疗同期胸部三维放疗的前瞻性临床研究(三)——不同放疗剂量对生存的影响[J]. 中华放射肿瘤学杂志, 2012, 21(1): 23-26. Long JH, Lu B, Ouyang WW, et al. A prospective study on concurrent chemotherapy and thoracic three-dimensional radiotherapy for stage Ⅳ non-small cell lung cancer(3)-The impact of radiation dose to thoracic primary tumor on survival[J]. Chin J Radiat Oncol, 2012, 21(1): 23-26. DOI:10.3760/cma.j.issn.1004-4221.2012.01.008 |
| [15] |
张波, 卢冰, 苏胜发, 等. Ⅳ期非小细胞肺癌化疗同期胸部三维放疗的前瞻性临床研究(四)——近期疗效对生存的影响[J]. 中华放射肿瘤学杂志, 2012, 21(1): 29-33. Zhang B, Lu B, Su SF, et al. A prospective study on concurrent chemotherapy and thoracic three-dimensional radiotherapy for stage Ⅳ non-small cell lung cancer(4)-The impact of response on survival[J]. Chin J Radiat Oncol, 2012, 21(1): 29-33. DOI:10.3760/cma.j.issn.1004-4221.2012.01.010 |
| [16] |
苏胜发, 卢冰, 张波, 等. Ⅳ期非小细胞肺癌化疗同期胸部三维放疗的前瞻性临床研究(一)——疗效与不良反应[J]. 中华放射肿瘤学杂志, 2011, 20(6): 467-472. Su SF, Lu B, Zhang B, et al. A prospective study on concurrent chemotherapy and thoracic three-dimensional radiotherapy for stage Ⅳ non-small cell lung cancer(1)-survival and toxicity[J]. Chin J Radiat Oncol, 2011, 20(6): 467-472. DOI:10.3760/cma.j.issn.1004-4221.2011.06.006 |
| [17] |
Buccheri G, Ferrigno D. Karnofsky and ECOG performance status in lung cancer:Equivalence, construct validity, and predictive validity[J]. Lung Cancer, 1994, 11(Suppl 1): 87. DOI:10.1016/0169-5002(94)94103-3 |
| [18] |
Ouyang WW, Su SF, Hu YX, et al. Radiation dose and survival of patients with stage Ⅳ non-small cell lung cancer undergoing concurrent chemotherapy and thoracic three-dimensional radiotherapy:reanalysis of the findings of a single-center prospective study[J]. BMC Cancer, 2014, 14: 491. DOI:10.1186/1471-2407-14-491 |
| [19] |
Koshy M, Malik R, Mahmood U, et al. Comparative effectiveness of aggressive locoregional therapy in metastatic lung cancer:associations between high-dose thoracic radiation therapy and/or chemoradiation therapy and survival in a large population-based cohort[J]. Int J Radiat Oncol Biol Phys, 2015, 93(3S): S68. DOI:10.1016/j.ijrobp.2015.07.163 |
 2019, Vol. 39
2019, Vol. 39


