颈段食管位于环状软骨下缘和胸骨上切迹之间[1]。颈段食管癌(cervical esophageal carcinoma,CEC)的发病率低,占所有食管癌的2%~10%[2]。鳞状细胞癌(squamous cell carcinoma,SCC)是其主要病理类型。因诊断时病变常侵犯周围重要结构,并常伴淋巴结转移,多为局部晚期,CEC根治性手术范围较大,通常需要咽喉食管切除术(pharyngo-laryngo-esophagectomy,PLE)。但PLE并发症发生率和死亡率高,患者生活质量明显下降[3-4]。美国国立综合癌症网络(NCCN)指南均推荐能够保留器官功能的根治性放化疗为CEC的标准治疗模式[5],且剂量学和器官保护方面调强放疗优于三维适形放疗[6]。然而,CEC放疗的处方剂量和靶区勾画尚未达成共识。目前发表的相关研究主要为回顾性分析,且少有大样本的数据。本研究对收治的初诊拟行根治性放疗CEC患者进行了分析,旨在探讨其复发模式和生存预后。
资料与方法1.患者筛选:从北京大学肿瘤医院病历系统中筛选出2008年8月至2017年5月确诊为CEC的患者,共119例接受放疗。入选标准:①肿瘤位于食管入口或环状软骨下缘至胸骨柄上缘平面之间,以病变中点判断位置,如中点上下长度均等,则以上段位置为准。②病理证实为SCC。③确诊后均计划行根治性放疗。④如CEC合并同时性胸段食管癌,因可同时行根治性放疗,可不排除。其中22例被排除:3例远处器官转移行减症姑息放疗,19例接受术前或术后放疗。其余97例满足入选条件,治疗前均完成系统病史采集、体格检查、血常规、生化全项、上消化道造影、上消化道内镜、颈胸部CT、颈部和腹部超声(如颈部淋巴结转移则可行细针穿刺细胞学检查)。此外,除非患者情况不允许或拒绝,局部晚期CEC患者均行气管镜检查。采用美国癌症联合会(AJCC) 2002版分期。治疗前均签署了放疗、化疗和/或靶向治疗知情同意书。97例CEC患者中位年龄59岁(18~78岁);初诊时营养良好、中等和不良患者的比例分别为63.92%、31.96%和4.12%;51.55%(50例)的患者吸烟,42.27%(41例)的患者嗜酒。表 1列出了患者其他临床基本特征。
|
|
表 1 97例患者一般特征和资料 Table 1 General characteristics of 97 patients |
2.治疗方式:结果示于图 1。由图 1可见,因肿瘤负荷大,为降低放疗局部损伤风险及远处转移风险,52/97例患者接受了诱导化疗(紫杉类+铂类)。46/97例接受了同步放化疗(concurrent chemoradiotherapy, CCRT, 包括:紫杉类±铂类,或铂类±氟尿嘧啶,或单药氟尿嘧啶)。5/97例采用了CCRT联合靶向治疗。9/97例接受了放疗同步抗表皮生长因子受体(EGFR)单抗靶向治疗。13例放疗后接受了铂类为基础的辅助化疗。
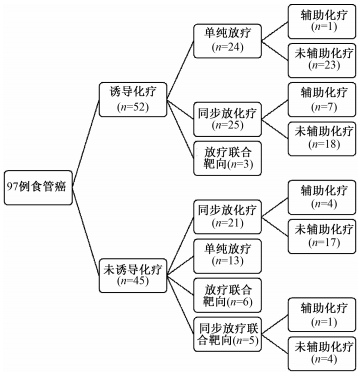
|
图 1 97例颈段食管癌患者治疗模式图 Figure 1 The treatment patterns of 97 patients with CEC |
患者采用仰卧位,头颈肩膜固定。CT定位层厚3 mm。除非患者情况不允许或拒绝,CT定位时使用静脉增强对比剂。将定位图像传至瓦里安计划系统中勾画靶区。大体肿瘤体积(gross tumor volume,GTV)包括所有临床查体、影像学检查和内镜检查可见的肿瘤病灶。分为原发灶GTV(GTVp)和阳性淋巴结GTV(GTVnd)两部分。阳性淋巴结定义:食管旁淋巴结短径≥5 mm,其他纵隔淋巴结短径≥10 mm,淋巴结包膜外侵犯,淋巴结明显坏死或强化,淋巴结成簇(≥3个),淋巴结PET图像SUVmax≥2.5,或细针穿刺细胞学确诊[7]。临床靶体积(clinical target volume,CTV)包括原发灶临床靶体积(CTVp)、阳性淋巴结所在引流区和其他有转移风险的淋巴引流区。CTVp由GTVp水平外扩5~10 mm,尾向外扩30~50 mm,头向外扩10~50 mm(根据病变位置及下咽是否受侵调整),并根据解剖屏障适当修改。选择性淋巴结照射(elective nodal irradiation,ENI)范围根据受累淋巴结数量和位置决定。计划靶体积(planning target volume,PTV)为CTV水平外扩5 mm,纵向外扩5~10 mm,并作解剖学修改。危及器官包括脊髓、腮腺、甲状腺、肺、心脏、喉、气管和颞下颌关节。
采用6~8 MV光子射线调强放疗。完成的95%PGTV处方剂量50~70 Gy,1.80~2.12 Gy/次,中位处方剂量66 Gy。完成的95%PTV处方剂量40~60 Gy,1.8~2.0 Gy/次,中位处方剂量56 Gy。1次/d,每周放疗5次。其中8例因不良反应或合并症完成的95%PGTV剂量低于60 Gy(≥3级放射性食管炎4例,心肌梗死1例,≥3级放射性肺炎3例)。
3.治疗失败定义:记录随访中的治疗失败和复发部位。治疗失败模式定义为:①局部失败为原发灶复发或进展。②区域失败为区域淋巴结复发(CEC区域淋巴结包括颈部+上纵隔淋巴结区;CEC侵犯胸上段食管,则还要包括中下纵隔淋巴结区;颈段和胸中/下段食管多原发癌,则包括颈部+纵隔+贲门、胃左至腹腔干淋巴结区)。③远处转移为血行播散至远处器官或组织,以及非区域淋巴结转移。
4.统计学处理:数据分析采用SPSS 19.0软件。无进展生存(progress free survival,PFS)时间从治疗第1天计算,至疾病进展或末次随访时间为止;总生存(overall survival,OS)时间从治疗第1天计算,至死亡或末次随访时间为止。Kaplan-Meier法计算生存率,并Log-rank法检验、Cox回归法进行预后因素分析。P < 0.05为差异有统计学意义。
结果1.治疗结果:中位随访时间为14.90个月。整体患者的中位PFS和OS分别为16.03和23.30个月。1、2、3年PFS分别为56.86%、30.35%和26.34%。1、2、3年OS分别为72.54%、47.94%和40.81%(图 2)。
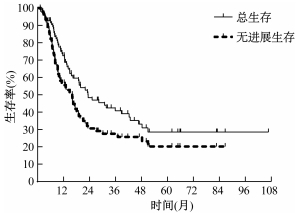
|
图 2 总生存和无进展生存Kaplan-Meier曲线 Figure 2 Kaplan-Meier curves of overall survival and progression free survival |
2.治疗失败模式:61例随访中发现治疗失败。其中40、27和18例分别发生局部复发、区域复发和远处转移。图 3给出了61例患者的失败模式。远处转移位置包括肺(12例),非区域淋巴结转移(7例)、骨(3例)、肝(3例)和胸腔积液(2例)。
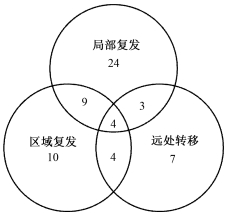
|
图 3 61例颈段食管癌患者治疗失败模式 Figure 3 Treatment failure patterns of 61 patients with CEC |
3.不良反应:1~2级急性不良反应最常见。3级急性黏膜炎、体表反应、放射性肺炎和白细胞减少发生率分别为5.15%、5.15%、4.12%和21.65%。4例放疗结束时发生瘘,31例(31.96%)接受营养干预,包括肠外营养、鼻胃管/空肠营养管管饲,或经皮胃造瘘/空肠造瘘。1例空肠造瘘术后因上消化道大出血死亡,2例因食管瘘感染死亡,另外1例因吸入性肺炎死亡。
4.预后因素:潜在预后因子包括年龄、性别、肿瘤范围、组织学分级、下咽是否受侵、气管是否受侵、甲状腺是否受侵、主动脉是否受侵、T分期、N分期、M分期、总分期、诱导化疗、CCRT±同步靶向治疗和大体肿瘤完成放疗剂量。分别评估各个潜在预后因子对PFS和OS的影响。表 2和表 3分别显示了单因素和多因素分析的结果。
|
|
表 2 97例颈段食管癌患者单因素分析 Table 2 Univariate analysis of 97 patients with CEC |
|
|
表 3 97例颈段食管癌患者多因素分析 Table 3 Multivariate analysis of 97 patients with CEC |
讨论
本研究中,97例CEC患者的1、2、3年PFS分别为56.86%、30.35%和26.34%,1、2、3年OS分别为72.54%、47.94%和40.81%。回顾总结各大肿瘤中心CEC研究的结果,其2、3、5年OS分别为35.0%~52.0%、29.0%~39.3%和18.6%~55.0%[8-16]。本研究的结果与其相似。
Tong等[3]报道了62例首选PLE手术和21例首选放化疗的CEC患者。PLE组和放化疗组的2年OS差异无统计学意义,分别为37.6%和46.9%。其他相关研究结果类似,手术治疗CEC的5年OS为24.0%~47.0%[17-23]。与根治性放疗CEC的5年OS基本持平(18.6%~ 55.0%)[8-16]。
Wang等[9]报道了35例接受CCRT且无远处转移的颈段或胸上段食管癌患者。放疗剂量为24.5~64.5 Gy,同步氟尿嘧啶为基础的化疗。放疗剂量≥50 Gy患者的CR率(79.2%)显著高于放疗剂量<50 Gy的患者(27.3%)。多因素分析中,放疗剂量是唯一1个OS、肿瘤特异生存和局部无复发生存的保护因素。Cao等[16]回顾性总结了115例接受根治性放疗的CEC患者数据。放疗剂量≥66 Gy患者的2年OS(55.6%)显著高于<66 Gy患者(37.5%)。本研究的多因素分析结果与其结果一致,均显示高剂量放疗可能增加OS获益。但是,仍有几项研究的数据不支持这一观点,结果显示高/低剂量放疗患者的5年OS和/或局部区域控制率差异并无统计学意义[13-14]。
Zhang等[15]的单因素分析结果显示,下咽受侵的CEC患者3年PFS和OS更差。但是Cao等[16]的研究结果显示,下咽受侵与预后并无关系。本研究中,单因素分析结果显示甲状腺受侵患者的PFS和OS更差,气管受侵与更差的OS相关,下咽受侵有可能是OS的另外一个不良预后因素。多因素分析结果显示主动脉是否受侵和甲状腺是否受侵是预后相关因素。因研究样本量有限和患者异质性,本研究并未得出肿瘤TNM分期高低与预后生存显著相关的结论。
本研究中淋巴结转移率高达88.7%,显著高于其他研究中的48.0%~68.8% [10, 12-13, 16]。此研究中最常见的淋巴结转移部位依次为ⅥB、Ⅳ、Ⅲ、Ⅱ区和上纵隔区,与相关报道数据一致[24-26]。基于CEC患者的高淋巴结转移率和转移范围广范性,大部分肿瘤中心仍采用ENI作为CEC放疗的基本原则[8-13, 15]。
本研究为单中心回顾性研究,样本量中等,发病率低研究时间跨度大,影响因素多,数据分析结果仅作为参考。CEC患者的复发模式和相关预后因素还需更大的数据库或前瞻性临床试验进行验证。
综上所述,本研究对接受根治性放疗的CEC患者进行复发模式和生存预后分析,发现治疗失败以局部区域复发为主,甲状腺受侵、气管受侵和主动脉受侵是预后不良因素,大体肿瘤放疗剂量≥66 Gy可能利于提高OS,但仍需大型前瞻研究证实。
利益冲突 无作者贡献声明 赵丹负责整理资料、采集和分析数据、起草论文;郑宝敏负责分析数据、指导修改论文;肖绍文、蔡勇、李永恒、朱向高、余荣、于会明、石安辉负责数据采集和协助论文修改;徐晓龙负责采集和分析数据、实施研究;王维虎、孙艳负责研究设计、数据分析以及论文修改
| [1] |
Rice TW, Ishwaran H, Ferguson MK, et al. Cancer of the esophagus and esophagogastric junction:an Eighth edition staging primer[J]. J Thorac Oncol, 2017, 12(1): 36-42. DOI:10.1016/j.jtho.2016.10.016 |
| [2] |
Lee DJ, Harris A, Gillette A, et al. Carcinoma of the cervical esophagus:diagnosis, management, and results[J]. South Med J, 1984, 77(11): 1365-1367. DOI:10.1097/00007611-198411000-00004 |
| [3] |
Tong DK, Law S, Kwong DL, et al. Current management of cervical esophageal cancer[J]. World J Surg, 2011, 35(3): 600-607. DOI:10.1007/s00268-010-0876-7 |
| [4] |
Peracchia A, Bonavina L, Botturi M, et al. Current status of surgery for carcinoma of the hypopharynx and cervical esophagus[J]. Dis Esophagus, 2001, 14(2): 95-97. DOI:10.1046/j.1442-2050.2001.00163.x |
| [5] |
Ajani JA, D'Amico TA, Almhanna K, et al. Esophageal and esophagogastric junction cancers, version 1.2015[J]. J Natl Compr Canc Netw, 2015, 13(2): 194-227. DOI:10.6004/jnccn.2015.0028 |
| [6] |
白文文, 周志国, 宋玉芝, 等. 颈段食管癌三维适形与调强放疗的剂量学及临床对比研究[J]. 中华放射医学与防护杂志, 2014, 34(12): 919-921. Bai WW, Zhou ZG, Song YZ, et al. The dosimetric and clinical comparison of 3D-CRT and IMRT for patients with cervical esophageal carcinoma[J]. Chin J Radiol Med Prot, 2014, 34(12): 919-921. DOI:10.3760/cma.j.issn.0254-5098.2014.12.010 |
| [7] |
Sgourakis G, Gockel I, Lyros O, et al. Detection of lymph node metastases in esophageal cancer[J]. Expert Rev Anticancer Ther, 2011, 11(4): 601-612. DOI:10.1586/era.10.150 |
| [8] |
Burmeister BH, Dickie G, Smithers BM, et al. Thirty-four patients with carcinoma of the cervical esophagus treated with chemoradiation therapy[J]. Arch Otolaryngol Head Neck Surg, 2000, 126(2): 205-208. DOI:10.1001/archotol.126.2.205 |
| [9] |
Wang S, Liao Z, Chen Y, et al. Esophageal cancer located at the neck and upper thorax treated with concurrent chemoradiation:a single-institution experience[J]. J Thorac Oncol, 2006, 1(3): 252-259. DOI:10.1016/S1556-0864(15)31576-8 |
| [10] |
Yamada K, Murakami M, Okamoto Y, et al. Treatment results of radiotherapy for carcinoma of the cervical esophagus[J]. Acta Oncol, 2006, 45(8): 1120-1125. DOI:10.1080/02841860600609768 |
| [11] |
Uno T, Isobe K, Kawakami H, et al. Concurrent chemoradiation for patients with squamous cell carcinoma of the cervical esophagus[J]. Dis Esophagus, 2007, 20(1): 12-18. DOI:10.1111/j.1442-2050.2007.00632.x |
| [12] |
Huang SH, Lockwood G, Brierley J, et al. Effect of concurrent high-dose cisplatin chemotherapy and conformal radiotherapy on cervical esophageal cancer survival[J]. Int J Radiat Oncol Biol Phys, 2008, 71(3): 735-740. DOI:10.1016/j.ijrobp.2007.10.022 |
| [13] |
Gkika E, Gauler T, Eberhardt W, et al. Long-term results of definitive radiochemotherapy in locally advanced cancers of the cervical esophagus[J]. Dis Esophagus, 2014, 27(7): 678-684. DOI:10.1111/dote.12146 |
| [14] |
Ludmir EB, Palta M, Zhang X, et al. Incidence and prognostic impact of high-risk HPV tumor infection in cervical esophageal carcinoma[J]. J Gastrointest Oncol, 2014, 5(6): 401-407. DOI:10.3978/j.issn.2078-6891.2014.053 |
| [15] |
Zhang P, Xi M, Zhao L, et al. Clinical efficacy and failure pattern in patients with cervical esophageal cancer treated with definitive chemoradiotherapy[J]. Radiother Oncol, 2015, 116(2): 257-261. DOI:10.1016/j.radonc.2015.07.011 |
| [16] |
Cao C, Luo J, Gao L, et al. Definitive radiotherapy for cervical esophageal cancer[J]. Head Neck, 2015, 37(2): 151-155. DOI:10.1002/hed.23572 |
| [17] |
Miyata H, Yamasaki M, Takahashi T, et al. Larynx-preserving limited resection and free jejunal graft for carcinoma of the cervical esophagus[J]. World J Surg, 2013, 37(3): 551-557. DOI:10.1007/s00268-012-1875-7 |
| [18] |
Sun F, Li X, Lei D, et al. Surgical management of cervical esophageal carcinoma with larynx preservation and reconstruction[J]. Int J Clin Exp Med, 2014, 7(9): 2771-2778. |
| [19] |
Ott K, Lordick F, Molls M, et al. Limited resection and free jejunal graft interposition for squamous cell carcinoma of the cervical oesophagus[J]. Br J Surg, 2009, 96(3): 258-266. DOI:10.1002/bjs.6437 |
| [20] |
Daiko H, Hayashi R, Saikawa M, et al. Surgical management of carcinoma of the cervical esophagus[J]. J Surg Oncol, 2007, 96(2): 166-172. DOI:10.1002/jso.20795 |
| [21] |
Triboulet JP, Mariette C, Chevalier D, et al. Surgical management of carcinoma of the hypopharynx and cervical esophagus:analysis of 209 cases[J]. Arch Surg, 2001, 136(10): 1164-1170. DOI:10.1001/archsurg.136.10.1164 |
| [22] |
Jiang M, He X, Wu D, et al. Reconstruction techniques for hypopharyngeal and cervical esophageal carcinoma[J]. J Thorac Dis, 2015, 7(3): 449-454. DOI:10.3978/j.issn.2072-1439.2015.02.12 |
| [23] |
Wang HW, Chu PY, Kuo KT, et al. A reappraisal of surgical management for squamous cell carcinoma in the pharyngoesophageal junction[J]. J Surg Oncol, 2006, 93(6): 468-476. DOI:10.1002/jso.20472 |
| [24] |
Hirano S, Nagahara K, Moritani S, et al. Upper mediastinal node dissection for hypopharyngeal and cervical esophageal carcinomas[J]. Ann Otol Rhinol Laryngol, 2007, 116(4): 290-296. DOI:10.1177/000348940711600413 |
| [25] |
Martins AS. Neck and mediastinal node dissection in pharyngolaryngoesophageal tumors[J]. Head Neck, 2001, 23(9): 772-779. DOI:10.1002/(ISSN)1097-0347 |
| [26] |
Timon CV, Toner M, Conlon BJ. Paratracheal lymph node involvement in advanced cancer of the larynx, hypopharynx, and cervical esophagus[J]. Laryngoscope, 2003, 113(9): 1595-1599. DOI:10.1097/00005537-200309000-00035 |
 2019, Vol. 39
2019, Vol. 39


