食管癌是一种消化系统恶性肿瘤,放射治疗是食管癌治疗的重要手段,多年以来,食管癌的治疗虽然取得了一定的成效,但是其5年内的生存率仍然低于15%,由于放射治疗常常伴随有不良反应,导致很多患者不能耐受放射治疗,增加食管癌放射敏感性是目前医学工作者研究的重点[1-3]。端粒酶与肿瘤的发生有关,超过90%的肿瘤细胞发现有端粒酶活性,而在正常的细胞中几乎没有端粒酶活性,端粒酶抑制因子X1(PinX1)是端粒酶活性的抑制因子,能够抑制细胞中端粒酶的活性,也被认为是一种重要的抑肿瘤因子,在肝癌、结直肠癌、白血病、胃癌等多种癌症中均发现PinX1表达下调甚至缺失,其可以影响多种肿瘤细胞的生长和凋亡[4-8]。本研究旨在探讨PinX1在食管癌细胞增殖、凋亡及放射敏感性中的作用,为以后靶向PinX1提高食管癌放射敏感性提供基础。
材料与方法1.材料:食管癌EC9706细胞购自美国ATCC公司;SYBR Premix Ex TaqⅡ Kit购自大连宝生物工程有限公司;Lipofectamine 2000购自美国Invitrogen公司;RNA提取试剂盒购自北京天根生化科技;pDsRed1-PinX1由上海鲁汶生物科技有限公司实验室构建保存;活性氧(ROS)含量测定试剂盒购自上海翊圣公司;剪切的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved Caspase-3)抗体、PinX1抗体、剪切的含半胱氨酸的天冬氨酸蛋白水解酶9(Cleaved Caspase-9)抗体购自美国Santa Cruz公司;GAPDH抗体购自美国Origene公司;HRP标记的二抗购自上海生工生物工程股份有限公司。
2.细胞转染、分组及照射:取转染pDsRed1-PinX1和pDsRed1的细胞记为pDsRed1-PinX1组和pDsRed1组。把未做细胞转染的EC9706细胞记为对照组。取过表达PinX1的食管癌EC9706细胞用8 Gy X射线剂量照射处理以后,记为照射组+PinX1。把过表达PinX1后的食管癌EC9706细胞记为PinX1组。用未做转染的食管癌EC9706细胞经8 Gy X射线剂量照射处理以后记为照射组。裸鼠成瘤实验中每组20只裸鼠。
细胞转染用Lipofectamine 2000,步骤同说明书。细胞在转染后2 d,用荧光定量PCR和Western blot方法检测转染以后的细胞中PinX1的水平。
照射方法为:6 MV X射线,吸收剂量率为300 cGy/min,源皮距为100 cm。用四甲基偶氮唑盐(MTT)、流式细胞术、2′, 7′-二氯荧光黄双乙酸盐(DCFH-DA)法、Western blot检测对照组、照射组、PinX1组、照射+PinX1组细胞培养2 d后细胞增殖、凋亡、ROS及细胞中Cleaved Caspase-3和Cleaved Caspase-9蛋白表达,集落形成实验测定放射敏感性。
3.荧光定量PCR检测PinX1水平:将对照组、pDsRed1组、pDsRed1-PinX1组细胞用细胞总RNA提取试剂盒提取RNA。取RNA,反转录合成cDNA,进行定量PCR,用2-△△Ct计算细胞中PinX1水平。
4. Western blot检测PinX1水平:收集对照组、pDsRed1组、pDsRed1-PinX1组细胞,提取细胞中的总蛋白,步骤同试剂盒说明书。按照每个泳道添加40 μg蛋白样品进行电泳,在积层胶中以90 V电压电泳,在分离胶中用120 V电压电泳。转膜(4℃,90 V,转膜2 h)、封闭(5%牛血清白蛋白室温孵育2 h)、免疫反应(1 :600稀释一抗在4℃过夜后,与1 :2 000稀释的二抗在室温孵育2 h)。电化学发光(ECL)化学发光以后,目的条带定量分析用Image J软件,内参为GAPDH。
5. MTT检测细胞存活情况:将对照组、照射组、PinX1组、照射+PinX1组细胞种植到96孔板内,在每个孔内加入MTT溶液10 μl,放在细胞培养箱内孵育4 h。把孔内的上清液吸掉,加入二甲基亚砜(DMSO),测定570 nm的吸光度值(A值),用不加细胞的孔调零,计算细胞存活率。细胞存活率(%)=实验A/对照A×100%
6.流式细胞术检测细胞凋亡:对照组、照射组、PinX1组、照射+PinX1组细胞中加入400 μl的结合缓冲液,再依次加入PI和Annexin V-FITC各5 μl,混合后,立即用流式细胞仪检测。
7. DCFH-DA法测定ROS水平:对照组、照射组、PinX1组、照射+PinX1组细胞用DCFH-DA法检测食管癌细胞中ROS水平,结果以细胞中DCF荧光强度表示ROS水平(流式细胞仪激发光为氩离子激光488 nm谱线),步骤同试剂盒说明书。
8. Western blot检测Cleaved Caspase-3和Cleaved Caspase-9蛋白水平:对照组、照射组、PinX1组、照射+PinX1组细胞用Western blot法测定细胞中Cleaved Caspase-3和Cleaved Caspase-9蛋白水平,具体操作方法同上。
9.集落形成实验测定放射敏感性:对照组、照射组细胞培养10 d以后,观察有细胞集落形成。以甲醇固定以后,用姬姆萨染色后,观察≥50个细胞集落数目。计算集落形成率(plating efficiency, PE)、细胞存活分数(surrival fraction, SF)。PE=集落数目/接种细胞时的数目;SF=照射剂量的PE/没有照射的PE。用单击多靶模型拟合存活曲线,计算出D0、Dq、N、SF2、k放射敏感性的参数值,计算放射增敏比(SER)。
10.异种移植小鼠模型中PinX1过表达与放射敏感性的关系:构建EC9706细胞致裸鼠皮下移植瘤模型。健康雌性裸鼠40只,6周龄,体重20 g,每组20只,在饲养温度(22±1) ℃的恒温条件下遵循12 h光/12 h暗循环,对投喂的食物和水进行消毒。取对数生长期的5×103 EC9706细胞,用计数器离心,悬浮于1 ml(0.01 mol/L,pH7.2)的磷酸缓冲盐溶液(PBS)中。每只小鼠注射转染pDsRed1-PinX1和pDsRed1的细胞悬液0.2 ml(约1×103细胞),每组20只,生长14 d后,计算肿瘤体积。每组小鼠每4天接受5次8 Gy剂量的局部照射(60 Co γ射线),转染组小鼠在照射前转染含PinX1质粒24 h,于第36天处死小鼠,切除肿瘤、称重、照相,取部分肿瘤作石蜡包埋,其余部分保存于-80℃。
11.统计学处理:采用SPSS 21.0软件进行分析。计量资料符合正态分布,用x±s表示。两组数据比较采用独立样本t检验,多组差异比较经方差齐性检验后采用单因素方差分析,组间比较采用LSD-t检验。P < 0.05为差异有统计学意义。
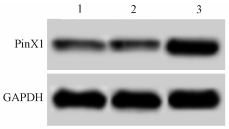
结果1.转染以后的食管癌细胞中PinX1的表达:从图 1和表 1中可以看出,转染pDsRed1后的食管癌细胞中PinX1 mRNA和蛋白水平与没有转染的对照组细胞相比,差异无统计学意义(P>0.05)。转染pDsRed1-PinX1后的食管癌细胞中PinX1 mRNA和蛋白水平与没有转染的对照组细胞相比明显升高,差异有统计学意义(t=15.563、8.461,P < 0.05)。pDsRed1-PinX1提高了食管癌细胞中PinX1的表达水平,而pDsRed1对食管癌细胞中PinX1表达没有影响。
|
图 1 Western blot测定食管癌细胞中PinX1蛋白表达 注:1.对照组;2. pDsRed1组;3. pDsRed1-PinX1组 Figure 1 Determination of PinX1 protein expression in esophageal cancer cells by Western blot |
|
|
表 1 转染PinX1过表达载体以后的各组细胞中PinX1 mRNA和蛋白水平(x±s) Table 1 The levels of PinX1 mRNA and protein in the cells after transfection of PinX1 vector(x±s) |
2. PinX1协同放射抑制食管癌细胞增殖:对照组、照射组、PinX1组、照放射+PinX1组细胞存活率依次为:100%、(67.92±4.71)%、(83.14±4.01)%、(52.73±5.58)%。照射组、PinX1组、照射+PinX1组细胞存活率明显低于对照组,差异有统计学意义(t=9.433、4.957、13.899,P < 0.05)。照射+PinX1组细胞存活率明显低于照射组、PinX1组,差异有统计学意义(t=4.466、8.942,P < 0.05)。PinX1降低食管癌细胞存活率,并且可以协同放射抑制食管癌细胞增殖。
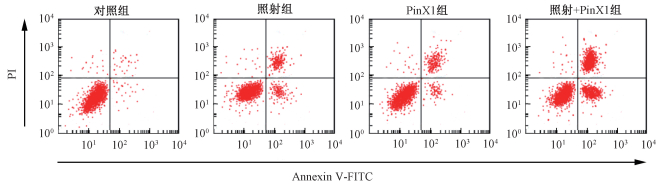
3. PinX1协同放射诱导食管癌细胞凋亡:结果列于表 2。从图 2、图 3和表 2中可以看出,照射组、PinX1组、照射+PinX1组细胞凋亡率、ROS水平、Cleaved Caspase-3和Cleaved Caspase-9蛋白水平明显高于对照组,差异有统计学意义(t=12.882、6.439、16.589、11.246、6.816、15.449、6.655、2.531、22.090、3.775、3.088、21.078,P < 0.05)。照射+PinX1组细胞凋亡率、ROS水平、Cleaved Caspase-3和Cleaved Caspase-9蛋白水平明显高于照射组、PinX1组,差异有统计学意义(照射组:t=3.707、4.203、15.435、17.304,P < 0.05;PinX1组:t=10.150、8.633、19.599、17.990, P < 0.05)。PinX1协同放射诱导食管癌细胞凋亡和Caspase-3、Caspase-9活化,促进细胞中ROS合成。
|
|
表 2 各组细胞中Cleaved Caspase-3和Cleaved Caspase-9蛋白水平比较(x±s) Table 2 Comparison of Cleaved Caspase-3 and Cleaved Caspase-9 protein levels in each group of cells(x±s) |
|
图 2 PinX1和X射线照射对食管癌细胞凋亡的影响 Figure 2 Effects of PinX1 transfection and X-ray radiation on apoptosis of esophageal cancer cells |

|
图 3 Western blot检测各组细胞中Cleaved Caspase-3和Cleaved Caspase-9蛋白水平 注:1.对照组;2.照射组;3.PinX1组;4.照射+PinX1组 Figure 3 Western blot assay of the Cleaved Caspase-3 and Cleaved Caspase-9 protein level in each group of cells |
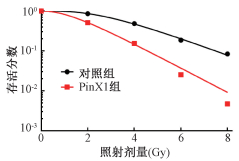
4. PinX1增加食管癌细胞的放射敏感性:结果列于图 4和表 3,食管癌细胞中过表达PinX1可以降低细胞的存活分数,增加食管癌细胞放射敏感性,增敏比为1.408。
|
图 4 食管癌细胞经放射处理以后的细胞存活曲线 Figure 4 Cell survival curves of esophageal cancer cells after radiation treatment |
|
|
表 3 单击多靶模型参数值 Table 3 The parameter values of cell survival curves stimulated by the single-hit multi-target model |
5.异种移植小鼠模型中PinX1过表达与放射敏感性的关系:过表达PinX1的小鼠肿瘤体积由(102.6±53.8) mm3降低至(33.7±16.2) mm3。
讨论PinX1参与调控端粒酶及端粒生物学功能,其基因定位在8q23,而8q23是一个容易发生缺失、杂合的区域,其编码的蛋白质是一个重要的端粒酶抑制因子[9]。PinX1在肿瘤中异常表达,并且与肿瘤的淋巴转移、恶性程度、患者预后等有关,PinX1水平越低,患者的预后越差[10-11]。目前研究显示,PinX1在宫颈癌、肾癌、膀胱癌等肿瘤中表达下调,提高其表达后,乳腺癌、鼻咽癌等癌细胞的生长受到抑制[12-16]。在食管癌中的研究表明,食管正常组织、增生组织和食管癌组织中PinX1的表达水平依次减小,并且与食管癌的病理分期呈负相关,PinX1在淋巴结转移患者中的表达水平低于无淋巴结转移患者,PinX1可能是一种潜在的食管癌基因,其表达水平的高低在食管癌恶性程度、预后评估中具有重要价值[17-19]。PinX1不仅可以调控癌细胞的生长凋亡等过程,还可以增加癌细胞对抗肿瘤药物的敏感性, 目前较多研究认为PinX1在食管癌中表达下调,PinX1具有增加肿瘤细胞化疗药物敏感性的作用[17];但也有研究表明,PinX1在食管癌中的表达水平升高,与肿瘤细胞化疗药物敏感性无关,这可能与不同的肿瘤组织有关[19-21]。本研究结果显示,PinX1表达上调后的食管癌细胞的存活率下降,并且其凋亡率也升高,说明PinX1具有诱导癌细胞凋亡抑制癌细胞生长的作用,这提示PinX1具有抑制食管癌细胞作用。
细胞凋亡的发生是细胞内一系列信号转导以后,经过特定的基因调控而诱发的主动性死亡,线粒体途径和死亡受体途径是目前公认的引起细胞凋亡的两大途径[22]。ROS是存在于细胞内的调控因子,在正常细胞代谢过程中产生,能够维持细胞内氧化平衡,参与细胞内信号转导过程,过量的ROS可以直接与线粒体膜蛋白作用,影响线粒体膜的通透性,导致细胞内凋亡因子、细胞色素C等异常,诱导细胞凋亡的发生[23]。影响细胞凋亡的重要蛋白家族在正常的细胞内是以没有活性的形式存在,当Caspase凋亡反应发生时其受到外界因素的刺激以后可以被激活,诱导细胞凋亡发生,Caspase-9位于该级联反应的上游,而Caspase-3位于该级联反应的下游,是重要的凋亡调节因子[24]。本研究结果显示,PinX1表达上调后的食管癌细胞中Caspase-3和Caspase-9的活化水平升高,并且细胞中ROS水平升高,提示PinX1可以通过激活Caspase级联反应和提高细胞内ROS水平诱导食管癌细胞凋亡。
提高肿瘤细胞放射敏感性是提高肿瘤治愈率的重要途径,早期的研究显示,化疗药物、亲电子性药物等可以在体外增加肿瘤细胞的放射敏感性,而这些药物不良反应较大、效果不理想[25]。随着研究的不断深入,发现靶基因提高放射敏感性是一种高效低毒的放射增敏剂,p53等基因是目前研究较为透彻的放射敏感性靶基因[26]。目前对于PinX1在肿瘤细胞细胞生长及放化疗敏感性的报道不一,较多研究显示,PinX1发挥抑癌基因作用[17-18];也有研究报道显示PinX1发挥癌基因作用[27-29]。Qian等[21]研究显示,敲低PinX1表达可以抑制食管癌细胞生长,提高癌细胞对辐射的敏感性,而对化疗药物等敏感性没有影响,在王洪斌[20]PinX1高表达可以提高肿瘤的化疗敏感性。本实验的结果显示,PinX1表达升高后的食管癌细胞经放射处理以后的细胞凋亡率更高,并且细胞对放射的敏感性增加,提示PinX1可能是一种潜在的靶基因放射增敏剂,这与Qian等[21]的研究结果不同,这可能与肿瘤细胞株不同及细胞生长状态等有关。
此外,本研究采用EC9706细胞一种细胞系实施实验,主要考虑EC9706细胞株是最常用的食管癌细胞株,且其放射敏感性比较适中。实验中所用的食管癌细胞株还包括TE-10细胞与kyse-150细胞。有研究发现,TE-10细胞对放射的敏感性比kyse-150细胞显著。由于细胞株对放射的敏感程度过高或者过低都不适合实施放射敏感实验,故EC9706细胞是放射敏感性机制最常用的细胞株[30-32]。
综上表明,PinX1具有抗肿瘤作用,可以在体外诱导食管癌细胞的凋亡,增加食管癌细胞放射敏感性,其作用机制与细胞内ROS和Caspase凋亡反应有关,这为提高食管癌放疗敏感性提供了新思路,为以后研究PinX1在食管癌发病机制中的作用奠定了基础,在以后的实验中会对PinX1在多株食管癌细胞及体内进行验证和探讨。
利益冲突 无作者贡献声明 刘杨负责酝酿和设计实验、实施研究、采集和分析数据、撰写论文;蒋月负责酝酿和设计实验,指导论文撰写;毛荣虎负责实验所用仪器与设备的调试和维修;卢令聪参与分析数据;杨原源参与酝酿和设计实验
| [1] |
Pan P, Yang BX, Ge XL. Brucea javanica seed oil enhances the radiosensitivity of esophageal cancer by inhibiting hypoxia-inducible factor 1α, in vitro and in vivo[J]. Oncol Lett, 2018, 15(3): 3870-3875. DOI:10.3892/ol.2018.7779 |
| [2] |
Chen GZ, Dai WS, Zhu HC, et al. Foretinib enhances the radiosensitivity in esophageal squamous cell carcinoma by inhibiting phosphorylation of c-Met:[J]. J Cancer, 2017, 8(6): 983-992. DOI:10.7150/jca.18135 |
| [3] |
Zhou ZG, Zhen CJ, Bai WW, et al. Salvage radiotherapy in patients with local recurrent esophageal cancer after radical radiochemotherapy[J]. Radiat Oncol, 2015, 27(10): 54-58. DOI:10.1097/MD.0000000000009777 |
| [4] |
许侨东, 颜永聪, 黄拼搏, 等. 原发性肝细胞肝癌中PinX1的表达及其临床意义[J]. 岭南现代临床外科, 2016, 16(2): 223-227. Xu QD, Yan YC, Huang PB, et al. The mRNA expression of PinX1 in hepatocellular carcinoma tissues and its clinical significance[J]. Lingnan Mod Clin Surg, 2016, 16(2): 223-227. DOI:10.3969/j.issn.1009-976X.2016.02.025 |
| [5] |
Zhang R, Zhao J, Wang X, et al. PinX1 without the G-patch motif suppresses proliferation, induces senescence, but does not inhibit telomerase activity in colorectal cancer SW480 cells[J]. Oncol Rep, 2014, 32(1): 286-292. DOI:10.3892/or.2014.3199 |
| [6] |
Zhang L, Jiang Y, Zheng Y, et al. Selective killing of Burkitt's lymphoma cells by mBAFF-targeted delivery of PinX1[J]. Leukemia, 2011, 25(2): 331-340. DOI:10.1038/leu.2010.261 |
| [7] |
Ma Y, Wu L, Liu C, et al. The correlation of genetic instability of PINX1, gene to clinico-pathological features of gastric cancer in the Chinese population[J]. J Cancer Res Clin Oncol, 2009, 135(3): 431-437. DOI:10.1007/s00432-008-0471-6 |
| [8] |
Chen GZ, Zhu HC, Dai WS, et al. The mechanisms of radioresistance in esophageal squamous cell carcinoma and current strategies in radiosensitivity[J]. J Thorac Dis, 2017, 9(3): 849-859. DOI:10.21037/jtd.2017.03.23 |
| [9] |
Zhao H, Cao Y, Wang G, et al. Expression of FOXC2, PinX1, Ki-67 and Cyclin D1 in cutaneous cell carcinoma[J]. Oncol Lett, 2017, 14(1): 635-638. DOI:10.3892/ol.2017.6244 |
| [10] |
Zhao H, Cao Y, Wang G, et al. Expression of FOXC2, PinX1, Ki-67 and Cyclin D1 in cutaneous cell carcinoma[J]. Oncol Lett, 2017, 14(1): 635-638. DOI:10.3892/ol.2017.6244 |
| [11] |
王会刚. PinX1基因靶向端粒酶抑制鼻咽癌干细胞及其TRFs调控机制的研究[D].广州: 南方医科大学, 2017. Wang HG. PinX1 gene targeting telomerase inhibits nasopharyngeal carcinoma stem cells and the regulatory mechanism of TRFs[D]. Guangzhou: Southern Medical University, 2017. |
| [12] |
冯峰, 洪宝发, 王晓雄, 等. PinX1基因在肾癌组织的表达及临床意义[J]. 泌尿外科杂志(电子版), 2010, 2(3): 13-18. Feng F, Hong BF, Wang XX, et al. Expression of PinX1 gene in renal cell carcinoma and the clinical significance[J]. J Urol Clin (Elect Vers), 2010, 2(3): 13-18. DOI:10.3969/j.issn.1674-7410.2010.03.004 |
| [13] |
Liu JY, Qian D, He LR, et al. PinX1 suppresses bladder urothelial carcinoma cell proliferation via the inhibition of telomerase activity and p16/cyclin D1 pathway[J]. Mol Cancer, 2013, 12(1): 148-162. DOI:10.1186/1476-4598-12-148 |
| [14] |
吴庚泽.端粒酶抑制因子PinX1在宫颈癌中的变异情况分析及HPV16E6对PinX1表达的影响[D].重庆: 第三军医大学, 2011. Wu GZ.Variation of telomerase inhibitor PinX1 in cervical cancer and the effect of HPV16E6 on PinX1 expression[D].Chongqing: Third Military Medical University, 2011. |
| [15] |
Feng YZ, Zhang QY, Fu MT, et al. Low expression of PinX1 is associated with malignant behavior in basal-like breast cancer[J]. Oncol Rep, 2017, 38(1): 109-119. DOI:10.3892/or.2017.5696 |
| [16] |
Lai XF, Shen CX, Wen Z, et al. PinX1 regulation of telomerase activity and apoptosis in nasopharyngeal carcinoma cells[J]. J Exp Clin Cancer Res, 2012, 31(1): 12-23. DOI:10.1186/1756-9966-31-12 |
| [17] |
左静, 王大虎, 张祥宏, 等. PinX1在食管鳞状细胞癌中的表达及其与临床病理特征的关系[J]. 中国老年学杂志, 2012, 32(2): 259-260. Zuo J, Wang DH, Zhang XH, et al. PinX1 expression in esophageal squamous cell carcinoma and its relationship with clinicopathological features[J]. Gerontology China, 2012, 32(2): 259-260. DOI:10.3969/j.issn.1005-9202.2012.02.017 |
| [18] |
Zuo J, Wang DH, Zhang YJ, et al. Expression and mechanism of PinX1 and telomerase activity in the carcinogenesis of esophageal epithelial cells[J]. Oncol Rep, 2013, 30(4): 1823-1831. DOI:10.3892/or.2013.2649 |
| [19] |
樊祥奎.端粒酶催化亚基和PinX1基因在食管癌治疗中的生物学意义[D].济南: 山东大学, 2014. Fan XK.Biological Significance of telomerase catalytic subunit and prix1 gene in the treatment of esophageal cancer[D].Jinan: Shandong University, 2014. |
| [20] |
王洪斌. PinX1抑制胃癌细胞增殖、增强其对5-FU敏感性及机制研究[D].重庆: 第三军医大学, 2009. Wang HB.PinX1 inhibits the proliferation of gastric cancer cells and enhances their sensitivity to 5-FU[D]. Chongqing: Third Military Medical University, 2009. |
| [21] |
Qian D, Zhang B, He LR, et al. The telomere/telomerase binding factor PinX1 is a new target to improve the radiotherapy effect of oesophageal squamous cell carcinomas[J]. J Pathol, 2013, 229(5): 765-774. DOI:10.1002/path.4163 |
| [22] |
Appierto V, Tiberio P, Villani MG, et al. PLAB induction in fenretinide-induced apoptosis of ovarian cancer cells occurs via a ROS-dependent mechanism involving ER stress and JNK activation[J]. Carcinogenesis, 2009, 30(5): 824-831. DOI:10.1093/carcin/bgp067 |
| [23] |
Moon DO, Kim MO, Choi YH, et al. Butein induces G2/M phase arrest and apoptosis in human hepatoma cancer cells through ROS generation[J]. Cancer Lett, 2010, 288(2): 204-213. DOI:10.1016/j.canlet.2009.07.002 |
| [24] |
Moungjaroen J, Nimmannit U, Callery PS, et al. Reactive oxygen species mediate caspase activation and apoptosis induced by lipoic acid in human lung epithelial cancer cells through Bcl-2 down-regulation[J]. J Pharmacol Exp Ther, 2006, 319(3): 1062-1069. DOI:10.1124/jpet.106.110965 |
| [25] |
Goel A, Aggarwal BB. Curcumin, the golden spice from Indian saffron, is a chemosensitizer and radiosensitizer for tumors and chemoprotector and radioprotector for normal organs[J]. Nutr Cancer, 2010, 62(7): 919-930. DOI:10.1080/01635581.2010.509835 |
| [26] |
Chen X, Wong P, Radany E, et al. HDAC inhibitor, valproic acid, induces p53-dependent radiosensitization of colon cancer cells[J]. Cancer Biother Radiopharm, 2009, 24(6): 689-699. DOI:10.1089/cbr.2009.0629 |
| [27] |
Deng W, Jiao N, Li N, et al. Decreased expression of PinX1 protein predicts poor prognosis of colorectal cancer patients receiving 5-FU adjuvant chemotherapy[J]. Biomed Pharmacother, 2015, 73(6): 1-5. DOI:10.1016/j.biopha.2015.04.011 |
| [28] |
Fan XK, Yan RH, Geng XQ, et al. Biological significance of PinX1 telomerase inhibitor in esophageal carcinoma treatment[J]. Exp Ther Med, 2016, 12(4): 2196-2200. DOI:10.3892/etm.2016.3561 |
| [29] |
Li JP, Zhu SW, Chen YH, et al. Suppression of PinX1 resulted in telomere dysfunction and enhanced radiosensitivity in osteosarcoma cell lines[J]. Neoplasma, 2015, 62(6): 887-893. DOI:10.4149/neo_2015_108 |
| [30] |
Zhao L, He LR, Xi M, et al. Nimotuzumab promotes radiosensitivity of EGFR-overexpression esophageal squamous cell carcinoma cells by upregulating IGFBP-3[J]. J Transl Med, 2012, 10: 249. DOI:10.1186/1479-5876-10-249 |
| [31] |
Ogawa R, Ishiguro H, Kuwabara Y, et al. Identification of candidate genes involved in the radiosensitivity of esophageal cancer cells by microarray analysis[J]. Dis Esophagus, 2008, 21(4): 288-297. DOI:10.1111/j.1442-2050.2007.00759.x |
| [32] |
Huang S, Li XQ, Chen X, et al. Inhibition of microRNA-21 increases radiosensitivity of esophageal cancer cells through phosphatase and tensin homolog deleted on chromosome 10 activation[J]. Dis Esophagus, 2013, 26(8): 823-831. DOI:10.1111/j.1442-2050.2012.01389.x |
 2019, Vol. 39
2019, Vol. 39


