CT门静脉造影是一种非侵入性成像技术,能够在一次扫描中轻松覆盖整个腹部,是评估门静脉高压患者侧支循环的常规方法[1-3]。传统门静脉造影扫描中,一般采用注射大量对比剂的方法以提高门静脉的显示效果[4-5],然而对比剂的注入提高了对比剂肾病发生的风险[6]。近年来,能谱CT技术被广泛应用于临床,其不仅提供物质分离的图像,还能产生从40~140 keV的多组单能量图像,在低能量范围内,由于对比度的提高[7-9],可减少对比剂用量而得到相似强化效果的图像。但由于低能量X射线能谱中光子数量减少,图像噪声会相应地增加[10],自适应迭代重建算法(ASIR)联合最佳单能量图像,可以有效地降低图像噪声,并充分利用低能量范围内增加的对比度[8, 11]。以往文献中能谱扫描协议设置并非基于个体化原理,与传统CT相比,显示出相似甚至更高的辐射剂量[10, 12-14]。自动能谱协议选择(automatic spectral imaging mode selection,ASIS)技术可以根据患者的体型和图像质量需求个性化患者的辐射剂量和扫描参数。本研究采用自动能谱协议选择技术结合自适应迭代重建算法技术探讨其在双低门静脉造影中的可行性。
资料与方法1.研究对象:回顾性搜集2017年1—4月武汉协和医院完成上腹部增强扫描的患者120例。入选标准:①无肝脏、脾脏及消化道手术史。②无心功能障碍影响血液循环。排除标准:①对碘对比剂过敏。②甲状腺功能亢进。③孕妇、孕龄期妇女、儿童等对射线敏感者。所有入选患者男80例,女40例,年龄19~87岁, 平均(51.9±12.4)岁,体质量49~97 kg, 平均(67.12±9.92)kg。
2.检查方法:将120例患者按扫描方案分为A、B、C 3组,每组40例。A、B、C 3组性别、年龄和体质量差异均无统计学意义(P>0.05),具有可比性。所有患者均采用美国GE Discovery CT机行上腹部增强扫描,扫描范围膈顶至双肾下极。A组采用常规扫描模式,管电压120 kVp,自动管电流调制技术,噪声指数10 HU,X射线管转速0.7 s/转,扫描野36 cm×36 cm,探测器宽度40 mm,螺距1.375,扫描层厚、层间距均为5 mm。对比剂采用非离子型对比剂碘海醇(优维显,300 mgI/ml,德国拜耳公司)。对比剂方案为450 mgI/kg[10], 对比剂开始注射60 s行门静脉期扫描[15]。B组采用能谱扫描模式,采用自动能谱协议选择技术,管电压140和80 kVp瞬时切换,转速0.5~1.0 s/转,噪声指数10 HU,对比剂方案300 mgI/kg其他参数与A组相同。C组采用能谱扫描模式,采用自动能谱协议选择技术,噪声指数13 HU,其他参数与B组相同。
3.图像重建:A组采用50%ASIR重建,B、C两组采用60 keV联合50% ASIR重建,A、B、C 3组的层厚、层间距均为1.25 mm。重建图像均传输到GE AW 4.6工作站进行测量和评价。
4.客观评价:分别在门静脉主干和肝实质选取感兴趣区(region of interest,ROI),取其CT值的平均值。门静脉主干ROI为肝门区域,门静脉管腔最大层面的2/3或以上;肝实质ROI取肝右叶,避开大血管、伪影及病变组织,面积约为250 mm2。在腹部皮下脂肪组织选取ROI并计算其CT值的标准差(standard deviation,SD),面积20~40 mm2。所有测量由同一位放射科医生完成,且均在连续3个相邻层面测量后取平均值。计算门静脉信噪比(signal to noise ratio,SNR),SNRROI=CT门静脉/SD门静脉;对比噪声比(contrast to noise ratio,CNR),CNRROI=(CT门静脉-CT肝实质)/SD脂肪,CT差值=CT门静脉-CT肝实质。CT门静脉、SD门静脉分别为门静脉的CT值和标准差,CT肝实质表示肝实质的CT值,SD脂肪为皮下脂肪的SD值,表示图像的噪声。
5.主观评分:由两名高年资放射科医生在PACS系统图像进行主观评价,意见不一致时经讨论取得一致评分。评价内容包括门静脉边缘的清晰度,可见肝内门静脉分支的水平,以及门静脉和肝实质之间的对比噪声比[16],采用5分制图像质量的评价标准,5分为门静脉边缘非常锐利,与肝实质对比佳,可显示门静脉主干4级及以上分支;4分为门静脉边缘较锐利,与肝实质对比良好,显示门静脉主干第3级分支;3分为门静脉边缘较清楚,与肝实质对比中等,显示门静脉主干第2级分支;2分为门静脉边缘不清楚,与肝实质对比较差,仅显示门静脉主干第l级分支;1分为门静脉边缘模糊,与肝实质对比差,仅显示门静脉主干。
6.有效剂量:扫描完成后,记录容积CT剂量指数(volume ct dose index,CTDIvol)和剂量长度乘积(dose length product,DLP),采用剂量转换系数计算有效剂量(E),E=DLP×k,其中腹部转换系数k=0.015 mSv/mGy ·cm。
7.统计学处理:所有统计学检验分析均使用SPPS 21.0统计学软件,采用单因素方差分析(ANOVA)比较3组患者的年龄、身高、体重及体质量指数,以及图像中门静脉CT值、肝脏CT值,门静脉与肝实质差值、图像噪声、门静脉SNR、CNR、其图像评分、CTDIvol、DLP及E。所有数据均符合正态分布,以x±s表示,P < 0.05为差异有统计学意义。
结果1.对比剂用量:A、B、C 3组对比剂用量分别为(87.48±14.88)、(61.10±9.32)、(64.93±8.19)ml,B、C两组对比剂用量相似且均显著低于A组,差异有统计学意义(t=9.504、8.400,P < 0.05),总用量减少约30%。
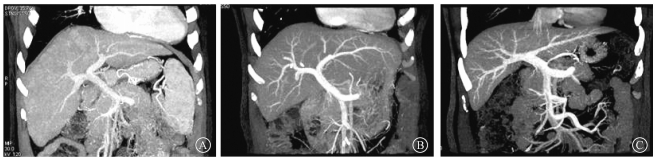
2.图像质量评价:测量3组图像的门静脉主干、肝实质的平均CT值及其差值和图像噪声,计算并统计SNR、CNR和主观评分。结果显示,B、C两组门静脉CT值、肝脏与门静脉差值均显著高于A组,差异有统计学意义(t=-9.625、-8.680、-9.536、-9.857,P < 0.05);A组的图像噪声显著低于B、C组(t=2.868、0.067,P < 0.05),B、C两组之间差异无统计学意义(P>0.05);B、C两组的SNR和CNR显著高于A组(t=-8.082、-6.064、-6.050、-5.308,P < 0.05),且B组SNR高于C组(t=3.361,P<0.05)。所有图像主观评分均>3分,可满足诊断要求,但B、C两组图像评分明显高于A组(t=-8.912、-6.779,P<0.05),B、C两组差异无统计学意义(P>0.05,表 1和图 1)。由图 1可见,A组的门静脉边缘较锐利,与肝实质对比良好,显示门静脉主干第4级分支;B组显示的门静脉边缘非常锐利,与肝实质对比佳,可显示门静脉主干4级及以上分支;C组,显示的门静脉边缘非常锐利,与肝实质对比佳,可显示门静脉主干4级及以上分支。
|
|
表 1 3组图像的门静脉主干、肝实质的平均CT值及其差值、图像噪声、SNR及CNR(x±s) Table 1 The mean CT value and difference of the portal vein and liver parenchyma of the three groups of images, image noise, SNR and CNR(x±s) |
|
图 1 3组门静脉成像图像质量比较 A.常规组;B.NI=10能谱组;C. NI=13能谱组 Figure 1 Image quality of three groups with portal vein imaging A. Conventional group; B. Spectrum group with NI=10; C. Spectrum group with NI=13 |
3.有效剂量:结果显示,A、B两组种扫描方案间辐射剂量差异无统计学意义(表 2),C组的剂量显着降低,CTDIvol、DLP及E分别下降约19%。
|
|
表 2 不同扫描方案有效剂量及其比较(x±s) Table 2 Effective dose between three groups and their comparison(x±s) |
讨论
众所周知,多层螺旋CT(multi-slice CT, MSCT)门静脉造影是评估门静脉高压继发的侧支循环和血液动力学变化的有效方法[1-3, 17]。门静脉造影的质量取决于门静脉内的对比浓度。理论上,通过应用高浓度对比介质的推注注射可以改善门静脉造影的质量[18-20]。然而,门静脉内的对比剂浓度依赖于肠系膜上静脉和脾静脉的回流,这些受到心脏功能和脾脏灌注等各种因素的影响。单独增加对比剂的浓度和剂量可能无法改善门静脉造影的成像质量[21]。
通常情况下随着光子能量的减少,物质的衰减增加。而随着光子能量的减少,具有较高原子序数的物质(如碘)衰减得更多,这为碘对比剂和软组织之间的对比提供了基础。然而,在使用常规CT扫描中,发生X射线能量衰减效应,并且图像以特定平均能量水平表示,这种平均能量衰减效应降低了物质之间的低对比度分辨力,在成像中只有使用单能量X射线才消除平均衰减效应。能谱CT利用单X射线管管电压快速切换技术可以获得单能量图像,增加对比度[10, 16],赵晶等[22]指出,采用60 keV可以获得用于显示门静脉的最佳对比噪声比。本研究的结果显示,在60 keV时减少30%造影剂,可得到更高的对比度,与之前的发现相似[10]。
在以前的能谱扫描成像中,设备无法自动提供个体化的扫描方案,与传统CT相比,显示出相似甚至更高的辐射剂量[9-11]。而ASIS技术可以基于目标非光谱成像噪声指数来个性化光谱CTDIvol,以维持与传统非光谱成像相似的剂量。本研究结果证实,该原理可应用于门静脉造影成像:基于相同的噪声指数,ASIS技术的能谱CT辐射剂量与使用120 kVp扫描几乎相同,与BMI无关。但Lv等[15]学者指出对于BMI过低或过高的患者,光谱CT推荐的CTDIvol可能超过ASIS系统允许的CTDIvol范围,与120 kVp CT相比,可能导致更高(对于非常小的患者)或更低(对于非常大的患者)的剂量比。
噪声指数是用来平衡图像质量与辐射剂量的参数[23]。在实际应用中,可以通过改变NI值从而调节辐射剂量。噪声指数值越高,受检者接受的辐射剂量越小,对应的其图像噪声越大;噪声指数值越低,受检者接受的辐射剂量越大,对应的其图像噪声越小。临床工作中,常采用噪声指数10(5 mm层厚)为腹部CT扫描参数,本研究将噪声指数设置为13,以探讨能否在保证图像质量的同时降低辐射剂量。结果表明,在预设了相同的噪声指数的A、B两组中,能谱扫描与常规扫描产生的辐射剂量差异无统计学意义;而C组通过预设较高的噪声指数,受检者在获得满意的图像质量的同时显著降低了辐射剂量,其中CTDIvol、DLP、E分别下降了19%。
低剂量扫描均会使图像噪声增加,影响图像质量,科学家们一直在致力于研究出更好的重建算法以提高图像质量。ASIR技术最显著的好处是它能够将CT系统的物理模型合并到重建过程中,能够准确地表征数据采集过程,包括噪声、射束硬化、散射和不完整的数据采样等。相对于传统使用的滤波反投影技术,自适应迭代统计重建技术能更有效地降低图像噪声,提高空间分辨率,并减少成像伪影[24]。既往的大多数研究中,对照组均采用滤波反投影(FBP)算法,然而在CT技术快速发展的今天,常规扫描大多已采用迭代重建算法,以期在降低辐射剂量的同时提高图像质量[25];本研究也采用了ASIR重建算法,且采用了相同的迭代比例,得到的结果显示B、C组在SNR和CNR均优于A组图像,说明即使A组采用了ASIR技术,能谱扫描时60 keV+50%ASIR重建的单能量图像也能更好地显示门静脉。
综上所述,在门静脉成像中,通过预设较高的NI值,配合能谱ASIS技术,根据患者体型为选择个体化的扫描方案,结合单能量成像和ASIR重建技术,可在有效降低患者的对比剂剂量和辐射剂量的同时,提供满足诊断要求的图像。
利益冲突 全体作者未因进行该研究而接受任何不当职务或财务利益,并对此研究的独立性和科学性予以保证作者贡献声明 杨明负责收集资料并撰写论文;范文亮负责统计学分析;余建明负责指导论文写作;雷子乔、谢光明负责完善资料和数据测量
| [1] |
Willmann JK, Weishaupt D, Böhm T, et al. Detection of submucosal gastric fundal varices with multi-detector row CT angiography[J]. Gut, 2003, 52(6): 886-892. DOI:10.1136/gut.52.6.886 |
| [2] |
Kang HK, Jeong YY, Choi JH, et al. Three-dimensional multi-detector row CT portal venography in the evaluation of portosystemic collateral vessels in liver cirrhosis[J]. Radiographics, 2002, 22(5): 1053-1061. DOI:10.1148/radiographics.22.5.g02se011053 |
| [3] |
Zhao LQ, He W, Chen G. Characteristics of paraesophageal varices:a study with 64-row multidetector computed tomography portal venography[J]. World J Gastroenterol, 2008, 14(34): 5331-5335. DOI:10.3748/wjg.14.5331 |
| [4] |
汤日杰, 郭成伟, 张水兴, 等. 64层螺旋CT门静脉造影对门静脉高压侧支循环的临床应用研究[J]. 肝脏, 2010, 15(2): 97-100. Tang RJ, Guo CW, Zhang SX, et al. The diagnostic value of portography in the portosystemic collateral shunts of portal hypertension with 64 silces spiral CT[J]. Chin Hepat, 2010, 15(2): 97-100. DOI:10.3969/j.issn.1008-1704.2010.02.007 |
| [5] |
郭成伟, 全显跃, 方驰华, 等. 64层螺旋CT门静脉造影对门静脉高压侧支循环的研究[J]. 中国医学影像技术, 2008, 24(6): 932-935. Guo CW, Quan XY, Fang CH, et al. Portography diagnotic value of collateral circulation of portal hypertension on 64-slice spiral CT[J]. Chin J Med Imaging Technol, 2008, 24(6): 932-935. DOI:10.3321/j.issn:1003-3289.2008.06.035 |
| [6] |
James MT, Ghali WA, Tonelli M, et al. Acute kidney injury following coronary angiography is associated with a long-term decline in kidney function[J]. Kidney Int, 2010, 78(8): 803-809. DOI:10.1038/ki.2010.258 |
| [7] |
He J, Wang Q, Ma X, et al. Dual-energy CT angiography of abdomen with routine concentration contrast agent in comparison with conventional single-energy CT with high concentration contrast agent[J]. Eur J Radiol, 2015, 84(2): 221-227. DOI:10.1016/j.ejrad.2014.11.025 |
| [8] |
Zhu Z, Zhao XM, Zhao YF, et al. Feasibility study of using gemstone spectral imaging (GSI) and adaptive statistical iterative reconstruction (ASIR) for reducing radiation and iodine contrast dose in abdominal CT patients with high BMI values[J]. PLoS One, 2015, 10(6): e0129201. DOI:10.1371/journal.pone.0129201 |
| [9] |
Matsumoto K, Jinzaki M, Tanami Y, et al. Virtual monochromatic spectral imaging with fast kilovoltage switching:improved image quality as compared with that obtained with conventional 120-kVp CT[J]. Radiology, 2011, 259(1): 257-262. DOI:10.1148/radiol.11100978 |
| [10] |
Lv P, Lin XZ, Chen K, et al. Spectral CT in patients with small HCC:investigation of image quality and diagnostic accuracy[J]. Eur Radiol, 2012, 22(10): 2117-2124. DOI:10.1007/s00330-012-2485-3 |
| [11] |
Yamada Y, Jinzaki M, Hosokawa T, et al. Abdominal CT:an intra-individual comparison between virtual monochromatic spectral and polychromatic 120-kVp images obtained during the same examination[J]. Eur J Radiol, 2014, 83(10): 1715-1722. DOI:10.1016/j.ejrad.2014.06.004 |
| [12] |
Pan Z, Pang L, Ding B, et al. Gastric cancer staging with dual energy spectral CT imaging[J]. PLoS One, 2013, 8(2): e53651. DOI:10.1371/journal.pone.0053651 |
| [13] |
Simons D, Kachelriess M, Schlemmer HP. Recent developments of dual-energy CT in oncology[J]. Eur Radiol, 2014, 24(4): 930-939. DOI:10.1007/s00330-013-3087-4 |
| [14] |
Lv P, Lin XZ, Li J, et al. Differentiation of small hepatic hemangioma from small hepatocellular carcinoma:recently introduced spectral CT method[J]. Radiology, 2011, 259(3): 720-729. DOI:10.1148/radiol.11101425 |
| [15] |
Lv P, Liu J, Chai Y, et al. Automatic spectral imaging protocol selection and iterative reconstruction in abdominal CT with reduced contrast agent dose:initial experience[J]. Eur Radiol, 2017, 27(1): 374-383. DOI:10.1007/s00330-016-4349-8 |
| [16] |
Zhao LQ, He W, Li JY, et al. Improving image quality in portal venography with spectral CT imaging[J]. Eur J Radiol, 2012, 81(8): 1677-1681. DOI:10.1016/j.ejrad.2011.02.063 |
| [17] |
Zhu K, Meng X, Pang P, et al. Gastric varices in patients with portal hypertension:evaluation with multidetector row CT[J]. J Clin Gastroenterol, 2010, 44(5): e108-115. DOI:10.1097/MCG.0b013e3181c115c6 |
| [18] |
Watanabe H, Kanematsu M, Miyoshi T, et al. Improvement of image quality of low radiation dose abdominal CT by increasing contrast enhancement[J]. AJR Am J Roentgenol, 2010, 195(4): 986-992. DOI:10.2214/AJR.10.4456 |
| [19] |
Furuta A, Ito K, Fujita T, et al. Hepatic enhancement in multiphasic contrast-enhanced MDCT:comparison of high-and low-iodine-concentration contrast medium in same patients with chronic liver disease[J]. AJR Am J Roentgenol, 2004, 183(1): 157-162. DOI:10.2214/ajr.183.1.1830157 |
| [20] |
Romano L, Grazioli L, Bonomo L, et al. Enhancement and safety of iomeprol-400 and iodixanol-320 in patients undergoing abdominal multidetector CT[J]. Br J Radiol, 2009, 82(975): 204-211. DOI:10.1259/bjr/93627766 |
| [21] |
Roos JE, Desbiolles LM, Weishaupt D, et al. Multi-detector row CT:effect of iodine dose reduction on hepatic and vascular enhancement[J]. Rofo, 2004, 176(4): 556-563. DOI:10.1055/s-2004-813018 |
| [22] |
赵晶, 李晓璐, 徐飞, 等. 基于能谱CT单能量成像及自适应统计迭代重建技术的门静脉图像质量分析[J]. 放射学实践, 2015, 30(6): 633-637. Zhao J, Li XL, Xu F, et al. Images analysis of the portal vein based on spectral CT monochromatic imaging and adaptive statistical iterative reconstruction (ASiR)[J]. Radiol Pract, 2015, 30(6): 633-637. DOI:10.13609/j.cnki.1000-0313.2015.06.007 |
| [23] |
Kambadakone AR, Chaudhary NA, Desai GS, et al. Low-dose MDCT and CT enterography of patients with Crohn disease:feasibility of adaptive statistical iterative reconstruction[J]. AJR Am J Roentgenol, 2011, 196(6): W743-752. DOI:10.2214/AJR.10.5303 |
| [24] |
Prakash P, Kalra MK, Kambadakone AK, et al. Reducing abdominal CT radiation dose with adaptive statistical iterative reconstruction technique[J]. Invest Radiol, 2010, 45(4): 202-210. DOI:10.1097/RLI.ob013e3181dzfeec |
| [25] |
朱华勇, 潘璟琍, 朱卫萍, 等. 自适应统计迭代重建算法对肝脏低剂量CT能谱成像质量的影响[J]. 中华放射医学与防护杂志, 2015, 35(12): 948-952. Zhu HY, Pan JL, Zhu WP, et al. Effect of adaptive statistical iterative reconstruction algorithm on the imaging quality in low-dose spectral CT scanning of the liver[J]. Chin J Radiol Med Prot, 2015, 35(12): 948-952. DOI:10.3760/cma.j.issn.0254-5098.2015.12.015 |
 2019, Vol. 39
2019, Vol. 39


