调强放射治疗(IMRT)技术因能达到高度的靶区适形度和精确的剂量投照已被广泛应用于临床[1]。为了充分发挥其优势,临床医师须在治疗计划设计前对肿瘤靶区及所有危及器官(OAR)进行准确地勾画。同时,患者在实际分次放疗过程中产生的摆位误差及解剖结构形变等仍可能对肿瘤靶区和OAR的剂量分布产生较大的影响[2-3],为改善这种情况,治疗过程中需重新采集图像、勾画靶区和OAR,并制定计划[4],大大加重了医师的负担。此外,人工勾画还容易产生操作者之间或同一操作者在不同时间的勾画偏差[5],而自动勾画软件通过建立参考图库及形变配准来完成勾画过程,有助于提高勾画效率,克服人工勾画的观察者之间的误差。本研究拟应用自动勾画软件对胸部肿瘤患者的OAR进行勾画,评估几何及剂量精度,并与手工勾画比较其几何学和剂量学差异,探讨自动勾画方式应用于临床的可行性。
资料与方法1.软件自动勾画:本研究采用的自动轮廓勾画软件是ABAS(Atlas-Based Autosegmentation,瑞典医科达公司),具体工作流程包括:纳入已勾画完组织结构的CT图像建立模板图谱库,提取测试图像并将其与模板图像进行形变配准,以获取两组图像之间的形变矢量,进而将形变矢量从模板图像上勾画好的组织结构映射到测试图像上,完成对测试图像的自动勾画。
2.患者资料和OAR勾画:选择已接受调强放疗的非远处转移的第6版美国癌症联合委员会(AJCC)分期为Ⅱ~Ⅳ期食管癌患者10例,提取其CT图像。为保证勾画的一致性,仅由1名有经验的放疗医师在医生工作站上(Oncentra Master Plan,荷兰核通公司)手工勾画OAR(包括双肺、心脏、脊髓),并经上级高年资医师修改审核,数据传输至ABAS软件工作站,以此建立参考图谱库。另选取10例准备接受调强放疗的Ⅲ~Ⅳ期食管癌患者作为研究对象,分别行相应OAR的人工勾画、单模板和多模板自动勾画,其中单模板自动勾画:即在参考图谱库中根据不同分期,分层分组,同一组别内按简单随机法选取1例参考图谱与测试图像进行1对1的自动勾画;多模板自动勾画:即采用10例参考图谱与1例测试图像进行10对1的自动勾画。最终将勾画好的CT图像传至放疗计划系统(Pinnacle 9.2 m,美国飞利浦公司)进行计划设计。剂量学要求和受量限值均是依据手工勾画的组织结构来设置的,该计划定义为原始计划。
3.放疗计划设计:采用5野共面等中心照射,分别从210°、310°、0°、50°和150° 5个方向入射,射线能量为6 MV X射线,直接子野优化方式,子野数目≤40,最小子野面积为9 cm2,最小子野跳数为9 MU。计划要求靶区处方剂量包绕95%的体积,GTV-T-P处方剂量为63 Gy/30次,CTV-T-P处方剂量为54 Gy/30次;OAR中脊髓的最大剂量Dmax < 45 Gy,全肺受照20 Gy的体积占总体积的百分比V20≤30%,心脏受照40 Gy的体积占总体积的百分比V40≤40%。
4.几何精度及剂量学评价
(1) 体积差异:分别记录自动勾画体积V自动与手工勾画体积V手工,为评估两者的差异,定义ΔV为自动勾画与手工勾画的体积差占手工勾画体积之比,ΔV的正负分别表示ABAS软件对目标OAR过度勾画或者低估目标体积,结果以其绝对值的百分比表示。
(2) 形状一致性:参考文献[6],将相似性系数(dice similarity coefficient,DSC)作为形状吻合度的评估指标,0 < DSC < 1,当两者有较好的相似性时,DSC趋近于1,并界定DSC > 0.700为重合度高[7]。
(3) 位置差异:通过记录所勾画组织结构几何中心在3个坐标轴上的坐标差异Δx, Δy, Δz(Δ=自动-手工),能较直观地反映三维空间中自动勾画与手工勾画组织结构的位置关系。
(4) 剂量学比较:将入组病例的原始计划分别导入至单模板和多模板方式下自动勾画OAR的CT图像上,通过剂量体积直方图(DVH)和剂量分布来评估OAR的受量,并根据国际辐射单位和测量委员会(ICRU)83号报告[8]提出的对OAR的剂量要求,对于不同OAR,统计其剂量学指标,与手工勾画OAR的原始计划进行临床剂量学的比较:脊髓Dmean和Dmax,肺 V5、V20、V30和平均剂量(Dmean),心脏 Dmean、V30、V40。
5.统计学处理:建立Excel数据库,应用SPSS 19.0软件进行数据分析。经Shapiro-Wilk正态性检验后,两种勾画方式的形态学结果采用Wilcoxon符号秩和检验,剂量学结果采用K个相关样本的Friedman检验,并对形态学指标DSC与OAR体积大小的关系行Spearman相关性分析,P < 0.05为差异有统计学意义。图形绘制由Origin 2017(美国OriginLab公司)软件完成。
结果1.几何精度对比
(1) 体积差异及形状吻合度分析:图 1为OAR自动勾画结果的CT图像示例,从图中可以看出自动勾画的OAR轮廓与医师手工勾画重合度高,其中多模板勾画与手工勾画轮廓更为贴合。但在某些层面上自动勾画仍存在不可忽视的偏差,对于这些层面,需作进一步修改方可应用与临床。
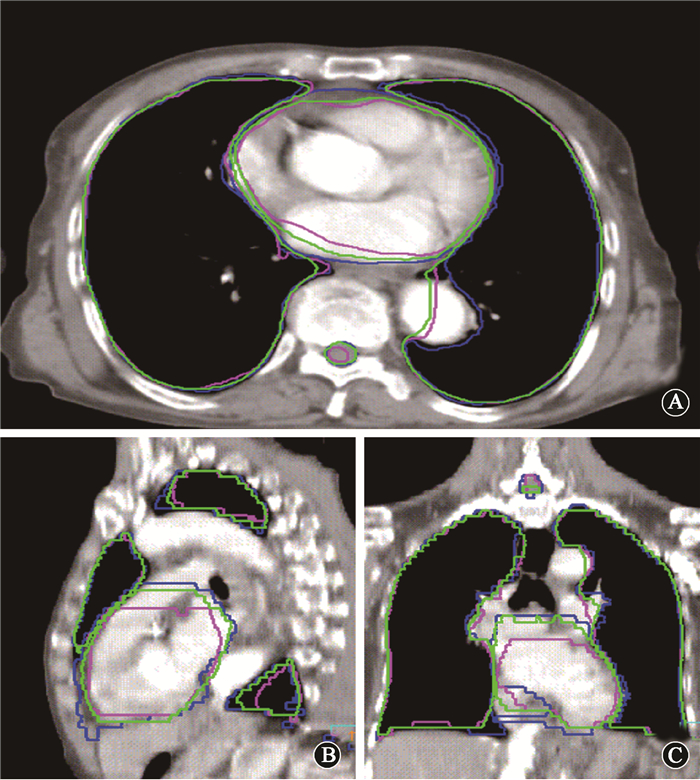
|
图 1 OAR自动勾画结果的CT图像示例A.横截位;B.矢状位;C冠状位 注:蓝色为手工勾画,粉色为单模板勾画,绿色为多模板勾画 Figure 1 Autosegmentation results of OAR A. Transverse; B. Sagittal; C. Coronal |
表 1所示为自动勾画与手工勾画的体积差异和DSC对比,多模板方式下勾画出的OAR体积差异ΔV%均小于单模板,说明它更接近手工勾画,尤其是肺和脊髓的差异有统计学意义(Z=-2.297、-1.172、-1.988,P < 0.05)。对于相似性指数,单模板和多模板勾画的OAR总体呈现出较高的相似系数,多模板的平均DSC值为0.92±0.05,单模板的平均DSC值为0.82±0.17,且多模板的DSC明显高于单模板(Z=-2.803~-2.497,P < 0.05)。此外,从表 1可知,单模板方式对脊髓的勾画与手工勾画的体积差异较大[ΔV=(25.64±27.37)%],且相似性指数(0.54±0.18) < 0.700。因此,从体积差异和形态吻合度来看,多模板勾画方式具有更高的勾画精度。
|
|
表 1 自动勾画的OAR体积差异(ΔV)和相似度(DSC)对比(x±s) Table 1 ΔV and DSC of OARs of autosegmentation(x±s) |
(2) 中心位置的差异分析:图 2较直观地展示了自动勾画的OAR在三维空间上的相对位置关系。从图中可看出,多模板勾画的OAR在3个方向上的平均位置偏差在0.5 cm以内,均小于单模板,说明其几何中心与手工勾画更为贴近,尤其在双肺,其几何中心基本与手工勾画相重合。而单模板勾画的各OAR在位置差异上呈现出不稳定性,左、右肺的几何中心偏差小,心脏的Δz和脊髓的Δx则 > 1.0 cm。尤其对于脊髓,单模板方式的勾画偏差较大,提示在勾画OAR的总体几何精度上,多模板仍优于单模板。

|
图 2 单模板勾画与多模板勾画的位置差异对比 注:●为单模板,★为多模板 Figure 2 Position differences of OARs of single and multi-template |
(3) DSC与体积大小的相关性分析;单模板和多模板两种自动勾画方式下的DSC与OAR体积大小均呈正相关(Rs=0.588、0.570,P < 0.05),即OAR体积越大,ABAS软件所勾画出的组织轮廓与手工勾画结果的吻合程度越高。因此,自动勾画体积较大的OAR(肺、心脏)时,得到的形状吻合度评价指标DSC较高,且几何中心的位置也更贴近手工勾画;而对于体积较小的脊髓来说,单模板勾画的效果欠佳(DSC=0.54),多模板勾画却依然能达到满意的形状吻合度(DSC=0.85),说明多模板勾画方式具有更高的稳定性,能更好地还原不同体积大小OAR的手工勾画效果。
2.剂量分布对比:在OAR剂量分布手工勾画与自动勾画的比较中,以手工勾画为参考标准,3者的剂量学指标的差异均无统计学意义(P > 0.05),详见表 2和图 3。结果说明两种自动勾画方式的剂量分布情况均接近手工勾画,剂量学精度较高,在临床可接受的范围内。

|
图 3 自动勾画与手工勾画的OAR的DVH Figure 3 DVH comparison of OAR between segmentation and manual |
|
|
表 2 自动勾画与手工勾画的OAR剂量分布比较(x±s) Table 2 Dosimetric comparison of OAR between autosegmentation and manual(x±s) |
讨论
精准放射治疗时代下,调强技术一直致力于向肿瘤靶区传递足够的治疗剂量,同时尽可能减少周围OAR的受量。而最优的计划设计很大程度上依赖于准确的轮廓勾画,因此,保证靶区及OAR勾画的准确性是提高患者疗效的重要前提。一般地,肿瘤靶区及OAR由放疗医师人工勾画,受到医师不同专业水平和临床经验的限制,实际工作中很难保证勾画的一致性,尤其在低年资医师面对复杂病例时,这种勾画者间差异更为明显[5, 9]。此外,患者在各分次放疗间的内部解剖位置的变化、器官形变及位移等成为影响累积剂量分布的不利因素[2-3]。虽然有研究表明放疗过程中重新制定治疗计划能有效保护OAR受到安全剂量照射[4, 10],但该项工作要求反复勾画靶区和OAR,很大程度上增加了放疗医师的工作量,难以普及。因此,不少研究者将目光放在自动勾画的软件工具上,以期在不牺牲勾画精度的情况下提高勾画效率、减少观察者间误差。但目前多数研究仍集中在头颈部肿瘤领域[6, 11-12],本研究将ABAS自动勾画软件应用于食管癌患者,用单模板1对1和多模板10对1两种勾画方式来勾画食管癌患者的OAR轮廓,结果显示多模板勾画方式能更好地还原医师手工勾画效果,而剂量分布方面,两种自动勾画方式与手工勾画对比均无明显统计学差异,且符合正常组织剂量限量要求。综合评价,多模板勾画方式能达到较满意的勾画精度,可应用于临床。
ABAS自动勾画软件基于形变配准的原理,使参考图像上的感兴趣器官轮廓与目标图像匹配从而完成自动勾画流程。评估图像配准准确度的相似性系数DSC是统计学上可靠的经典指标[13]。然而,DSC在计算相似度时并未视两者中的任一方为参考,因此,为突出医师手工勾画的“金标准”地位,本研究将体积差异ΔV和几何中心坐标差异(Δx, Δy, Δz)共同纳入统计来综合评价自动勾画的形态学精度。本研究中,体积差异方面,多模板方式勾画出的OAR ΔV均小于单模板,尤其是肺和脊髓的差异有统计学意义;单模板和多模板的平均DSC值分别0.82±0.17、0.92±0.05,两者与手工勾画的形状吻合度均较高,且多模板明显优于单模板;几何中心位置差异分析结果,也表明多模板勾画的OAR在三维空间的平均位置偏差在0.5 cm以内,均小于单模板,说明其几何中心位置与手工勾画更为贴近。Sims等[6]也报道了利用45例多模板构建的ISOgrayTM ABAS工具勾画头颈部肿瘤OAR,与手工勾画对比,得到了满意的敏感性和特异性。
自动勾画的精度与所勾画的组织结构体积大小有关。Qazi等[14]指出下颌骨、脑干和腮腺等头颈部OAR的勾画重合度较高,DSC分别为0.93、0.91、0.83,而体积较小的颌下腺、淋巴结重合度低,与Zhang等[15]的报道一致。本研究也得到了相似结论,发现DSC值与体积大小呈正相关,在勾画体积较小的脊髓时,两种自动勾画方式的DSC值都出现了不同程度的降低。不同的是,单模板的勾画精度下降程度较大,而多模板仍能保持稳定的较高吻合度。原因可能是ABAS软件形变配准在寻找空间特征的对应点的过程中,体积小的结构易出现偏差,同时也可能是配准算法在捕捉小体积结构的图像像素时,因小体积结构的大小与像素步长接近而出现较大误差。而多模板勾画由于将目标图像与多个参考图像同时形变配准,获取多组形变矢量,在计算“最相似”结果的过程中对形状差别较大的图像进行了一定程度的校正,因此具有单模板勾画缺乏的稳定性优势。
然而,要衡量自动勾画能否应用于临床,仅凭几何学精度是不够的,还需根据相应的剂量学指标来评估最终剂量分布情况。Tsuji等[12]对比了鼻咽癌患者肿瘤靶区和OAR的手工勾画及自动勾画剂量分布结果,发现两者在OAR的剂量分布方面并无明显差异,本研究也得到了相同结论,肺、脊髓和心脏的剂量分布情况均接近手工勾画,且各项剂量学指标均符合临床OAR剂量限量要求。有研究表明,肺的放射并发症与其受照体积和受照剂量密切相关[16],因此临床计划中无论采取何种技术手段和辅助工具,都需要重点关注肺的受照剂量。本研究3种勾画方式下,肺的相关受照剂量和剂量体积均在临床剂量限值水平以下。对于心脏受量,V30和V40分别低于17%和10%,Wei等[17]认为当心脏的V30低于46%时心包积液的发生率只有13%,而当心脏接受>40 Gy时将诱发心脏疾病[18],所以控制V30、V40对于降低心脏的不良反应是很重要的。
综上所述,本研究对ABAS自动勾画软件的单模板和多模板勾画结果进行几何精度和剂量分布的评估发现,多模板勾画与医师手工勾画的所有OAR形态吻合程度更高。而在剂量学表现上,两者均接近手工勾画下的剂量分布,且符合目前临床对于食管癌调强计划下各OAR的剂量限定标准,为ABAS自动勾画软件应用于临床提供了依据。
利益冲突 无作者贡献声明 胡彩容负责数据统计及撰写论文;林小艺和阴晓娟负责OAR的自动勾画和数据收集;李金銮负责整理临床资料;吴君心指导论文写作;张秀春指导本研究实验过程
| [1] |
Grégoire V, Langendijk JA, Nuyts S. Advances in radiotherapy for head and neck cancer[J]. J Clin Oncol, 2015, 33(29): 3277-3284. DOI:10.1200/JCO.2015.61.2994 |
| [2] |
Hammers J, Matney J, Kaidar-Person O, et al. Effects of inter-fraction organ displacement/deformation on the delivered doses to the heart, esophagus, and lungs in patients receiving thoracic radiotherapy[J]. Med Phys, 2016, 43(6): 3582. DOI:10.1118/1.4956701 |
| [3] |
Tao C, Liu T, Chen J, et al. Dosimetry change during radiotherapy and dosimetry difference for rigid and deformed registration in the min-thoracic esophageal carcinoma[J]. Med Phys, 2016, 43(6): 3560. DOI:10.1118/1.4956606 |
| [4] |
Dial C, Weiss E, Siebers JV, et al. Benefits of adaptive radiation therapy in lung cancer as a function of replanning frequency[J]. Med Phys, 2016, 43(4): 1787. DOI:10.1118/1.4943564 |
| [5] |
Li XA, Tai A, Arthur DW, et al. Variability of target and normal structure delineation for breast cancer radiotherapy:an RTOG multi-institutional and multiobserver study[J]. Int J Radiat Oncol Biol Phys, 2009, 73(3): 944-951. DOI:10.1016/j.ijrobp.2008.10.034 |
| [6] |
Sims R, Isambert A, Gregoire V, et al. A pre-clinical assessment of an atlas-based automatic segmentation tool for the head and neck[J]. Radiother Oncol, 2009, 93(3): 474-478. DOI:10.1016/j.radonc.2009.08.013 |
| [7] |
Zijdenbos AP, Dawant BM, Margolin RA, et al. Morphometric analysis of white matter lesions in MR images:method and validation[J]. IEEE Trans Med Imaging, 1994, 13(4): 716-724. DOI:10.1109/42.363096 |
| [8] |
International Commission on Radiation Units and Measurements. ICRU Report 83. Prescribing, recording, and reporting photon-beam IMRT[R]. Oxford: Oxford University Press, 2010.
|
| [9] |
Bekelman JE, Wolden S, Lee N. Head-and-neck target delineation among radiation oncology residents after a teaching intervention:a prospective, blinded pilot study[J]. Int J Radiat Oncol Biol Phys, 2009, 73(2): 416-423. DOI:10.1016/j.ijrobp.2008.04.028 |
| [10] |
Wang W, Yang H, Hu W, et al. Clinical study of the necessity of replanning before the 25th fraction during the course of intensity-modulated radiotherapy for patients with nasopharyngeal carcinoma[J]. Int J Radiat Oncol Biol Phys, 2010, 77(2): 617-621. DOI:10.1016/j.ijrobp.2009.08.036 |
| [11] |
Stapleford LJ, Lawson JD, Perkins C, et al. Evaluation of automatic atlas-based lymph node segmentation for head-and-neck cancer[J]. Int J Radiat Oncol Biol Phys, 2010, 77(3): 959-966. DOI:10.1016/j.ijrobp.2009.09.023 |
| [12] |
Tsuji SY, Hwang A, Weinberg V, et al. Dosimetric evaluation of automatic segmentation for adaptive IMRT for head-and-neck cancer[J]. Int J Radiat Oncol Biol Phys, 2010, 77(3): 707-714. DOI:10.1016/j.ijrobp.2009.06.012 |
| [13] |
Dice LR. Measures of the amount of ecologic association between species[J]. Ecology, 1945, 26(3): 297-302. DOI:10.2307/1932409 |
| [14] |
Qazi AA, Pekar V, Kim J, et al. Auto-segmentation of normal and target structures in head and neck CT images:a feature-driven model-based approach[J]. Med Phys, 2011, 38(11): 6160-6170. DOI:10.1118/1.3654160 |
| [15] |
Zhang T, Chi Y, Meldolesi E, et al. Automatic delineation of on-line head-and-neck computed tomography images:toward on-line adaptive radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2007, 68(2): 522-530. DOI:10.1016/j.ijrobp.2007.01.038 |
| [16] |
Wang SL, Liao Z, Vaporciyan AA, et al. Investigation of clinical and dosimetric factors associated with postoperative pulmonary complications in esophageal cancer patients treated with concurrent chemoradiotherapy followed by surgery[J]. Int J Radiat Oncol Biol Phys, 2006, 64(3): 692-699. DOI:10.1016/j.ijrobp.2005.08.002 |
| [17] |
Wei X, Liu HH, Tucker SL, et al. Risk factors for pericardial effusion in inoperable esophageal cancer patients treated with definitive chemoradiation therapy[J]. Int J Radiat Oncol Biol Phys, 2008, 70(3): 707-714. DOI:10.1016/j.ijrobp.2007.10.056 |
| [18] |
Ishikura S, Nihei K, Ohtsu A, et al. Long-term toxicity after definitive chemoradiotherapy for squamous cell carcinoma of the thoracic esophagus[J]. J Clin Oncol, 2003, 21(14): 2697-2702. DOI:10.1200/JCO.2003.03.055 |
 2018, Vol. 38
2018, Vol. 38


