乳腺癌是女性全球范围内最常见的恶性肿瘤, 乳腺癌根治术后局部区域复发率为10%~30%[1], 欧洲肿瘤医学学会会议(EMSO)2012年发布的局部区域复发和转移性乳腺癌的治疗指南中强调, 对于局部区域复发的乳腺癌患者, 治愈是其治疗目标, 可行手术切除病灶患者建议尽早切除病灶, 若根治术后未行辅助放疗的患者局部区域复发手术切除病灶后, 应行局部区域巩固放射治疗, 已行辅助放疗的患者, 手术切除病灶±再程放疗[2], 但对放射治疗野、放射剂量如何选择未提及, 本研究旨在分析110例仅局部区域复发后R0切除病灶患者的预后因素, 探讨巩固放射治疗策略的选择。
资料与方法1.一般临床资料:回顾性分析2003年1月1日至2015年11月30日期间解放军307医院收治的3 226例乳腺癌患者。入组条件:乳腺癌改良根治术后局部区域复发(仅同侧胸壁、锁骨上下区、腋窝或内乳淋巴引流区中,一处或多处复发);完善全身检查,无远处转移;复发病灶全部手术切除,且切缘阴性;临床病理资料基本完整。共入组110例患者,84例(76.4%)仅胸壁复发,12例(10.9%)仅锁骨上下区转移,13例(11.8%)仅腋窝转移,1例(0.9%)同时侵及胸壁和腋窝。103例(93.6%)为单发病灶,7例(6.7%)多发病灶。103例(93.6%)病灶直径≤2 cm,7例(6.7%)病灶直径 > 2 cm。均经手术切除所有病灶,且达到(R0)无残留标准。术后选择巩固化疗66例(60%),巩固放疗74例(67.2%),巩固内分泌治疗42例(38.2%),治疗方法有交叉。
2.放疗野选择
(1) 胸壁照射:患者采取仰卧位,用专用装置固定,使患侧上肢外展并外旋,胸壁平坦而薄的患者(< 3 cm)选择6 MeV电子线,胸壁加0.5 cm厚的补偿物,胸壁厚者选用6 MV X射线,加0.5 cm厚的补偿物。胸壁野上界:锁骨头下缘水平;下界:相当于对侧乳腺皱褶下2 cm的水平;内界为体中线;外界为腋中线。小野范围:术后刀口外扩1.0~1.5 cm。
(2) 锁骨上下区照射:患者采取仰卧位,用专用装置固定。患者上肢贴近腋中线,锁骨上下区用6 MV X射线,多采用单前野照射,机架角向健侧转15°~20°以保护脊髓。锁骨上下区照射范围:上界环甲膜水平,下界在锁骨头下缘水平,内界在体中线和胸锁乳突肌的内侧1 cm处,外界在肱骨头的内缘。当照射腋窝淋巴结时,包全腋窝区。内乳淋巴结放疗可采用衔接的电子线野或扩大的切线野照射,包全受侵率最高的同侧第1~3肋间,尽量减少心脏照射体积。
3.随访及统计学处理:采用住院检查、门诊复查或电话询问方式对所有患者进行随访。随访时间为首次确诊乳腺癌时间开始,至死亡时间或末次随访时间截止。建立Excel数据库,采用SAS 9.2软件进行统计学分析。采用Kaplan-Meier法进行生存分析,单因素分析采用Log-rank检验,多因素分析采用Cox比例风险模型。P < 0.05为差异具有统计学意义。
结果1.疗效随访:中位发病年龄43岁(24~76岁),本研究中49例(44.54%)患者再次局部区域进展,中位局部进展时间:34个月(95%CI:25~42个月)。36例(32.73%)患者远处转移,中位远处转移时间:31个月(95%CI:25~38个月)。13例(11.81%)患者同时局部进展及远处转移。仅有12例(10.91%)患者至末次随访未发生疾病进展。
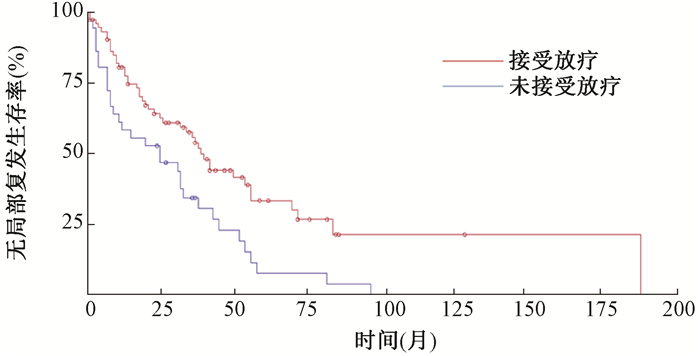
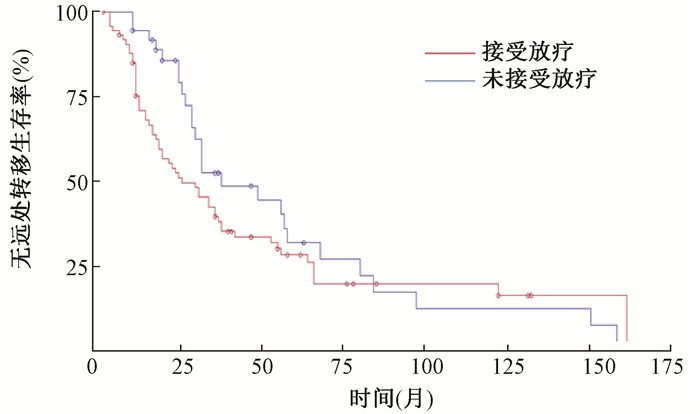
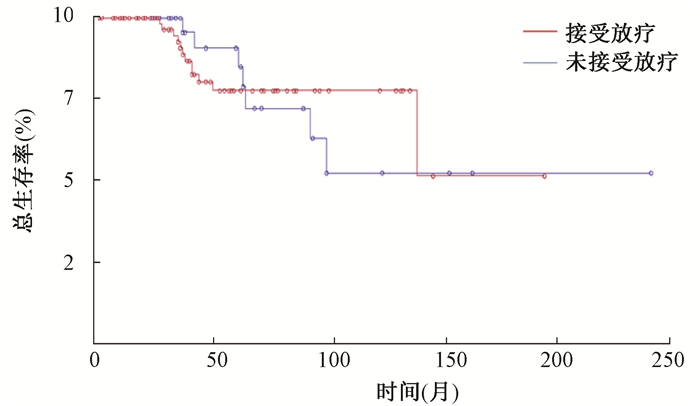
2.单因素分析结果:74例(67.3%)接受巩固放疗的患者,其中位至局部区域进展时间优于未接受放疗的36例(32.7%)患者,差异有统计学意义(χ2=8.526, 95%CI:32%~58%, P < 0.01),放射治疗可以显著降低二次局部区域复发风险。接受巩固放疗的患者的局部复发后至无远处转移生存期与未接受放疗的患者差异无统计学意义(P > 0.05);其局部区域复发后总生存期与未接受放疗的患者差异无统计学意义(P > 0.05)。见图 1,2,3。
|
图 1 放疗与局部进展时间关系 注:o.删失数据 Figure 1 The relationship between radiotherapy and local progression time |
|
图 2 放疗与无远处转移生存期关系 注:o.删失数据 Figure 2 The relationship between radiotherapy and DDFS |
|
图 3 放疗与局部区复发后总生存期关系 注:o.删失数据 Figure 3 The relationship between radiotherapy and OS |
3.多因素分析结果:将上述单因素分析中差异有统计学意义的变量及其他重要因素(年龄、雌激素受体、孕激素受体、Her-2、无病生存期、化疗、放疗、内分泌治疗、淋巴结转移个数)共9项纳入Cox回归模型,结果显示内分泌治疗、无病生存期、放疗是局部区域复发R0术后患者局部复发后总生存期的独立预后因素,差异具有统计学意义(表 1)。
|
|
表 1 局部进展时间多因素分析 Table 1 Multi-factor analysis results of local progression time |
4.受累区情况:结果见表 2。受累区定义为首次局部区域复发部位累及的部位(84例仅胸壁复发,12例仅锁骨上下区转移,13例仅腋窝转移,1例同时侵及胸壁和腋窝区)。受累区为胸壁时,胸壁复发患者R0术后接受巩固放疗可显著降低胸壁再复发率;高剂量照射组(50~70 Gy)的局部控制率好于低剂量照射组(< 50 Gy)。受累区为锁骨上下区时,锁骨上下区巩固放疗剂量为50~70 Gy可降低局部再复发率。受累区为腋窝时,是否接受腋窝巩固放疗的两组患者局部复发率相似。
|
|
表 2 巩固放疗与受累区的局部再复发关系 Table 2 The relationship between pseudo-adjuvant and the involved regions |
5.非受累区情况:结果见表 3。非受累区定义为首次局部区域复发未累及的部位,但仍然在患侧胸壁或淋巴引流区域。非受累区为胸壁时,病例数少,但也提示非受累区的胸壁可能还应该接受巩固放疗。非受累区为锁骨上下区时,作为非受累区接受50~70 Gy巩固放疗,其转移率小于放射剂量不足50 Gy者。非受累区为腋窝区、内乳区时,巩固放疗与不放疗患者腋窝转移率相似。
|
|
表 3 巩固放疗与非受累区的局部再复发关系 Table 3 The relationship between pseudo-adjuvant and the non-involved regions |
讨论
有研究结果显示,局部区域复发后选择手术治疗,总有效率能够超过70%,可提高5年内的生存率[3]。也有学者提出原发肿瘤体积≥1 cm3时,肿瘤细胞可能已经进入血流,达到全身播散[4]。但对于术后是否应该选择局部放疗,如果选择放疗,具体方案如何,没有具体阐述。而本研究选取预后较好的局部区域复发后接受R0手术的110例患者进行分析,其同致性较高,分析结果较可信。
有资料显示,有45.0%的局部区域复发乳腺癌患者会出现远处转移,但良好的局部控制率可以延长无远处转移时间,并可能提高总生存率[5]。也有学者认为局部放疗可以改善生存质量,但不能提高生存率[6]。美国乳腺与肠道外科辅助治疗研究组(NSABP)通过9年随访指出,乳腺癌局部区域复发后是否接受放疗对患者无远处转移生存期和局部复发后总生存期没有显著性差别[7]。本研究至末次随访,乳腺癌局部区域复发R0术后接受巩固放疗患者的中位至无远处转移生存期、局部区域复发后总生存期与未接受放疗的患者差异无统计学意义(P > 0.05),同NSABP随访结果一致。分析原因, 本研究中患者除接受局部放疗外,还采取巩固内分泌治疗、化疗、靶向药物等全身综合治疗手段,治疗效果较好,中位至无远处转移时间长,由此得到局部放疗对于局部区域复发后总生存期获益甚微,导致其对局部复发后总生存期改善不显著。
乳腺癌局部区域复发可能会导致短时间内出现远处转移[8]。Cowen等[9]称局部区域复发后的乳腺癌其发生远处转移的风险比未复发的要高2.5~4.4倍。van Langenberg[10]认为局部区域复发就是远处转移的标志。有文献报道,乳腺癌根治术后的局部区域复发高峰在术后2年左右[11]。本研究中患者中位至远处转移时间31个月,多因素分析提示根治术后无病生存期是局部复发R0术后患者局部复发后总生存期的独立预后因素,无局部区域复发时间≥2年与 < 2年相比较,患者的局部区域复发后总生存期有显著延长,差异具有统计学意义。
有报道提出局部区域复发概率较高的部位是胸壁和锁骨上下区,所以这两个部位应为放疗的主要靶区[12]。本研究中局部区域复发部位也是以胸壁、锁骨上下区最多,与上述报道相符。Bedwinek等[13]报道区域淋巴结复发不行胸壁预防照射的患者,胸壁复发率达42.5%,而给予预防照射的话,其复发率可降低30.0%。同样胸壁复发不行区域淋巴结预防照射者的区域淋巴结复发率可达28.3%,而行区域淋巴结区预防照射,其局部复发率仅为7.1%。而本研究结果再次支持上述研究结论。
综上所述,乳腺癌术后局部区域复发后,首选手术完全切除病灶。胸壁及锁骨上下区应接受巩固放疗,高危区不能 < 60 Gy,低危区不能 < 50 Gy。本研究病例数较少,有些放疗记录不规范,混杂因素多,为取得共识, 尚需作更多的大规模、多中心随机分组研究。
利益冲突 无作者贡献声明 王岳负责实验操作和论文撰写;孙慧茹参与数据录入;孟祥颖参与课题设计和指导结果分析与讨论;孙冰、宋三泰参与课题设计;吴世凯负责提出研究思路、结果分析讨论、指导论文写作和修改论文
| [1] |
Sharma R, Rourke LL, Kronowitz SJ, et al. Management of local-regional recurrence following immediate breast reconstruction in patients with early breast cancer treated without postmastectomy radiotherapy[J]. Plast Reconstr Surg, 2011, 127(5): 1763-1772. DOI:10.1097/PRS.0b013e31820cf24c |
| [2] |
Cardoso F, Harbeck N, Fallowfield L, et al. Locally recurrent or metastatic breast cancer:ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2012, 23(Suppl 7): vii11-19. DOI:10.1093/annonc/mds232 |
| [3] |
牛钊峰. 乳腺癌术后复发的临床因素及再治疗的分析[J]. 世界最新医学信息文摘(电子期刊), 2016, 16(39): 73-74. Niu ZF. Analysis of the clinical factors and retreatment of postoperative recurrence of breast cancer[J]. World Latest Med Inform (Electronic Version), 2016, 16(39): 73-74. DOI:10.3969/j.issn.1671-3141.2016.39.043 |
| [4] |
李树玲. 乳腺肿瘤学[M]. 2版. 北京: 科技文献出版社, 2007, 93-95. Li SL. Mammary oncology[M]. 2nd ed. Beijing: Scientific and Technical Documents Publishing House, 2007, 93-95. |
| [5] |
Anderson SJ, Wapnir I, Dignam JJ, et al. Prognosis after ipsilateral breast tumor recurrence and locoregional recurrences in patients treated by breast-conserving therapy in five National Surgical Adjuvant Breast and Bowel Project protocols of node-negative breast cancer[J]. J Clin Oncol, 2009, 27(15): 2466-2473. DOI:10.1200/JCO.2008.19.8424 |
| [6] |
Clarke M, Collins R, Darby S, et al. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival:an overview of the randomised trials[J]. Lancet, 2005, 366(9503): 2087-2106. DOI:10.1016/S0140-6736(05)67887-7 |
| [7] |
Fisher B, Wickerham DL, Deutsch M, et al. Breast tumor recurrence following lumpectomy with and without breast irradiation:an overview of recent NSABP findings[J]. Semin Surg Oncol, 1992, 8(3): 153-160. |
| [8] |
Jeong Y, Kim SS, Gong G, et al. Prognostic factors for distant metastasis in patients with locoregional recurrence after mastectomy[J]. J Breast Cancer, 2015, 18(3): 279-284. DOI:10.4048/jbc.2015.18.3.279 |
| [9] |
Cowen D, Jacquemier J, Houvenaeghel G, et al. Local and distant recurrence after conservative management of "very low-risk" breast cancer are dependent events:a 10-year follow-up[J]. Int J Radiat Oncol Biol Phys, 1998, 41(4): 801-807. DOI:10.1016/S0360-3016(98)00144-8 |
| [10] |
van Langenberg A. Prognosis after breast recurrence following conservative surgery and radiotherapy in patients with node-negative breast cancer[J]. Br J Surg, 2000, 87(5): 681. DOI:10.1046/j.1365-2168.2000.01430-2.x |
| [11] |
Pisansky TM, Ingle JN, Schaid DJ, et al. Patterns of tumor relapse following mastectomy and adjuvant systemic therapy in patients with axillary lymph node-positive breast cancer. Impact of clinical, histopathologic, and flow cytometric factors[J]. Cancer, 1993, 72(4): 1247-1260. DOI:10.1002/(ISSN)1097-0142 |
| [12] |
王淑莲, 李雄, 余子豪. 早期乳腺癌根治术后放射治疗靶区的确定[J]. 中华放射肿瘤学杂志, 2001, 10(4): 223-227. Wang SL, Li X, Yu ZH. Targetting in postmastectomy radiotherapy for early stage breast cancer[J]. Chin J Radiat Oncol, 2001, 10(4): 223-227. DOI:10.3760/j.issn:1004-4221.2001.04.003 |
| [13] |
Bedwinek JM, Lee J, Fineberg B, et al. Prognostic indicators in patients with isolated local-regional recurrence of breast cancer[J]. Cancer, 1981, 47(9): 2232-2235. DOI:10.1002/(ISSN)1097-0142 |
 2018, Vol. 38
2018, Vol. 38


