与全乳腺切除术相比,早期乳腺癌保乳术后辅助放疗的局部复发率和总生存率相似,但保乳术后辅助放疗具有良好的美容效果[1]。目前早期乳腺癌患者行术后全乳腺放疗(whole breast irradiation,WBI)已成为标准的治疗模式之一[2]。浸润性乳腺癌患者保乳手术通过行WBI可降低2/3的局部复发率,瘤床同步推量照射(simultaneous integrated boost,SIB)可以在全乳45~50 Gy剂量的基础上进一步提高局部控制率,SIB对于60岁以下的患者获益更显著[3]。研究显示,保乳手术后瘤床附近是高危复发区,而同侧乳腺内远离瘤床的区域复发率与对侧乳腺相似[4],所以对术后瘤床进行增量照射是必要的。因此,缩短总疗程、缩小照射范围的加速部分乳腺照射(accelerated partial breast irradiation,APBI)得到了越来越广泛的应用[5-8]。本研究针对早期乳腺癌保乳术后辅助放疗的全过程运用统计学方法进行疗效评价,可为临床决策提供帮助。
资料与方法1.病例选择:选取2009年7月—2014年12月吉林省肿瘤医院收治的早期乳腺癌保乳术后放疗患者。入组标准:年龄≥45岁的女性患者按照2002版国际抗癌联盟(UICC)及美国癌症联合会(AJCC)TNM分期标准[9]术后分期为T0~1N0~1M0期,均接受早期乳腺癌保乳手术,且术后切缘阴性(> 2 mm)。排除标准:新辅助化疗后;切缘(+);未作腋窝手术;广泛淋巴-血管间隙浸润;导管原位癌(ductal carcinoma in situ, DCIS) > 3 cm;BRCA 1或2突变;≥T2期的浸润性乳腺癌;浸润性小叶癌或其他浸润性癌但含有小叶癌成分;钼靶呈现广泛钙化累及超过1个象限或切缘持续阳性;临床或影像学可以或证实内乳淋巴结转移;乳头派杰氏病;治疗过程中出现远处转移;伴妊娠;双乳腺癌;三阴乳腺癌;有其他肿瘤病史;有其他严重内科系统疾病及精神方面疾病。回顾性分析纳入355例早期乳腺癌保乳术后患者,其中177例接受加速部分乳腺照射(ABPI),178人接受全乳腺照射瘤床同步推量照射(WBI-SIB)。患者临床特征列于表 1。
|
|
表 1 355例早期乳腺癌术后患者的临床资料 Table 1 Clinical pathological characteristics of the 355 early stage breast cancer patients |
2.治疗方法:所有患者都采用Synergy直线加速器(瑞典Elekta公司)束流调强放疗。患者仰卧于乳腺托架上,真空垫固定,乳腺用铅丝标记,乳腺手术瘢痕处也贴铅丝标记。在飞利浦大孔径定位CT (荷兰)获得定位图像,放疗专科医师勾画靶区后传输至计划系统制定治疗计划,最后将治疗计划、CT定位图像分别传输至MOSAIQ治疗验证系统。ABPI组靶区勾画遵照肿瘤放射治疗协作组(RTOG) 0319[10],术腔大体肿瘤体积(GTV):依据CT显示的术后瘤床和(或)手术时放置的金属夹确定;临床靶体积(CTV):术腔外放10 mm,前方不超过皮肤表面下5 mm,后方不超过乳腺组织后缘(不包括胸壁、胸肌、肺);计划靶体积(PTV):临床靶体积外放10 mm。靶区剂量:单次3.85 Gy/次,2次/d,两次放疗间隔6 h以上,总剂量38.5 Gy。WBI-SIB组靶区勾画遵照国际辐射单位与测量委员会(ICRU) 83报告[11],术腔大体肿瘤体积(GTV):依据CT显示的术后瘤床或手术时放置的金属夹确定;PGTV:GTV外扩0.5 cm。CTV:患侧全乳腺,前方不超过皮肤表面下5 mm,后方不超过乳腺组织后缘(不包括胸壁、胸肌、肺);PTV:临床靶体积外放5 mm,前方不超过皮肤表面下5 mm。靶区剂量:全乳腺单次2 Gy/次,1次/d,25次,总剂量50 Gy。术后瘤床:单次2.4 Gy,1次/d,25次,总剂量60 Gy。危及器官限量:ABPI组:同侧乳腺V50%≤60%(接受50%处方剂量的体积≤60%)、V100%≤35%,对侧乳腺Dmax≤3%(最大剂量小于处方剂量的3%);同侧肺V30% < 10%;对侧肺V5% < 10%;心脏:右侧患者V5% < 5%;左侧患者V5% < 50%;甲状腺Dmax≤3%。WBI-SIB组:双侧肺V20 Gy < 20%(接受20 Gy剂量的体积 < 20%);心脏V30 Gy < 40%,V40 Gy < 30%;对侧乳腺Dmax≤3%;甲状腺Dmax≤3%。评估的计划靶体积的优化目标为95%处方剂量≥95%体积、最大剂量 < 110%处方剂量、最小剂量 > 93%处方剂量。
3.随访及评价标准:随访从放疗结束第1天开始计算,随访时间以月为单位进行计算。局部或区域复发指临床或组织学显示同侧乳腺或区域淋巴结复发,远处转移指临床及影像学检查显示有远处转移。不良反应评价采用不良反应NCI-CTC 3.0标准。美容评价依据Harris美容级别标准。
4.统计学处理:采用SPSS 19.0软件进行统计学分析。等级/频数表资料采用χ2检验。生存分析采用Kaplan-Meier方法,生存期组间比较采用Log-Rank法。P < 0.05为差异有统计学意义。
结果1.疗程及疗效比较:所有患者均完成治疗计划。APBI组全程平均治疗时间为9.7 d(7~15 d)。WBI-SIB组全程平均治疗时间为36.2 d(33~42 d)。两组对比,APBI组平均时间缩短了26.5 d(χ2=40.76,P < 0.05)。
随访至2017年12月,中位随访42个月(5.8~92.7个月)。局部区域复发15例,其中APBI组8例,WBI-SIB组7例;全组发生远处转移26例,其中APBI组10例,WBI-SIB组16例;全组死亡35例,其中APBI组17例,WBI-SIB组18例。两组相比较,3年无局部区域复发生存率(LRFS)、无远处转移率(DMFS)、无病生存率(DFS)和总生存率(OS)的差异均无统计学意义(P > 0.05,图 1)。
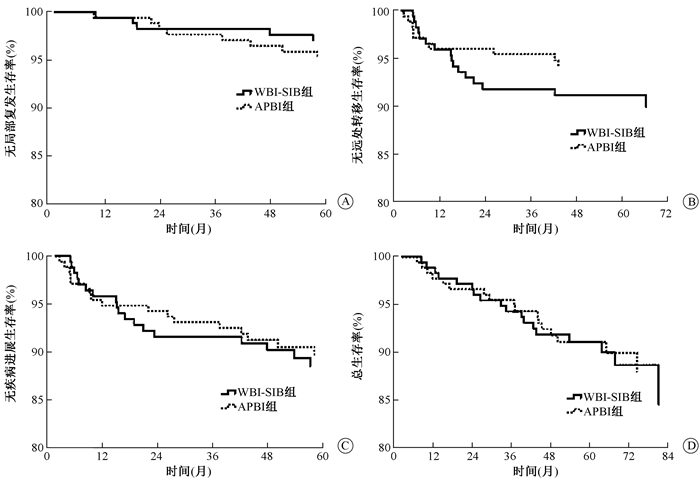
|
图 1 ABPI组和WBI-SIB组的生存率比较A.无局部区域复发生存率(LRFS);B.无远处转移生存率(DMFS);C.无疾病进展生存率(DFS);D.总生存率(OS) Figure 1 Comparison of survival rates between ABPI and WBI-SIB groups A. Loco-regional recurrence free survival (LRFS); B. Distant metastasis free survival (DMFS); C. Disease-free survival (DFS); D. Overall survival(OS) |
2.不良反应比较及美容效果:全组患者急性放射性不良反应轻微。从放疗开始至放疗结束3个月内发生急性期反应:全组未见3级以上急性不良反应。与WBI-SIB组相比,APBI组的2级急性期反应较轻(3.4% vs. 5.6%,χ2=6.044,P < 0.05)。放疗结束6周内所有1级急性皮肤反应均完全缓解。至随访结束,全组未出现3级以上晚期放射性不良反应,APBI组4例2级晚期不良反应,WBI-SIB组10例2级晚期不良反应,差异有统计学意义(2.3% vs. 5.6%,χ2=6.149,P < 0.05,表 2)。
|
|
表 2 APBI组和WBI-SIB组的早期及晚期不良反应 Table 2 Acute and late toxicity after radiotherapy between APBI group and WBI-SIB group |
美容效果:全组治疗前美容效果优秀+良好的患者共333例(93.8%),APBI组为166例(93.8%),WBI-SIB组167例(93.8%),两组差异无统计学意义(P > 0.05)。放疗结束6个月后,经评价美容效果优秀+良好的患者APBI组为166例(93.8%),WBI-SIB组158例(88.8%),两组差异有统计学意义(χ2=5.220,P < 0.05, 表 3)。
|
|
表 3 放疗前后两组患侧乳房美容效果评估 Table 3 Cosmetic outcomes before and after radiotherapy between two group |
讨论
乳腺癌为中国女性发病率首位的恶性肿瘤,2015年新发病例约24.9万,呈明显上升趋势[12]。早期乳腺癌保乳术后辅助放疗的局部复发率及总体生存率与全乳切除相似,且具有良好的美容效果,使患者的生活质量亦获得提高,已被作为早期乳腺癌的标准治疗模式之一[13]。目前,临床上乳腺癌保乳术后放疗的照射范围及剂量为患侧乳房50 Gy/25次,对瘤床补量照射10 Gy/5次,总疗程需要6~7周,常规分割剂量照射给患者带来较大的心理及经济压力,从而使一些患者很难坚持而选择放弃放疗,对患者的预后造成较大影响。近年来,早期乳腺癌保乳术后的加速部分乳腺照射(APBI)模式越来越受到关注。经病理学证实乳腺癌包块切除术后瘤床周围1~2 cm范围是最高危的复发区域,80%~90%的同侧乳房复发位于瘤床,而瘤床外复发极为少见[14-15]。这一病理学研究结果奠定APBI的理论基础,即把一部分乳腺组织(主要是瘤床区)作为靶区进行照射。采用大分割模式与常规分割放疗模式相对生物总剂量等效的前提下,增加每次照射剂量(>2 Gy/次),减少照射总剂量,从而使治疗总时间缩短。因其治疗时间短,不良反应小而迅速成为临床研究的热点。
目前国际上有多项加速部分乳腺照射对比全乳腺照射的多中心随机对照试验。英国一项Ⅲ期临床随机研究皇家马斯登医院/格洛斯特郡肿瘤学中心(RMH/GOC)纳入1410例早期乳腺癌保乳术后患者,随机分为3组:39.0 Gy/13次、42.9 Gy/13次和50.0 Gy/25次,共5周。随访10年发现这3组患侧乳腺局部区域复发的概率分别为14.8%、9.6%和12.1%,临床疗效和治疗不良反应比较差异均无统计学意义(P=0.027)[16]。英国START A试验纳入2 236例早期乳腺癌保乳术后患者,随机分为3组:39.0 Gy/13次、41.6 Gy/13次和50.0 Gy/25次,共5周,中位随访时间为9.3年。结果显示,3组无病生存期和总生存期比较差异无统计学意义;在发生中度或显著乳房硬结、乳腺毛细血管扩张及乳房水肿方面,39 Gy/13次组较常规分割组减少,但41.6 Gy/13次组与常规分割组比较差异无统计学意义[17]。GEC-ESTRO研究是一项Ⅲ期临床试验,该研究入组了1 184例分期为0、Ⅰ、ⅡA期且接受保乳手术的早期乳腺癌患者,将患者随机分为APBI组和全乳放疗组,中位随访6.6年后,APBI组和全乳放疗组的5年同侧乳腺肿瘤复发率(IBTR)率差异无统计学意义(1.44% vs. 0.92%,P=0.42),两组的5年总生存率和不良反应差异也没有统计学意义[18]。近期,Polgár等[19]报道了一项来自欧洲16个国家的多中心、随机、对照Ⅲ期临床试验,共纳入1 328名早期乳腺癌患者,随机将患者分配进接受WBI(50 Gy)+瘤床外加量(10 Gy)或APBI+组织间插植放疗。中位随访6.6年的结果,两组的临床疗效相似,5年不良反应和美容结果相近,但APBI组中的2~3级迟发皮肤不良反应显著少于全乳照射组(6.9% vs. 10.7%, P=0.020)。本研究分析结果与上述研究结果相似,ABPI组和WBI-SIB组的3年无局部区域复发生存率、无远处转移生存率、无疾病进展生存率和总生存率差异均无统计学意义。ABPI组与WBI-SIB组比较,2级以上急性不良反应发生率降低,2级以上晚期不良反应降低,美容效果更佳。
本研究是国内较早报道较大样本量的APBI对比WBI-SIB的临床研究,纳入355例早期乳腺癌保乳术后放疗患者。ABPI组与WBI-SIB组相比缩短了平均治疗时间26.5 d。
本研究也存在不足,首先为回顾性对照临床研究,全组患者按照标准纳入分析,3年的随访结果显示全组局部区域复发15例,发生远处转移26例,死亡35例。ABPI组和WBI-SIB组的死亡发生率(9.6% vs. 10.0%)均较高,其中非肿瘤因素死亡ABPI组4例,WBI-SIB组5例,另外一部分患者未进行规范的内分泌治疗、化疗以及靶向治疗,影响预后,有待开展大样本的前瞻性随机对照临床研究。
综述所述,加速部分乳腺照射与常规分割放疗的安全性和有效性类似,甚至更有优势,且加速部分乳腺照射的应用缩短了治疗时间,减少了医疗资源,亦具有经济学优势。
利益冲突 本项目接受吉林省卫生计生适宜技术推广项目(20165017)资助,作者及配偶、工作伙伴和子女无影响研究结果的财务关系作者贡献声明 岳丹负责整理和分析数据、论文撰写和修改;杨永净和赵玲负责进行试验;卜明伟负责物理计划设计;李忠负责操作放疗仪器;刘士新和吴洪芬负责提出研究思路、设计研究方案
| [1] |
Darby S, Davies C, Mcgale P. The Early Breast Cancer Trialists' Collaborative Group:a brief history of results to date[J]. Celebrating Statistics, 2005, 185-197. DOI:10.1093/acprof:oso/9780198566540.003.0010 |
| [2] |
Roukos DH, Kappas AM, Agnantis NJ. Perspectives and risks of breast-conservation therapy for breast cancer[J]. Ann Surg Oncol, 2003, 10(7): 718-721. DOI:10.1245/ASO.2003.05.925 |
| [3] |
Bartelink H, Maingon P, Poortmans P, et al. Whole-breast irradiation with or without a boost for patients treated with breast-conserving surgery for early breast cancer:20-year follow-up of a randomised phase 3 trial[J]. Lancet Oncol, 2015, 16(1): 47-56. DOI:10.1016/S1470-2045(14)71156-8 |
| [4] |
Showalter SL, Grover S, Sharma S, et al. Factors influencing surgical and adjuvant therapy in stage Ⅰ breast cancer:a SEER 18 database analysis[J]. Ann Surg Oncol, 2013, 20(4): 1287-1294. DOI:10.1245/s10434-012-2693-8 |
| [5] |
Akhtari M, Teh BS. Accelerated partial breast irradiation:advances and controversies[J]. Chin J Cancer, 2016, 35(4): 163-170. DOI:10.1186/s40880-016-0095-1 |
| [6] |
Vicini FA, Baglan KL, Kestin LL, et al. Accelerated treatment of breast cancer[J]. J Clin Oncol, 2001, 19(7): 1993-2001. DOI:10.1200/JCO.2001.19.7.1993 |
| [7] |
Veronesi U, Orecchia R, Maisonneuve P, et al. Intraoperative radiotherapy versus external radiotherapy for early breast cancer (ELIOT):a randomised controlled equivalence trial[J]. Lancet Oncol, 2013, 14(13): 1269-1277. DOI:10.1016/S1470-2045(13)70497-2 |
| [8] |
Njeh CF, Saunders MW, Langton CM. Accelerated partial breast irradiation using external beam conformal radiation therapy:a review[J]. Crit Rev Oncol Hematol, 2012, 81(1): 1-20. DOI:10.1016/j.critrevonc.2011.01.011 |
| [9] |
Wittekind C, Oberschmid B. TNM classification of malignant tumors 2010:General aspects and amendments in the general section[J]. Pathologe, 2010, 31(5): 333-334, 336-338. DOI:10.1007/s00292-010-1301-6 |
| [10] |
Vicini F, Winter K, Straube W, et al. A phase Ⅰ/Ⅱ trial to evaluate three-dimensional conformal radiation therapy confined to the region of the lumpectomy cavity for stage Ⅰ/Ⅱ breast carcinoma:initial report of feasibility and reproducibility of Radiation Therapy Oncology Group (RTOG) Study 0319[J]. Int J Radiat Oncol Biol Phys, 2005, 63(5): 1531-1537. DOI:10.1016/j.ijrobp.2005.06.024 |
| [11] |
Hodapp N. The ICRU Report 83:prescribing, recording and reporting photon-beam intensity-modulated radiation therapy (IMRT)[J]. Strahlentherapie Und Onkologie, 2012, 188(1): 97-99. DOI:10.1007/s00066-011-0015-x |
| [12] |
Li T, Mellothoms C, Brennan PC. Descriptive epidemiology of breast cancer in China:incidence, mortality, survival and prevalence[J]. Breast Cancer Res Treat, 2016, 159(3): 395-406. DOI:10.1007/s10549-016-3947-0 |
| [13] |
McGale P, Taylor C, Correa C, et al. Effect of radiotherapy after mastectomy and axillary surgery on 10-year recurrence and 20-year breast cancer mortality:meta-analysis of individual patient data for 8135 women in 22 randomised trials[J]. Lancet, 2014, 383(9935): 2127-2135. DOI:10.1016/S0140-6736(14)60488-8 |
| [14] |
Wickberg A, Holmberg L, Adami HO, et al. Sector resection with or without postoperative radiotherapy for stage Ⅰ breast cancer:20-year results of a randomized trial[J]. J Clin Oncol, 2014, 32(8): 791-797. DOI:10.1200/JCO.2013.50.6600 |
| [15] |
Liljegren G, Holmberg L, Bergh J, et al. 10-year results after sector resection with or without postoperative radiotherapy for stage Ⅰ breast cancer:a randomized trial[J]. J Clin Oncol, 1999, 17(8): 2326-2333. DOI:10.1200/JCO.1999.17.8.2326 |
| [16] |
Owen JR, Ashton A, Bliss JM, et al. Effect of radiotherapy fraction size on tumour control in patients with early-stage breast cancer after local tumour excision:long-term results of a randomised trial[J]. Lancet Oncol, 2006, 7(6): 467-471. DOI:10.1016/S1470-2045(06)70699-4 |
| [17] |
Haviland JS, Owen JR, Dewar JA, et al. The UK Standardisation of Breast Radiotherapy (START) trials of radiotherapy hypofractionation for treatment of early breast cancer:10-year follow-up results of two randomised controlled trials[J]. Lancet Oncol, 2013, 14(11): 1086-1094. DOI:10.1016/S1470-2045(13)70386-3 |
| [18] |
Polgár C, Van Limbergen E, Pötter R, et al. Patient selection for accelerated partial-breast irradiation (APBI) after breast-conserving surgery:recommendations of the Groupe Européen de Curiethérapie-European Society for Therapeutic Radiology and Oncology (GEC-ESTRO) breast cancer working group based on clinical evidence (2009)[J]. Radiother Oncol, 2010, 94(3): 264-273. DOI:10.1016/j.radonc.2010.01.014 |
| [19] |
Polgár C, Ott OJ, Hildebrandt G, et al. Late side-effects and cosmetic results of accelerated partial breast irradiation with interstitial brachytherapy versus whole-breast irradiation after breast-conserving surgery for low-risk invasive and in-situ carcinoma of the female breast:5-year results of a randomised, controlled, phase 3 trial[J]. Lancet Oncol, 2017, 18(2): 259-268. DOI:10.1016/S1470-2045(17)30011-6 |
 2018, Vol. 38
2018, Vol. 38


