结直肠癌是较为常见的消化道恶性肿瘤,近年来我国结直肠癌的发病率和死亡率呈逐步上升趋势,放疗成为中晚期患者的主要治疗方案,但治疗效果差强人意,其中仅有小部分患者对放疗敏感。研究发现结直肠癌干细胞表面有许多高表达的标志物,其中癌基因Musashi1(Msi1)是当下研究的热点,因其与肿瘤的分期、淋巴结转移、ki-67、放化疗敏感性密切相关[1]。Musashi1(Msi1)是一种进化保守型RNA结合蛋白(RBP),Msi1作为RBP家族重要一员,通过RRM与超过60多个靶基因的mRNA 3′端非编码区的特定序列特异性结合,这些靶基因与结肠癌的放疗敏感性密切相关[2-3]。因此,可通过研究Musashi1对结直肠癌放疗敏感性的影响,指导临床治疗,为当代放射肿瘤学提供新的治疗靶点。
材料与方法1.细胞株与试剂:结肠癌HCT116细胞株、慢病毒载体、沉默Msi1慢病毒液、阴性对照组慢病毒液均由上海吉凯基因化学技术有限公司提供。McCoy′s5A培养基、胎牛血清(FBS)购于美国GIBCO公司,Pen-Strep溶液购于美国Biological Industries公司,DMSO购于北京Solarbio公司,Anti-β-肌动蛋白、Anti-Msi1购于美国Santa Cruz公司,PEAnexinV Apoptosis DetectionKi、碘化丙啶(PI)、RNA酶购于美国BD公司,单溶液细胞增殖检测试剂盒购于美国Promega公司。
2.细胞培养:细胞贴壁生长,加入含100 U/ml青霉素和100 μg/ml链霉素以及10%胎牛血清的McCoy′s 5A培养基,置于37℃、5%CO2饱和湿度的培养箱中培养。
3.构建沉默Msi1的细胞系:取细胞悬液中5×104的目的细胞接种于6孔板中,置于培养箱中继续培养,按病毒侵染感染复数(MOI)值为20,分别向其中加入适量的携带阴性对照的病毒载体和沉默Msi1的病毒载体的病毒液,再向其中加入适量polybrene,均匀混合培养,侵染72 h后转入培养瓶中继续培养。
4.检测沉默效率:以GAPDH为内参,应用SYBR Green荧光染料法检测Msi1在HCT116-Msi1稳转株中mRNA表达, 以β-肌动蛋白为内参,应用Western blot法检测Msi1在HCT116-Msi1稳转株中蛋白表达情况。实验重复3次。最终将细胞分为3组:Msil低表达的沉默组,携带病毒载体的阴生对照组及HCT116细胞不做任何处理的空白对照组。
5.细胞外照射:采用瑞典医科达公司医用直线加速器进行细胞照射,6 MV X射线,照射野面积设为20 cm×20 cm,吸收剂量率200 cGy/min,源靶距100 cm,机架角为180°,在培养瓶或培养板下放置1 cm补偿膜进行组织补偿,室温条件下进行照射。
6.集落形成实验检测细胞放射敏感性:3组细胞按浓度梯度500~4 000个细胞分别接种于6孔板中,待细胞贴壁生长24 h后,每组细胞按由低到高的细胞接种密度接受0、2、4、6、8 Gy单次照射,照射后继续在培养箱中培养10~14 d,或当出现肉眼可见的克隆时终止培养,用甲醇固定细胞,0.2%结晶紫染色,显微镜下计数多于50个细胞的克隆数,计算克隆形成率(PE)和不同剂量点的细胞存活分数(SF)。PE%=未照射组克隆数/接种细胞数×100%,SF=照射组克隆数/(接种细胞数×PE)。实验重复3次。
7.流式细胞仪检测各组细胞凋亡:取对数生长期的3组细胞,分别接受0、8 Gy照射后的24、48、72 h常规消化收集细胞,用1×结合缓冲液将细胞重悬,取1×105细胞,向其加入5 μl AnnexinV-PE和5 μl 7-AAD,于室温避光孵育15 min,再向每管中加入400 μl的1×结合缓冲液,用流式细胞仪检测。实验重复3次。
8.流式细胞仪检测各组细胞周期:取对数生长期的3组细胞,分别接受0、12 Gy照射后,于48 h常规消化,以冷PBS洗涤3次后收集2×106细胞,加入70%的乙醇于4℃固定过夜,过滤,PBS清洗2次,每管加入2.5 μl的RNaseA(10 mg/ml)室温孵育20 min,再加入25 μl PI染液(1 mg/ml),室温避光保存15 min,上机检测。实验重复3次。
9.统计学处理:所有数据采用SPSS 13.0软件进行分析,符合正态分布,结果用x±s表示,两组间比较用独立样本t检验,多组间比较采用单因素方差分析,重复测量设计资料采用方差分析,两两比较采用SNK检验。P < 0.05为差异有统计学意义。
结果1. Msi1 RNA水平、蛋白水平的沉默效率:以GAPDH为内参,应用SYBR Green荧光染料法检测Msi1在HCT116-Msi1稳转株中mRNA表达情况,与空白对照组(1.213±0.301)、阴性对照组(1.197±0.285)相比,沉默组细胞中的Msi1 mRNA表达量(0.311±0.04)下降,沉默效率为74%,其差异有统计学意义(F=13.956,P < 0.05);而空白对照组与阴性对照组之间,差异无统计学意义(P > 0.05)。
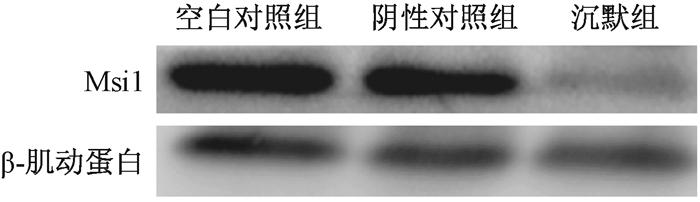
以β-肌动蛋白为内参,应用Western blot法检测Msi1在HCT116-Msi1稳转株中蛋白表达情况,结果显示,与空白对照组、阴性对照组相比,沉默组细胞中的Msi1蛋白表达量下降59%,差异有统计学意义(F=11.137,P < 0.05);空白对照组与阴性对照组相比,Msi1蛋白表达量差异无统计学意义(P > 0.05),见图 1。
|
图 1 沉默组、空白对照组和阴性对照组中Msi1蛋白的表达情况 Figure 1 Western blot assay of Msi1 protein of the Msi1 silence group, control group and NC group |
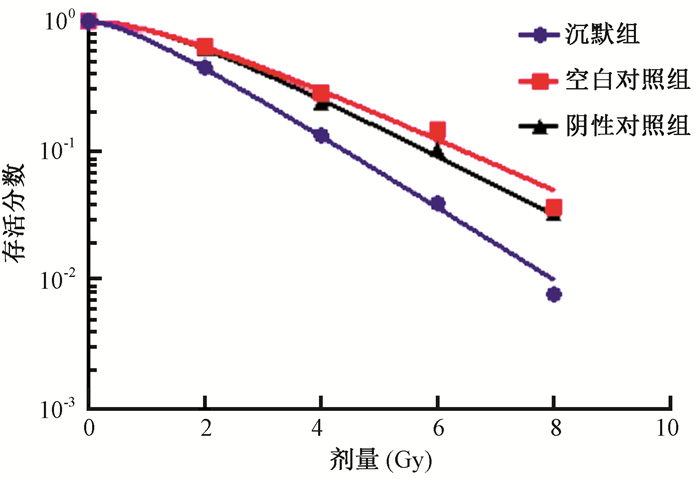
2.集落形成实验检测细胞放射敏感性:结果见图 2,表 1。根据单击多靶模型拟合生存曲线,沉默组D0、Dq、N、SF2分别为1.55、0.88、1.76 Gy和0.43,空白对照组分别为2.17、1.51、2.01 Gy和0.64,阴性对照组分别为1.99、1.45、2.07 Gy和0.62。沉默组相对于空白对照组的放射增敏比为1.40,相对于阴性对照组的放射增敏比为1.28。沉默组的细胞放射敏感性明显高于阴性对照组和空白对照组。
|
图 2 沉默组、空白对照组和阴性对照组细胞的生存曲线 Figure 2 Cell survival curves of the Msi1 silence group, control group and NC group |
|
|
表 1 细胞生存曲线相关参数 Table 1 The fitting parameters of cell survival curves |
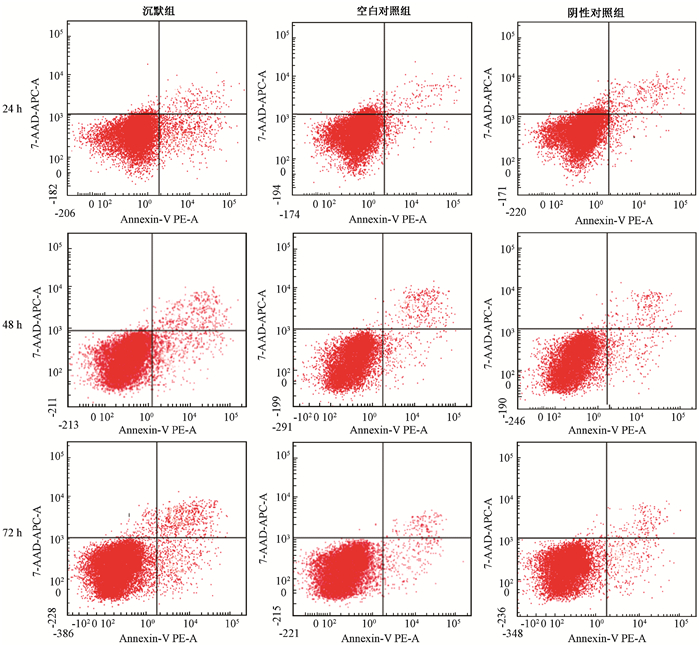
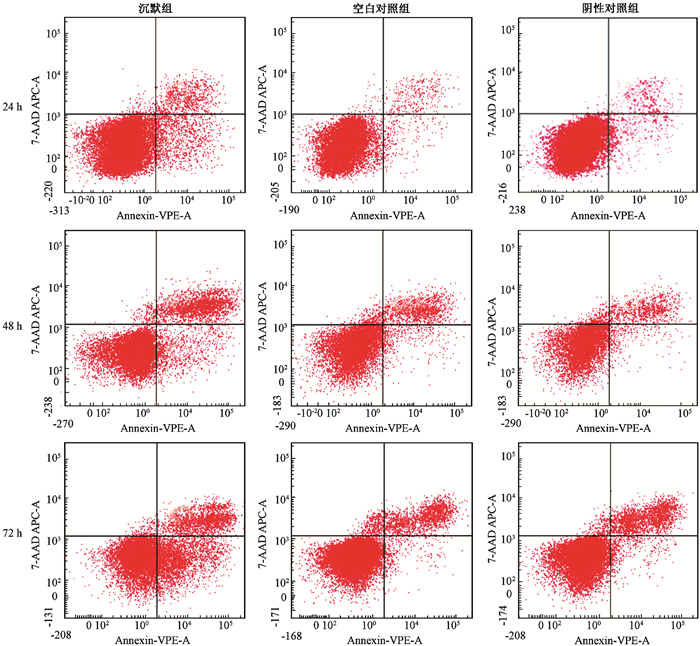
3.未照射及照后细胞凋亡情况:结果见图 3,4,表 2。未照射时,沉默组细胞凋亡数高于空白对照组和阴性对照组(t=12.905、11.358、15.068,P < 0.05;t=19.194、16.507、14.001,P < 0.05)。8 Gy照射后,各组细胞凋亡比例均增加,沉默组在照射后的24、48、72 h的凋亡比例均高于空白对照组和阴性对照组,差异有统计学意义(F=122.638、577.481、245.369,P < 0.05),但空白对照组和阴性对照组之间差异无统计学意义(P > 0.05),各组凋亡比例随着时间的增加而增加,沉默组凋亡比例在各时间点增加的程度更加明显(F=65.16,P < 0.05),可见凋亡比例呈现时间-剂量依赖性。
|
图 3 未照射的沉默组、空白对照组、阴性对照组照后不同时间细胞凋亡情况 Figure 3 Cell apoptosis rate of the Msi1 silence group, control group and NC group |
|
|
表 2 沉默组、空白对照组和阴性对照组在0、8 Gy照射后不同时间点的细胞凋亡数(%,x±s) Table 2 Apoptosis index of the Msi1 silence group, control group and NC group at different time after 0 Gy and 8 Gy irradiation(%, x±s) |
|
图 4 8 Gy照射后不同时间沉默组、空白对照组、阴性对照组细胞凋亡情况 Figure 4 Cell apoptosis rate of the Msi1 silence group, control group and NC group at 24 h, 48h and 72h after 8 Gy X-ray irradiation |
4.照后细胞周期变化:结果见图 5,表 3。12 Gy照射后48 h,空白对照组和阴性对照组的细胞周期与未照射相比,G2/M期细胞明显增多(t=8.588、5.317,P < 0.05), 而照射后沉默组G2/M期比例较后两组明显下降,差异有统计学意义(F=65.398,P < 0.05)。
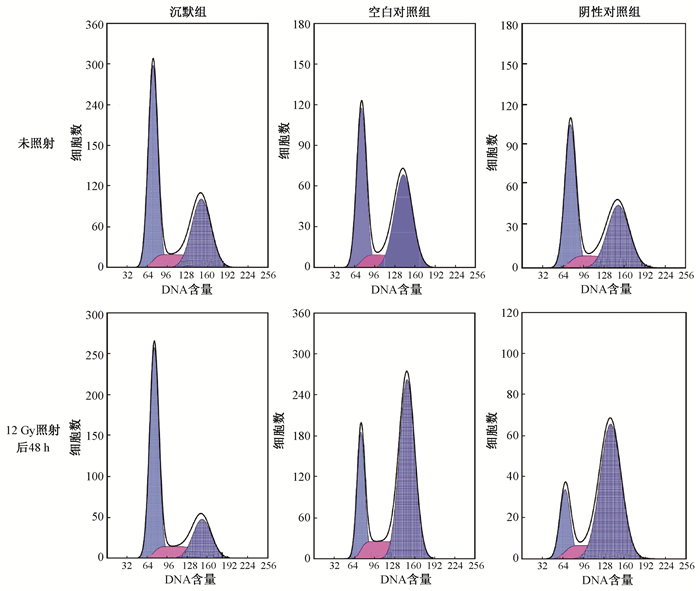
|
图 5 沉默组、空白对照组、阴性对照组0和12 Gy射线照后48 h细胞周期分布 Figure 5 Flow cytometry assay of cell cycle distribution of the Msi1 silence group, control group and NC group at 48h after 0 and 12 Gy X-ray irradiation |
|
|
表 3 沉默组、空白对照组和阴性对照组在0、12 Gy照射后细胞周期分布(%,x±s) Table 3 Cell cycle distribution of the Msi1 silence group, control group and NC group at 48h after 0 and 12 Gy X-ray irradiation(%, x±s) |
讨论
目前, 多数学者认为,肿瘤细胞有很大的异质性,只有极少数的具有无限增殖和自我更新能力、导致肿瘤发生的细胞,即肿瘤干细胞(cancer stem cells,CSCs)[4],它们大多处于乏氧环境、细胞周期处于G0期、较强的DNA修复能力、表达ABC转运蛋白,因此对放、化疗抗拒,是肿瘤复发和转移的根源[3, 5-7]。
人肠干细胞位于肠隐窝的1~10层细胞,通过Msi1抗体染色发现Msi1阳性区域和肠道干细胞位置一致[8]。Yousefi等[3]发现缺失Msi基因的小鼠经过12 Gy外照射后,肠上皮丧失了再生功能。Sureban等[9]和Li等[10]的研究表明,Msi1在结肠癌患者的癌组织、细胞中高表达,且Msi1高表达的患者易复发和转移,降低该基因的表达水平可以抑制肿瘤的生长。这些研究均显示高表达Msi1的细胞具有干细胞特性。随后又有研究学者在细胞和动物水平证实Msi1作为癌基因,可加剧结肠癌的发生[5]。发病机制研究发现,RNA结合蛋白(RBP)在突变的基因的转录翻译过程中发挥着重要的作用,Msi1作为RBP家族重要一员,Msi1可抑制m-Numb和p21WAF-1,并可激活Notch通路、Wnt信号通路,在肿瘤的发生、增殖、侵袭、凋亡以及细胞周期调控方面起着重要的作用[1, 11-14]。
克隆实验是验证放射增敏作用的金标准,通过计数不同剂量外照射后形成的克隆数,拟合单击多靶模型,发现照射后沉默组克隆数明显少于空白对照组及阴性对照组,提示沉默组细胞克隆形成能力显著下降,从侧面反应出沉默Msi1降低了肿瘤细胞DNA放射损伤后再修复的功能。有研究学者表示胶质瘤细胞U251接受5 Gy照射后,高表达Msi1的细胞比例增加,且辐射损伤修复基因DNA-PKcs表达也增加,克隆实验中沉默Msi1表达组在接受照射后其克隆数较对照组显著下降,证明Msi1通过调控DNA-PKcs来增加放射抗性[6]。Sureban等[9]研究指出沉默HCT116细胞中Msi1的表达,并给予12 Gy照射后,沉默Msi1联合放疗组的细胞凋亡数是单纯照射组的4倍,证明Msi1可以增加结肠癌的放疗敏感性,本实验研究结论与之类似。
Msi1作为癌基因,抑制其表达后有促进肿瘤细胞凋亡的作用[9]。本实验研究发现单纯沉默Msi1本身就有促进细胞凋亡的作用,当给予3组细胞8 Gy照射后,沉默组联合放疗后能更加明显地增加细胞凋亡数,进一步分析发现,单纯沉默Msi1引起的细胞凋亡数,加上对照组因射线导致的细胞凋亡数,低于沉默组因射线引起的细胞凋亡总数,从流式分析细胞凋亡技术角度再次印证了降低Msi1表达可能通过促进凋亡而达到放射增敏作用,这与Sureban等[9]的研究一致。
细胞放射抗性与细胞周期密切相关,大部分学者认为,机体细胞照射后细胞周期阻滞于G2/M期,因该反应有利于损伤的DNA进行修复,从而确保细胞基因组的完整性和稳定性[15-16]。Yousefi等[3]研究发现小鼠暴露于12 Gy照射后使得大部分处于静止期(G0)的肠干细胞进入细胞周期促进细胞修复,而这些细胞同时高表达Msi1,当Msi1表达缺失后细胞周期阻滞于G1期。本实验给予12 Gy外照射时,对照组细胞周期阻滞于G2/M期,有利于损伤细胞的修复,从而增加了放射抗性,但沉默组放射后细胞周期中G2/M期比例下降,可能沉默组通过解除G2/M期阻滞,使细胞在照射后得不到修复就进入了下一个细胞周期,进而细胞增殖能力减低。本实验研究结果与既往研究结果[3, 15-16]类似。综合以上研究,从客观的角度来看,肿瘤的发生、发展是多基因、多因素、多阶段参与的复杂过程,考虑肿瘤细胞中细胞周期的调控、放疗损伤修复的机制较多且相互关联,放射增敏作用不能仅仅考虑单一基因对细胞周期的影响。
体外实验表明,沉默Msi1可以增加肿瘤对放疗的敏感性,而其在人体内的增敏作用还尚待进一步研究,这可为现代放化疗提供重要治疗靶点,提高治疗有效率,降低肿瘤的复发转移率,从而使患者的生存期延长。
利益冲突 无作者贡献声明 丁博月负责实验操作及数据统计分析、论文撰写;高超、韩春负责研究方案的设计、论文撰写指导
| [1] |
Espersen ML, Olsen J, Linnemann D, et al. Clinical implications of intestinal stem cell markers in colorectal cancer[J]. Clin Colorectal Cancer, 2015, 14(2): 63-71. DOI:10.1016/j.clcc.2014.12.004 |
| [2] |
Kudinov AE, Karanicolas J, Golemis EA, et al. Musashi RNA-binding proteins as cancer drivers and novel therapeutic targets[J]. Clin Cancer Res, 2017, 23(9): 2143-2153. DOI:10.1158/1078-0432.CCR-16-2728 |
| [3] |
Yousefi M, Li N, Nakauka-Ddamba A, et al. Msi1 RNA-binding proteins control reserve intestinal stem cell quiescence[J]. J Cell Biol, 2016, 215(3): 401-413. DOI:10.1083/jcb.201604119 |
| [4] |
Wang W, Quan Y, Fu Q, et al. Dynamics between cancer cell subpopulations reveals a model coordinating with both hierarchical and stochastic concepts[J]. PLoS One, 2014, 9(1): e84654. DOI:10.1371/journal.pone.0084654 |
| [5] |
Li N, Yousefi M, Nakauka-Ddamba A, et al. The Msi family of RNA-binding proteins function redundantly as intestinal oncoproteins[J]. Cell Rep, 2015, 13(11): 2440-2455. DOI:10.1016/j.celrep.2015.11.022 |
| [6] |
de Araujo PR, Gorthi A, da SAE, et al. Musashil impacts radio-resistance in glioblastoma by controlling DNA-protein kinase catalytic subunit[J]. Am J Pathol, 2016, 186(9): 2271-2278. DOI:10.1016/j.ajpath.2016.05.020 |
| [7] |
Dawood S, Austin L, Cristofanilli M. Cancer stem cells:implications for cancer therapy[J]. Oncology (Williston Park), 2014, 28(12): 1101-1107, 1110. |
| [8] |
Plateroti M, de Araujo PR, da SAE, et al. The RNA-binding protein musashil:A major player in intestinal epithelium renewal and colon cancer development[J]. Curr Colorectal Cancer Rep, 2012, 8(4): 290-297. DOI:10.1007/s11888-012-0141-6 |
| [9] |
Sureban SM, May R, George RJ, et al. Knockdown of RNA binding protein musashi-1 leads to tumor regression in vivo[J]. Gastroenterology, 2008, 134(5): 1448-1458. DOI:10.1053/j.gastro.2008.02.057 |
| [10] |
Li D, Peng X, Yan D, et al. Msi-1 is a predictor of survival and a novel therapeutic target in colon cancer[J]. Ann Surg Oncol, 2011, 18(7): 2074-2083. DOI:10.1245/s10434-011-1567-9 |
| [11] |
Kharas MG, Lengner CJ. Stem cells, cancer, and MUSASHI in blood and guts[J]. Trends Cancer, 2017, 3(5): 347-356. DOI:10.1016/j.trecan.2017.03.007 |
| [12] |
Lan L, Appelman C, Smith AR, et al. Natural product (-)-gossypol inhibits colon cancer cell growth by targeting RNA-binding protein Musashi-1[J]. Mol Oncol, 2015, 9(7): 1406-1420. DOI:10.1016/j.molonc.2015.03.014 |
| [13] |
Huels DJ, Ridgway RA, Radulescu S, et al. E-cadherin can limit the transforming properties of activating β-catenin mutations[J]. EMBO J, 2015, 34(18): 2321-2333. DOI:10.15252/embj.201591739 |
| [14] |
Uren PJ, Vo DT, de Araujo PR, et al. RNA-binding protein musashil is a central regulator of adhesion pathways in glioblastoma[J]. Mol Cell Biol, 2015, 35(17): 2965-2978. DOI:10.1128/MCB.00410-15 |
| [15] |
李曙光, 祝淑钗, 刘志坤, 等. RNA干扰抑制STAT1基因表达对食管癌细胞放射生物效应影响[J]. 中华放射肿瘤学杂志, 2013, 22(1): 53-57. Li SG, Zhu SC, Liu ZK, et al. Effect of RNA interference of STAT1 expression on radiosensitivity and cell cycle of esophageal carcinoma cell line Eca109[J]. Chin J Radiat Oncol, 2013, 22(1): 53-57. DOI:10.3760/cma.j.issn.1004-4221.2013.01.017 |
| [16] |
刘志坤, 祝淑钗, 苏景伟, 等. 靶向沉默人基因MDC1表达对食管癌细胞放射增敏作用的实验研究[J]. 南方医科大学学报, 2010, 30(8): 1830-1834. Liu ZK, Zhu SC, Su JW, et al. Short hairpin RNA-mediated MDC1 gene silencing enhances the radiosensitivity of esophageal squamous cell carcinoma cell line ECA109[J]. J South Med Univ, 2010, 30(8): 1830-1834. |
 2018, Vol. 38
2018, Vol. 38


