肠黏膜为高度辐射敏感组织。暴露于高剂量电离辐射可引起致死性的急性放射性胃肠损伤(radiation-induced gastrointestinal syndrome,RIGS)[1]。对此,目前仍缺乏有效的治疗药物[2-3]。近年来,小肠干细胞研究取得长足进展,特别是肠道干细胞体外3D培养体系的建立为研究肠道辐射损伤和防治提供了很好的技术手段[4-5]。本研究利用体外小肠类器官3D培养技术,结合X射线照射,建立小鼠小肠类器官辐射损伤模型,观察碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)的辐射损伤保护及治疗作用。以此为基础,初步研究了表皮调节素(epiregulin)对小肠类器官的辐射损伤治疗作用,为进一步抗辐射作用研究提供基础。
材料与方法1.主要试剂和仪器:Advanced DMEM/F12培养基、4-(2-羟乙基)-1-哌嗪乙磺酸(HEPES)、L-丙氢酰-L-谷氨酰胺(GLutaMax)、双抗(青霉素/链霉素)、B27、N2购自美国Thermo Fisher公司;细胞因子R-spondin1、Noggin购自北京义翘神州科技有限公司;N-乙酰半胱氨酸(N-acetylcysteine)购自美国Sigma公司;表皮细胞生长因子(epidermal growth factor,EGF)、bFGF、表皮调节素购自美国R&D公司;乙二胺四乙酸二钠(EDTA)购自美国Ambion公司;基质胶(Metrigel)购自美国Corning公司;倒置荧光显微镜(德国ZEISS公司)。
2.照射条件:由复旦大学放射医学研究所提供X射线照射仪(美国PXI公司,RAD-320),源靶距(SSD)为50 cm,250 kV、12 mA,剂量率246 cGy/min。
3.实验小鼠:C57BL6/J雄性小鼠购自上海南方模式生物科技股份有限公司,8~10周龄,体重(24±1)g,合格证号:312024300000732。动物均饲养在温度和光照适宜的动物房内(22~25℃,12 h光照12 h黑暗交替,自由摄食、摄水)。所有动物实验操作均依照复旦大学实验动物伦理要求进行。
4.微克隆实验:小鼠予X射线全腹部照射(剑突以上使用铅板屏蔽),剂量分别为0、4、8、10、12、15 Gy,每剂量组3只。照射后3.5 d脱颈处死小鼠,取空肠组织进行HE染色,记录每个肠横截面隐窝数量(以>10个细胞且核深染,细胞饱满为阳性隐窝),用GraphPad Prism 6.0软件拟合剂量效应曲线。
5.小鼠小肠隐窝提取及培养:小鼠脱颈处死后,剪取约10 cm空肠段,经灌胃器冲洗至肠腔干净后,剪为5 mm大小片段,于含双抗PBS缓冲液(冰浴)振摇上清洗5 min× 3次。接着用含EDTA(5 mmol/L)PBS缓冲液冰浴消化40 min,手摇至液体浑浊,弃含绒毛上清,再次于PBS缓冲液中摇晃至浑浊,显微镜下可见完整隐窝。取浑浊液过100和70 μm滤网后离心收集(4℃,69×g,5 min)。沉淀经Metrigel重悬,按每孔50 μl(约含200个隐窝)接种于24孔板。于细胞培养箱中静置10 min使Metrigel凝固后,加入Advanced DMEM/F12培养基(含500 ng/ml R-spondin1,100 ng/ml Noggin,50 ng/ml EGF,1×B27,1×N2,1×双抗,1×GlutaMAX,10 mmol/L HEPES,500 μmol/L N-acetylcysteine)培养。每3天更换新鲜培养基。
6.小肠类器官照射:小鼠小肠隐窝接种24 h后给予X射线照射,剂量分别为0、2、4、6、8、10 Gy。显微镜下计数照前和照射后5 d每孔类器官数量,计算各剂量组存活百分数。计算公式:S=(D5/D0)×100%。式中,D0和D5分别为照射前和照射后第5天存活类器官数目。结果用GraphPad Prism 6.0软件拟合剂量效应曲线。
7.bFGF作用验证:小肠隐窝接种24 h后经8 Gy X射线照射,于照射后24 h给予bFGF处理,浓度分别为0、50、100、200、400 ng/ml,每组设3个复孔。分别于照射前和照射后5 d计数存活类器官数量,计算各浓度组存活百分数。进一步于照射前1 h,照射后1 h和照射后24 h给予bFGF处理,浓度200 ng/ml,观察其作用与时间点的关系。类器官大小以图像面积表示,统计其所占的像素值。
8.表皮调节素作用观察:小肠隐窝接种24 h后给予X射线8 Gy照射,表皮调节素于照射后24 h加入待测孔,浓度分别为0、50、100、200、400 ng/ml,并设bFGF(200 ng/ml)为阳性对照,每组设3个复孔。分别于照前和照射后5 d记录存活类器官数量和形态,采用ImageJ 1.51软件进行形态计量分析,比较各浓度组存活百分数及类器官形态变化。类器官大小以图像面积表示,统计其所占的像素值。
9.统计学处理:数据符合正态分布,以x±s表示。采用GraphPad Prism 6.0软件进行统计学分析,均数组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
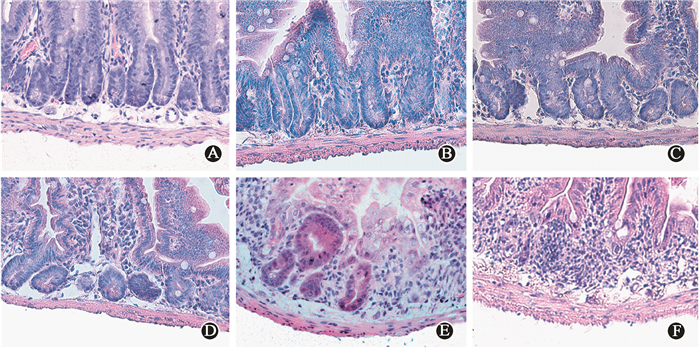
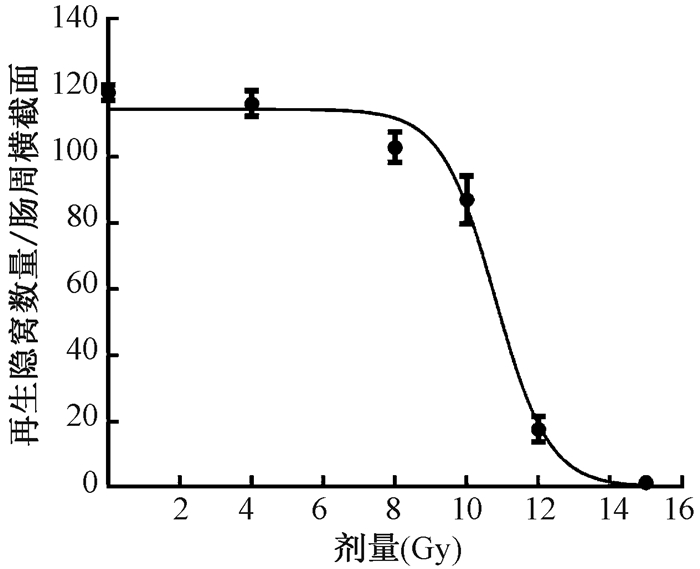
结果1.微克隆实验:图 1所示小鼠受不同剂量电离辐射后在体隐窝结构的病理学改变,结果表明,与正常对照组相比,12 Gy腹部照射后的小鼠在3.5 d后小肠隐窝明显减少,有部分再生隐窝;15 Gy照射组小肠隐窝基本消失;图 2显示,>10 Gy时再生隐窝数明显下降,曲线呈“S”型有肩区。
|
图 1 不同剂量电离辐射后3.5 d小鼠隐窝结构的病理学改变HE染色×200 A. 0 Gy对照组;B. 4 Gy照射组;C. 8 Gy照射组;D. 10 Gy照射组;E. 12 Gy照射组;F. 15 Gy照射组 Figure 1 Regenerating crypts 3.5 days after irradiation in vivo HE staining ×200 A. 0 Gy control group; B. 4 Gy group; C. 8 Gy group; D. 10 Gy group; E. 12 Gy group; F. 15 Gy group |
|
图 2 小鼠小肠隐窝剂量存活曲线 Figure 2 Crypt survival curve characterized by a large shoulder |
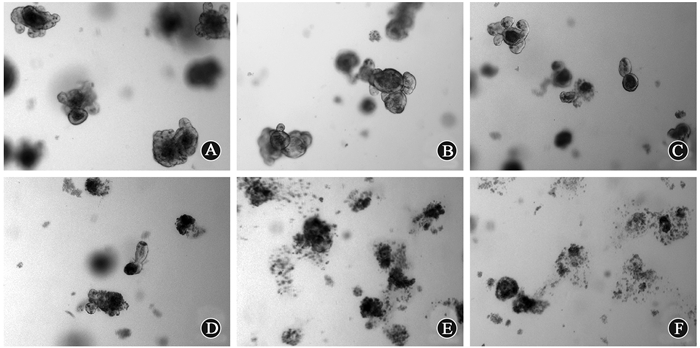
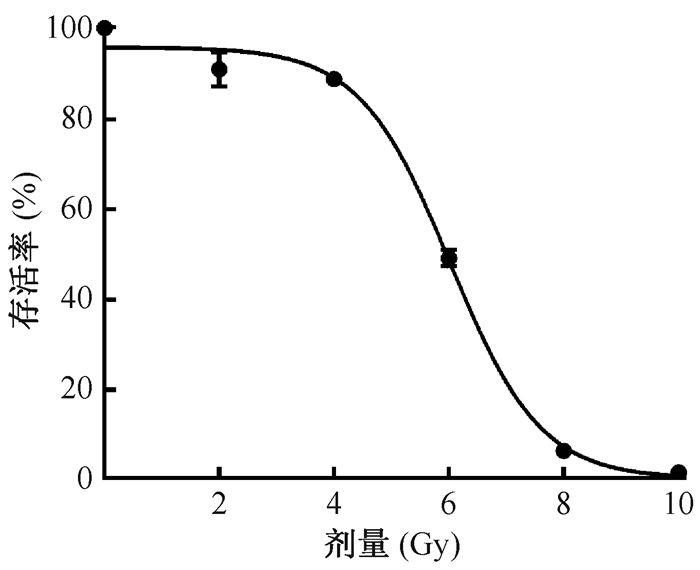
2.小鼠小肠类器官剂量反应:结果如图 3,4所示,照射后小鼠小肠类器官存活率随辐射剂量增加而降低,>4 Gy时存活率明显下降,曲线呈“S”型有肩区,与动物实验微克隆实验变化相似,且与在体实验相比,更加敏感。
|
图 3 小肠类器官照射后第5天形态×50 A. 0 Gy对照组;B. 2 Gy照射组;C. 4 Gy照射组;D. 6 Gy照射组;E. 8 Gy照射组;F. 10 Gy照射组 Figure 3 Intestinal organoids 5 days post-irradiation in vitro ×50 A. 0 Gy control group; B. 2 Gy group; C. 4 Gy group; D. 6 Gy group; E. 8 Gy group; F. 10 Gy group |
|
图 4 小鼠小肠类器官剂量存活曲线 Figure 4 Intestinal organoids survival curve characterized by a large shoulder |
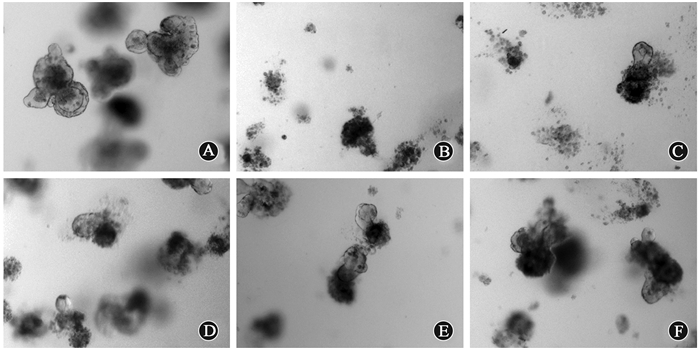
3. bFGF治疗作用验证:结果表明,随bFGF浓度增加,8 Gy X射线照射后类器官生存率逐渐增加,但200和400 ng/ml之间差异无统计学意义,如表 1和图 5。进一步于照射后不同时间点加药,观察其对小肠类器官作用的差异。结果显示,对照组照射后5 d小肠类器官存活率为(4.90±0.33)%,照前1 h给药组为(12.41±0.73)%,照后1 h给药组为(12.77±0.58)%,照后24 h给药组为(14.10±0.64)%,给药组与对照组比较差异有统计学意义(t=17.27~21.96,P<0.05)。表明bFGF对小鼠小肠类器官具有辐射保护及治疗作用。
|
|
表 1 8 Gy X射线照射后不同浓度bFGF处理下小肠类器官存活率(x±s) Table 1 The survival of small intestinal organoid treated with/without bFGF after 8 Gy X-ray irradiation (x±s) |
|
图 5 8 Gy X射线照射后bFGF促进小肠类器官存活×50 A.未受照组;B. 0 ng/ml对照组;C. 50 ng/ml治疗组;D. 100 ng/ml治疗组;E. 200 ng/ml治疗组;F. 400 ng/ml治疗组 Figure 5 bFGF promotes small intestinal organoids survival after 8 Gy X-ray irradiation ×50 A. Unirradiated group; B. 0 ng/ml group; C. 50 ng/ml group; D. 100 ng/ml group; E. 200 ng/ml group; F. 400 ng/ml group |
4.表皮调节素对肠类器官辐射损伤的治疗作用:8 Gy X射线照射后,类器官存活率随表皮调节素浓度增加而增加,见表 2。400 ng/ml组存活率为(12.56±1.02) %,较对照组(4.73±0.38)%明显增加,差异有统计学意义(t=12.43,P<0.05)。类器官出芽数量比较,200和400 ng/ml组分别为1.80±0.96和2.63±1.35,较对照组(0 ng/ml)的0.90±0.96明显增加,差异有统计学意义(t=3.63~5.73,P<0.05)。类器官大小比较,0、50、100、200、400 ng/ml组分别为(1.14±0.45)×105、(1.16±0.93)×105、(1.20±0.12)×105、(1.40±0.13)×105、(1.87±0.70)×105像素,其中400 ng/ml组较0 ng/ml组,差异有统计学意义(t=4.11,P<0.05)。进一步观察不同时间点表皮调节素(400 ng/ml)对小肠类器官的作用,结果显示:对照组存活率为(4.68±0.37)%,照前1 h给药组为(4.29±0.37)%,照后1 h给药组为(5.08±0.58)%,照后24 h给药组为11.31±0.61,仅照后24 h给药组存活率高于对照组,差异有统计学意义(t=16.08,P<0.05)。表明表皮调节素对小肠类器官辐射损伤有治疗作用。
|
|
表 2 8 Gy X射线照射后各浓度表皮调节素小肠类器官存活率(x±s) Table 2 The survival rate of small intestinal organoid treated at various concontrations of epiregulin after 8 Gy X-ray irradiation (x±s) |
讨论
小肠上皮由绒毛和隐窝构成,为一单层柱状细胞覆盖于肠腔表面,主要功能有消化吸收和抵御外源致病微生物的作用[6]。小鼠小肠上皮每4~5天全部更新一次,由位于隐窝底部干细胞增殖分化而来[7]。肠道受照后,小肠干细胞死亡导致肠上皮更新障碍,造成隐窝及绒毛消失、肠腔表面裸露形成溃疡,引起吸收障碍、水电解质紊乱、腹泻、出血及感染等[8]。如肠损伤严重,小鼠一般于照射后4~10 d死亡[8]。小鼠存活与否,取决于肠上皮细胞再生速度与细胞死亡和丢失速度的竞争作用,前者主要取决于肠道干细胞辐射后的存活量,且与照射剂量负相关[8]。因此,肠道干细胞是肠道辐射损伤及防治的关键靶点。
近年来,小肠干细胞研究取得长足进步。Barker等[9]证明Lgr5(Leucine-rich repeat-containing G-protein coupled receptor 5)是小肠干细胞特异性标志物,表达于隐窝基底部柱状细胞(CBC细胞)。Sato等[10]首次分离得到单个Lgr5+肠道干细胞,并于体外成功培养成肠道类器官,其细胞构成与生长方式均与体内肠隐窝一致。此后,基于干细胞的肠类器官3D培养技术得到充分发展。肠道上皮干细胞和隐窝可以在特定生长因子作用下于基质胶(matrigel)中形成空心的小球,其内部具有完整的肠上皮样结构,这种空心小球称之为肠道类器官(organoid),也称为“迷你肠”(mini-gut)[4]。肠道类器官由于易于分离培养、培养周期短、与原发组织差异小等优点正被广泛应用于基础及转化医学研究[5]。
本研究采用小鼠小肠隐窝体外分离培养的方法生成肠类器官,观察电离辐射损伤效应。小肠隐窝接种3~5 h后即可成球状,此时为单个肠隐窝结构,1个类器官对应为1个肠道隐窝。1 d后逐渐以出芽的方式形成多个隐窝结构。X射线作用后5 d,死亡隐窝已逐渐消散,随存活干细胞增殖分化新生隐窝增大出芽明显,此时便于形态学观察以获得其存活、增殖和分化等情况。因此,本研究以接种后24 h为照射点,以受照后5 d为观察点,研究了小肠类器官辐射剂量效应关系,并与小鼠肠道辐射损伤再生(微克隆形成)进行比较。研究显示,小肠类器官的辐射剂量反应曲线与小肠隐窝微克隆剂量曲线类似,均出现明显肩区,表明体外小肠类器官辐射损伤再生与体内变化较一致,可以用于观察小肠干细胞辐射损伤与再生过程。
bFGF被证实在辐射后给药具有肠道保护作用[11-12]。bFGF是成纤维生长因子家族的一员,由155个氨基酸残基组成[13]。bFGF可通过激活磷脂酰肌醇3-激酶(PI3K)/丝氨酸-苏氨酸蛋白激酶(PKB,也称AKT)信号通路抑制p53表达从而减少辐射后肠干细胞凋亡[14-15]。本研究利用小肠类器官辐射损伤模型进一步观察了bFGF的辐射损伤治疗和保护效果。结果显示,bFGF于辐射前1 h,辐射后1及24 h给药均可提高肠类器官存活率,表明其具有肠类器官辐射损伤保护和治疗作用,与Paris等[11]和Maj等[12]通过小鼠实验获得的其对小肠抗辐射作用的结论相一致。尽管考虑到体内给药在药物吸收分布存在一定时间而不同于体外实验,但该结果仍初步展示了肠类器官辐射损伤模型对辐射保护剂及治疗剂研究的价值。
表皮调节素为EGF家族成员,成熟体为46肽,其表达仅限7 d内小鼠胚胎,以后明显降低,出生后表达停止。当组织损伤时有少量表达,可能参与组织修复[16-17]。有报道,在发生肠炎的肠上皮内分泌细胞及间质细胞有表达,推测其可能参与损伤修复。Gregorieff等[18]报道表皮调节素可通过补偿Yap促进肠上皮细胞存活。也有报道表皮调节素可激活PI3K/AKT信号通路[19],其作用机制可能与bFGF类似。为此,本研究进一步观察了表皮调节素对体外肠类器官的辐射损伤治疗作用。实验结果表明,于照射后24 h给药,表皮调节素组类器官存活率、大小和出芽率方面高于对照组,显示表皮调节素对肠类器官的辐射损伤具有治疗作用。
综上所述,本研究通过小肠类器官培养,观察了电离辐射致小肠类器官的损伤和肠道辐射保护剂(bFGF)的保护及治疗作用。以此为基础,发现了表皮调节素在类器官水平的辐射损伤治疗效应,其抗辐射治疗作用有待动物体内实验进一步验证。
利益冲突 无作者贡献声明 富国祥、李远闯负责实验操作、数据采集、统计分析和论文撰写;潘梦雪、郭强、饶欣欣、徐小雅、周轶负责协助实验操作;邵春林、高建军负责论文修改;华国强负责指导课题设计和修改论文
| [1] |
Taniguchi CM, Miao YR, Diep AN, et al. PHD inhibition mitigates and protects against radiation-induced gastrointestinal toxicity via HIF2[J]. Sci Transl Med, 2014, 6(236): 236ra64. DOI:10.1126/scitranslmed.3008523 |
| [2] |
Singh VK, Ducey EJ, Brown DS, et al. A review of radiation countermeasure work ongoing at the Armed Forces Radiobiology Research Institute[J]. Int J Radiat Biol, 2012, 88(4): 296-310. DOI:10.3109/09553002.2012.652726 |
| [3] |
Dumont F, Le RA, Bischoff P. Radiation countermeasure agents:an update[J]. Expert Opin Ther Pat, 2010, 20(1): 73-101. DOI:10.1517/13543770903490429 |
| [4] |
Wang C, Gao JJ, Hua GQ. Research applications of intestinal organoids in precision medicine[J]. Sci Sin Vitae, 2017, 47(2): 171-179. DOI:10.1360/N052016-00342 |
| [5] |
Ranga A, Gjorevski N, Lutolf MP. Drug discovery through stem cell-based organoid models[J]. Adv Drug Deliv Rev, 2014, 69-70: 19-28. DOI:10.1016/j.addr.2014.02.006 |
| [6] |
Simons BD, Clevers H. Stem cell self-renewal in intestinal crypt[J]. Exp Cell Res, 2011, 317(19): 2719-2724. DOI:10.1016/j.yexcr.2011.07.010 |
| [7] |
Potten CS. Kinetics and possible regulation of crypt cell populations under normal and stress conditions[J]. Bull Cancer, 1975, 62(4): 419-430. |
| [8] |
Potten CS. Radiation, the ideal cytotoxic agent for studying the cell biology of tissues such as the small intestine[J]. Radiat Res, 2004, 161(2): 123-136. DOI:10.1667/RR3104 |
| [9] |
Barker N, van Es JH, Kuipers J, et al. Identification of stem cells in small intestine and colon by marker gene Lgr5[J]. Nature, 2007, 449(7165): 1003-1007. DOI:10.1038/nature06196 |
| [10] |
Sato T, Stange DE, Ferrante M, et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett's epithelium[J]. Gastroenterology, 2011, 141(5): 1762-1772. DOI:10.1053/j.gastro.2011.07.050 |
| [11] |
Paris F, Fuks Z, Kang A, et al. Endothelial apoptosis as the primary lesion initiating intestinal radiation damage in mice[J]. Science, 2001, 293(5528): 293-297. DOI:10.1126/science.1060191 |
| [12] |
Maj JG, Paris F, Haimovitz-Friedman A, et al. Microvascular function regulates intestinal crypt response to radiation[J]. Cancer Res, 2003, 63(15): 4338-4341. |
| [13] |
Dionne CA, Crumley G, Bellot F, et al. Cloning and expression of two distinct high-affinity receptors cross-reacting with acidic and basic fibroblast growth factors[J]. EMBO J, 1990, 9(9): 2685-2692. |
| [14] |
Qiu W, Leibowitz B, Zhang L, et al. Growth factors protect intestinal stem cells from radiation-induced apoptosis by suppressing PUMA through the PI3K/AKT/p53 axis[J]. Oncogene, 2010, 29(11): 1622-1632. DOI:10.1038/onc.2009.451 |
| [15] |
Liu Z, Liu H, Jiang J, et al. PDGF-BB and bFGF ameliorate radiation-induced intestinal progenitor/stem cell apoptosis via Akt/p53 signaling in mice[J]. Am J Physiol Gastrointest Liver Physiol, 2014, 307(11): G1033-1043. DOI:10.1152/ajpgi.00151.2014 |
| [16] |
Toyoda H, Komurasaki T, Uchida D, et al. Epiregulin. A novel epidermal growth factor with mitogenic activity for rat primary hepatocytes[J]. J Biol Chem, 1995, 270(13): 7495-7500. DOI:10.1074/jbc.270.13.7495 |
| [17] |
Toyoda H, Komurasaki T, Ikeda Y, et al. Molecular cloning of mouse epiregulin, a novel epidermal growth factor-related protein, expressed in the early stage of development[J]. FEBS Lett, 1995, 377(3): 403-407. DOI:10.1016/0014-5793(95)01403-9 |
| [18] |
Gregorieff A, Liu Y, Inanlou MR, et al. Yap-dependent reprogramming of Lgr5(+) stem cells drives intestinal regeneration and cancer[J]. Nature, 2015, 526(7575): 715-718. DOI:10.1038/nature15382 |
| [19] |
Hu K, Li SL, Gan YH, et al. Epiregulin promotes migration and invasion of salivary adenoid cystic carcinoma cell line SACC-83 through activation of ERK and Akt[J]. Oral Oncol, 2009, 45(2): 156-163. DOI:10.1016/j.oraloncology.2008.04.009 |
 2018, Vol. 38
2018, Vol. 38


