随着核技术不断飞速发展,γ射线在食品灭菌、医疗器械消毒、化学合成及环境保护等方面有着广泛地应用[1]。然而,过量的γ射线辐照会对生物机体产生严重的辐射损伤。因此,在利用γ射线的同时,对于γ射线的剂量检测工作十分必要,且具有重要的放射卫生学意义。目前常规的γ射线检测工具主要包括:闪烁体探测器、半导体探测器、热释光探测器等[2-7]。这些方法在关于γ射线的具体检测工作中发挥了重要的作用。不同于常规检测方法,本研究拟建立一种γ射线检测新方法,探究利用寡核苷酸分子(ssDNA)修饰的金纳米颗粒(AuNPs)复合材料(ssDNA-AuNPs)比色检测γ射线辐照的可行性,并对其机制进行分析。
材料与方法1.主要试剂与仪器:氯金酸、柠檬酸三钠、氯化钠均购置于北京化工厂,寡核苷酸(结构式为AGGGTTAGGG-(CH)2-SH,购置于北京赛百盛基因技术有限公司),实验所用水为Milli-Q自制纯水(18.2 MΩ· cm),multiskan GO型酶标仪(美国Thermo公司),所有实验均在室温下进行。
2.ssDNA-AuNPs复合材料的制备:首先,用柠檬酸三钠还原氯金酸的方法制备得到AuNPs[8-9],具体合成步骤如下:将50 ml浓度为0.25 mmol/L的氯金酸溶液加热搅拌(转速为400 r/min),待溶液沸腾后快速加入1.3 ml 1% (W/V)的柠檬酸三钠溶液,继续加热,当溶液的颜色从浅黄色变成淡紫色、再最终变为酒红色时停止加热,反应液继续在室温下搅拌,冷却至室温后,转移至4℃冰箱中保存待用。其次,将0.5 μl浓度为20 μmol/L的ssDNA加入上述制备好的500 μl金纳米颗粒溶液中,再向混合溶液中缓慢地滴加30 μl浓度为500 mmol/L的氯化钠溶液,室温反应1 h,即得到寡核苷酸修饰的金纳米颗粒复合材料ssDNA-AuNPs。取500 μl的ssDNA-AuNPs放入一次性玻璃管中准备进行照射实验。
3.60Co γ射线照射:利用北京师范大学钴源照射ssDNA-AuNPs溶液,源靶距84 cm,剂量率1 Gy/min,照射剂量分别为0、5、10、20和30 Gy。
4.吸收光谱的测量:将经过60Co γ射线照射后的ssDNA-AuNPs溶液依次小心转移到96孔板,再将其置于全波长酶标仪中进行吸收光谱的测量,测量波段范围设定为300~700 nm。本研究所有图中所示的紫外-可见吸收光谱均为扣除水参比溶液的结果,同时用相机对受照后的溶液进行拍照。
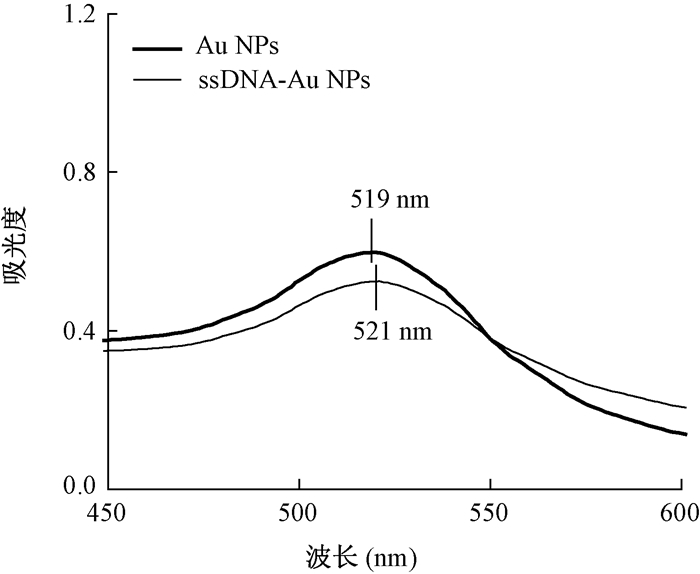
结果1. AuNPs与ssDNA-AuNPs的紫外-可见吸收光谱:用柠檬酸三钠还原氯金酸法制备得到的AuNPs溶液均匀,并呈现出特有的酒红色,图 1中紫外-可见吸收光谱显示,其最大吸收波长在519 nm处(图 1),这两个特征说明本实验中制备的AuNPs分散性良好。经表面修饰后形成ssDNA-AuNPs,ssDNA分子中的巯基固定在AuNPs表面形成金-硫共价键产生阻尼效应,导致了其最大吸收峰红移至521 nm(图 1)[10]。这表明了ssDNA被成功地修饰到了AuNPs表面。
|
图 1 AuNPs与ssDNA-AuNPs的紫外-可见吸收光谱 Figure 1 Ultraviolet-visible absorption spectra of AuNPs and ssDNA-AuNPs |
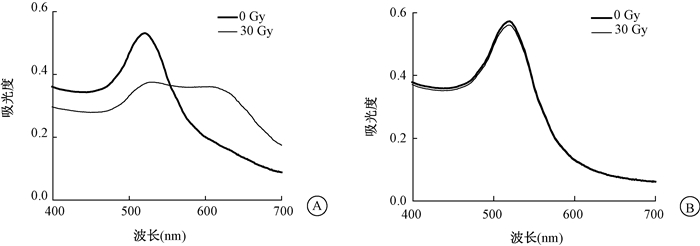
2.AuNPs与ssDNA-AuNPs受照后的紫外-可见吸收光谱:将ssDNA-AuNPs经过30 Gy的γ射线照射,溶液吸收光谱如图 2所示。由图 2可知,受照后的ssDNA-AuNPs溶液的最大吸收峰从521 nm处红移到625 nm处。同时,溶液颜色发生了明显的变化,即由原来的酒红色变为蓝色。这为ssDNA-AuNPs用于比色检测γ射线照射剂量提供了可靠的实验基础。为了验证溶液颜色的变化是由于γ射线与表面修饰分子ssDNA的相互作用引起的,本研究中进行了1组对照实验,即将表面未经修饰的AuNPs经过同样处理,并对其进行γ射线照射(照射剂量30 Gy),结果如图 2所示,受照后的AuNPs溶液的吸收光谱与辐照前相比,未发生明显的变化。这说明了本检测体系溶液颜色的变化确实是由于γ射线与表面修饰分子ssDNA的相互作用而引起的。
|
图 2 30 Gy γ射线照射2 nmol/L浓度的ssDNA-AuNPs和AuNPs的紫外-可见吸收光谱 A. ssDNA-AuNPs;B. AuNPs Figure 2 UV-Vis absorption spectra of ssDNA-AuNPs (2 nmol/L) and AuNPs (2 nmol/L) before and after gamma irradiation with 30 Gy A. ssDNA-AuNPs; B. AuNPs |
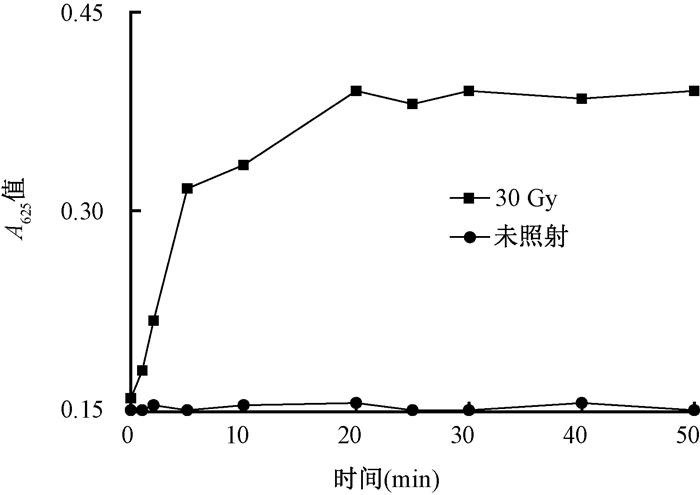
3.测量时间的选择:实验对受辐照后的ssDNA-AuNPs溶液的变色时间进行了研究,如图 3所示,经过30 Gy照射后,溶液吸收光谱中625 nm处的吸光度(A625)值随着时间的增加而增加,20 min后,A625的值基本稳定不再继续增长,所以本体系测量时间选在照射后20 min。具体测量过程在全波长酶标仪上进行(快速精准模式),1 min内即可完成。同时,又进行了1组对照实验,研究了未经辐照的ssDNA-AuNPs溶液吸收光谱中A625值随着时间变化情况,如图 3所示,该数值基本保持不变,这保证了ssDNA-AuNPs在比色检测γ射线照射剂量过程中的稳定性。
|
图 3 经过30 Gy照射(黑线)与未经过照射(红线)的ssDNA-AuNPs (2 nmol/L)溶液中A625值随时间变化关系 Figure 3 Variation with time of A625 in ssDNA-AuNPs (2 nmol/L) solution irradiated with 30 Gy (black line) and b) without irradiation (red line) |
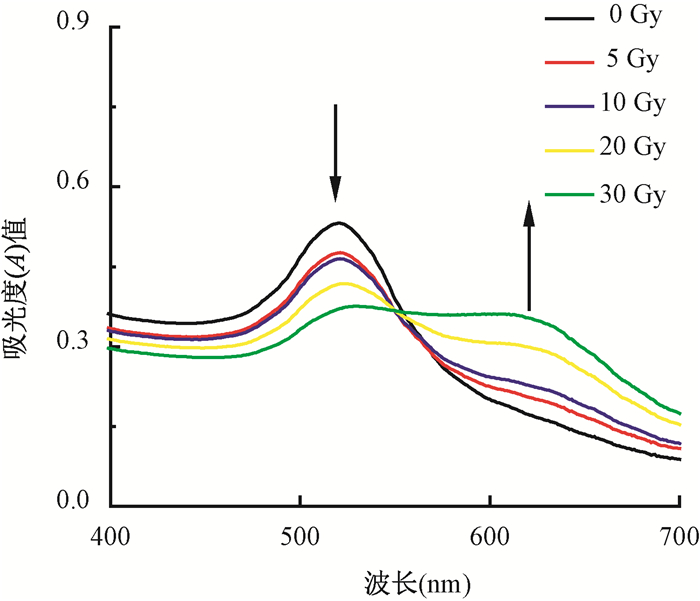
4.标准曲线:为了进一步定量分析考察ssDNA-AuNPs用于可视化检测γ射线照射剂量的可行性。本实验测量了不同剂量水平的γ射线辐照后,ssDNA-AuNPs溶液吸收光谱的变化。由图 4可知,随着照射剂量的不断升高,吸收光谱中521 nm处的吸光度不断降低,而625 nm处的吸光度不断增高。此外,在550 nm处左右出现了一个等吸收点,这是由于,随着照射剂量的增大,金纳米颗粒由分散状态逐渐变为团聚状态,在这个等吸收点时,分散态浓度的减少和团聚态浓度的增加相同,在这550 nm这个波长的吸光度数值中,分散态和聚集态这两种状态下的金纳米颗粒刚好有相同的贡献率。为了实现对γ射线照射剂量的定量分析检测,研究利用吸收光谱中625 nm与521 nm处吸光度比值(A625/A521)对溶液的照射剂量进行定量分析(采用A625/A521是为了得到照射剂量范围更宽的线性方程)。如图 5所示,当溶液的照射剂量(E)在30 Gy以内时,A625/A521与其呈现良好的线性关系,拟合线性方程A625/A521=0.020 6 + 0.303 6 E(R2=0.991 5),探测下限为0.5 Gy。
|
图 4 不同剂量(0、5、10、20、30 Gy)γ射线照射后ssDNA-AuNPs (2 nmol/L)的紫外-可见吸收光谱
↓代表照射剂量从0 Gy逐渐变为30 Gy, ↑代表照射剂量从30 Gy逐渐变为0 Gy Figure 4 Ultraviolet-visible absorption spectra of ssDNA-AuNPs (2 nmol/L) after gamma irradiation with 0, 5, 10, 20, 30 Gy |

|
图 5 吸收光谱A625/A521处的比值与照射剂量(0~30 Gy)之间拟合线性方程 Figure 5 Linear equations between absorbance ratio (A625/A521) and absorbed doses from 0 to 30 Gy |
5.不同剂量照射后ssDNA-AuNPs溶液颜色变化:图 6显示了不同剂量的γ射线照射后,ssDNA-AuNPs溶液颜色的变化情况,从图中可以清楚地看出,随着照射剂量的不断增加,颜色由原来的酒红色逐渐变为蓝紫色。变色结果只需肉眼即可辨别。

|
图 6 不同剂量的γ射线照射ssDNA-AuNPs溶液后的颜色变化 Figure 6 Color change in ssDNA-AuNPs solutions after γ-ray irradiation with different doses |
讨论
本研究选取金纳米颗粒作为检测基质,是利用了它独特的光学性质[11-15]:金纳米颗粒在分散状态下呈现出酒红色,而在聚集状态下呈现蓝紫色。根据这种分散/聚集状态不同而产生颜色变化的性质可以设计构筑针对不同目标的可视化检测方法。分析方法的具体创建大多数是利用巯基和金之间能够形成稳定的共价键,将配体巯基物质修饰到金纳米颗粒的表面,被分析物质与金纳米颗粒表面的巯基物质发生相互作用,导致原来分散状态良好(酒红色)的金纳米颗粒逐渐聚集,颜色逐渐变为蓝紫色,并利用由此引起的吸光光谱信号的变化达到比色检测待检目标物的目的[16]。
ssDNA作为金纳米颗粒表面的修饰分子,这是基于以下两点考虑:一方面,相关文献报道ssDNA可以明显地提高金纳米颗粒的耐盐性[10],ssDNA可以像保护剂一样包裹在AuNPs的表面,使其在盐溶液中具有良好的分散性不发生聚集(实验中所使用盐浓度会使未经表面修饰的单纯的AuNPs溶液迅速变蓝即发生聚集反应);另一方面,大量研究表明,适当剂量的γ射线辐照可以有效地切断DNA分子,具体途径是通过γ射线照射溶液产生的羟基自由基对DNA的损伤切断来实现的[17]。因此,本工作的比色检测机制可以理解为:ssDNA-AuNP溶液经过适当剂量的γ射线照射后,溶液中产生了大量的羟基自由基,它对复合材料表面的ssDNA具有切断作用,从而使其从复合材料表面脱离出来,没有了ssDNA的包裹保护作用,材料的耐盐性大大减弱。因此,复合材料由原来的分散性变为聚集状态。此外,这种聚集程度随着羟基自由基的增加而增加,而羟基自由基的生成与照射剂量成正比。所以,材料的聚集程度随着照射剂量的增加而增加。
与常规γ探测器(电离室剂量计和热释光剂量计等)相比较,本方法具有目视即可完成的特点,即通过溶液受照后的颜色变化即可判断照射剂量水平,且使用过程无需电源。但较之常规γ探测器,本方法的探测下限不够低,达不到常规探测器的灵敏度。如何最大限度地提高本方法检测的灵敏度是下一步工作着重解决的问题。由于本方法在0至30 Gy照射剂量范围内有明显的颜色变化,它适用于这个剂量范围内的相关检测应用。而根据相关文献报道[18],25 Gy被定为是特殊患者输血前血液辐照剂量值,以避免输血导致的抗宿主疾病的发生。因此,本方法在血液辐照过程的质量控制方面,有着潜在的应用价值。
基于γ射线照射复合纳米材料ssDNA-AuNPs产生颜色变化,本研究发展了一种比色检测γ射线照射剂量的新方法。利用金纳米颗粒丰富的表面化学性质,通过合理地设计修饰分子,该研究实现了对γ射线照射剂量的比色检测,体系制备简单,结果易辨别,这为纳米材料用于辐射检测与防护领域的研究提供了新思路。
利益冲突 所有作者均于投稿前阅读并认可本研究内容,不存在任何潜在利益冲突作者贡献声明 宋延超设计实验并撰写文章;崔宏星、张庆召、侯长松协助研究;武云云指导研究设计并修改文章
| [1] |
彭静, 郝燕, 魏根全, 等. 辐射化学基础教程[M]. 北京: 北京大学出版社, 2015. Peng J, Hao Y, Wei GQ, et al. Basic course in radiation chemistry[M]. Beijing: Peking University Press, 2015. |
| [2] |
沈建华, 林伟, 马林丽, 等. CsI(Tl)探测器对γ射线探测参数的MC模拟[J]. 核电子学与探测技术, 2015, 35(10): 1031-1034. Shen JH, Lin W, Ma LL, et al. Based on GEANT4 simulation of CsI(Tl)detector to detect different energy rays[J]. Nucl Electron Detect Technol, 2015, 35(10): 1031-1034. DOI:10.3969/j.issn.0258-0934.2015.10.020 |
| [3] |
吴福源, 张凤娜, 高永凤, 等. 高能γ探测系统中的光耦合部件参数优化[J]. 强激光与粒子束, 2013, 25(1): 169-172. Wu FY, Zhang FN, Gao YF, et al. Optical coupling structure parameter optimization for high energy gamma-ray detection system[J]. Pow Las Pati Beam, 2013, 25(1): 169-172. DOI:10.3788/HPLPB20132501.0169 |
| [4] |
杨桂霞, 李晓燕, 傅澜, 等. γ照射剂量率在线探测用硅光电池的电学性能研究[J]. 原子能科学与技术, 2015, 49(8): 1504-1508. Yang GX, Li XY, Fu L, et al. Electrical behavior research of silicon photo-cell used in online monitoring absorbed dose rate of γ-ray[J]. Ato Ener Sci Technol, 2015, 49(8): 1504-1508. DOI:10.7538/yzk.2015.49.08.1504 |
| [5] |
侯新生, 方方, 马英杰, 等. 一种新型半导体探测器的应用[J]. 核电子学与探测技术, 2004, 24(1): 44-46. Hou XS, Fang F, Ma YJ, et al. application of a kind of new type semiconductor detector[J]. Nucl Electron Detect Technol, 2004, 24(1): 44-46. DOI:10.3969/j.issn.0258-0934.2004.01.013 |
| [6] |
王晨辉, 陈伟, 金军山, 等. 敏化LiF(Mg, Ti)热释光剂量片γ射线响应特性[J]. 强激光与粒子束, 2016, 28(2): 115-121. Wang CH, Chen W, Jin JS, et al. Comparison of responses to γ rays among 4 types of LiF(Mg, Ti)-M thermoluminescence dosimestries[J]. Nucl Electron Detect Technol, 2016, 28(2): 115-121. DOI:10.11884/HPLPB201628.024002 |
| [7] |
全红, 陈大庆, 林洪, 等. γ-刀漏射线分布及环境背景辐射的探测[J]. 中国医学物理学杂志, 2001, 18(1): 7-9. Quan H, Chen DQ, Lin H, et al. Environmental radiation exposure surveys of the leksell gamma unit[J]. Chin J Med Phy, 2001, 18(1): 7-9. DOI:10.3969/j.issn.1005-202X.2001.01.004 |
| [8] |
Song Y, Wang Z, Li L, et al. Gold nanoparticles functionalized with cresyl violet and porphyrin via hyaluronic acid for targeted cell imaging and phototherapy[J]. Chem Commun (Camb), 2014, 50(99): 15696-15698. DOI:10.1039/c4cc07565j |
| [9] |
Feng D, Zhang Y, Shi W, et al. A simple and sensitive method for visual detection of phosgene based on the aggregation of gold nanoparticles[J]. Chem Commun (Camb), 2010, 46(48): 9203-9205. DOI:10.1039/c0cc02703k |
| [10] |
Jiang Y, Zhao H, Lin Y, et al. Colorimetric detection of glucose in rat brain using gold nanoparticles[J]. Angew Chem Int Ed, 2010, 49(28): 4800-4804. DOI:10.1002/anie.201001057 |
| [11] |
Yu Y, Hong Y, Gao P, et al. Glutathione modified gold nanoparticles for sensitive colorimetric detection of Pb2+ ions in rainwater polluted by leaking perovskite solar cells[J]. Anal Chem, 2016, 88(24): 12316-12322. DOI:10.1021/acs.analchem.6b03515 |
| [12] |
Zhu D, Li X, Liu X, et al. Designing bifunctionalized gold nanoparticle for colorimetric detection of Pb2+ under physiological condition[J]. Biosens Bioelectron, 2012, 31(1): 505-509. DOI:10.1016/j.bios.2011.11.026 |
| [13] |
Chen CK, Huang CC, Chang HT. Label-free colorimetric detection of picomolar thrombin in blood plasma using a gold nanoparticle-based assay[J]. Biosens Bioelectron, 2010, 25(8): 1922-1927. DOI:10.1016/j.bios.2010.01.005 |
| [14] |
Xie X, Xu W, Li T, et al. Colorimetric detection of HIV-1 ribonuclease H activity by gold nanoparticles[J]. Small, 2011, 7(10): 1393-1396. DOI:10.1002/smll.201002150 |
| [15] |
Aryal S, Remant BKC, Dharmaraj N, et al. Spectroscopic identification of S-Au interaction in cysteine capped gold nanoparticles[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2006, 63(1): 160-163. DOI:10.1016/j.saa.2005.04.048 |
| [16] |
Cao R, Li B, Zhang Y, et al. Naked-eye sensitive detection of nuclease activity using positively-charged gold nanoparticles as colorimetric probes[J]. Chem Commun (Camb), 2011, 47(45): 12301-12303. DOI:10.1039/c1cc15994a |
| [17] |
Hall EJ, Giaccia AJ. Radiobiology for the Radiologist[M]. Philadelphia: Lippincott Williams & Wilkins, 2006.
|
| [18] |
Chapman J, Finney RD, Forman K, et al. Guidelines on gamma irradiation of blood components for the prevention of transfusion-associated graft-versus-host dissease[J]. Transfus Med, 1996, 6: 261-271. DOI:10.1111/j.1365-3148.1996.tb00078.x |
 2018, Vol. 38
2018, Vol. 38


