乳腺癌脑转移(BCBM)临床上常见,其发生机制、特征、治疗和预后因素复杂[1-4]。传统全脑照射(WBRT)控制症状疗效明显[5]。但近年来,它对寡转移(脑转灶数目≤3)或拥有良好分级预后评估分数(GPA)患者的益处受到质疑。原因包括对1~3病灶单独或手术联合立体定向照射(SRS)的生存疗效肯定,WBRT对神经认知和情绪功能及生活质量(QoL)的负面影响,以及WBRT对多发脑转移生存提高方面的证据不足等[6-11]。近年来,有效系统治疗(化疗、内分泌和靶向治疗)延长了Ⅳ期乳腺癌(包括BCBM)的生存[12-14]。考虑到WBRT能够减少或减缓脑部肿瘤复发或新灶形成,因此联合系统治疗WBRT有独立提高BCBM总体生存(OS)和无颅内疾病进展生存(PFS)的可能。本研究目的是通过回顾性多因素Cox生存分析,评估WBRT以及其剂量分组与OS和PFS的独立关系。
一、资料与方法1.基准线资料和随访:收集2013年1月至2015年12月在本院首次连续收治的所有BCBM患者的临床资料,女性105例,排除双乳癌。入组病例均有原发灶病理和脑部影像学(CT或MRI)诊断为BCBM。随访截止时间为2016年12月1日。基准线临床资料按来源分为脑转移和原发病乳腺癌,见表 1。
|
|
表 1 105例乳腺癌脑转移人群基线特征 Table 1 The baseline clinicopathological characteristics of 105 patients with breast cancer brain metastases |
2.脑转移放疗变量:分为3类,WBRT分4组剂量:0 Gy即无WBRT、< 30 Gy、30~39 Gy和≥40 Gy;单纯局部放疗或WBRT同期或序贯增量照射总剂量:0 Gy即无照射或无增量、< 50 Gy、≥50 Gy;伽玛刀SRS应用:有vs.无。WBRT剂量为研究主变量。其他两放疗变量始终参与WBRT剂量组Cox存活分析。
3.非放疗相关协变量:脑转移方面包括BCBM年龄、乳腺癌病史(年)、美国东部肿瘤协作组活动状态评分(ECOG)、分级预后评估分数(GPA)、脑转移灶数目、脑膜累及状态、有无脑外病灶、心血管疾病(CVD)、以及其他脑转移治疗(手术、全身化疗、内分泌治疗、靶向治疗)。乳腺癌方面包括首诊临床TNM分期、雌激素(ER)和孕激素(PR)受体状态、人表皮生长因子受体2(HER2)状态以及Ki-67表达水平。
4.统计学处理:采用SAS 9.20软件进行分析。连续性变量组间比较采用ANOVA与秩和分析法(在非正态分布时)。分类变量组间比较采用χ2检验或Fisher's精准检验。由于分组例数少,取P>0.200为差异有统计学意义。利用Kaplan-Meier曲线评估总生存(OS)和无颅内疾病进展生存(PFS)的中位数及95%置信区间(CI),采用Log-rank检验评估组间差异。单因素Cox比例风险模型筛选与WBRT有高关联性(P < 0.25)的非放疗相关变量为潜在协变量,然后结合临床和文献考虑,确定最终协变量。多因素Cox分析评估WBRT危险比(HR)。P<0.05为差异有统计学意义。
二、结果1.整体人群:共收集病例105例,脑转移平均年龄52.9(27~82)岁,乳腺癌病史≤5年者占59%,ECOG评分0/1者38%。多发脑转移(≥4)者44%,脑膜累及17%,脑外转移74%。病例来自所有临床科室,WBRT占51%,局部或增量放疗35%,伽玛刀SRS 8%。最多见WBRT模式为40 Gy/20次,4周(37%,20/54例),按WBRT总剂量0、< 30、30~39、≥ 40 Gy,病例分别占48%、11%、12%和29%。按脑病灶单纯局部或增量放疗最大剂量水平至0、< 50、≥50 Gy分类,病例分别占65%、5%和30%。BCBM化疗(定义为脑转移诊断后,有使用通过血脑屏障的化学药物记录)为38%,靶向治疗为14%,见表 1。
人群OS和PFS中位(95%CI)值分别为11.7(9.0~13.4)个月和10.1(6.5~12.2)个月。1、2和3年累计OS和PFS率分别为46%、25%、12%和41%、23%、6%。截止随访日,累计总死亡率为76%(80例),总治疗失败(死亡、复发或转移)率为81%(85例)。
2.WBRT组间特征和生存:在WBRT剂量的4组间,脑转移瘤局部单纯或增量放疗所达总剂量、脑转移化疗、乳腺癌TNM分期、Ki-67表达差异有统计学意义(χ2=13.5~46.9,P<0.05)。虽然ECOG分数组间差异无统计学意义(P>0.05),但ECOG 3或4分者在无WBRT者中占37%,明显高于行WBRT者的22%(χ2=7.7,P=0.02),显示患者体能差者行WBRT可能性低,见表 1。
按以上WBRT剂量分组,其1和2年OS率分别为37%、11%、62%、63%和27%、11%、33%、24%;OS中位数(OS-MST)分别为9.0、6.6、19.0和13.4个月;组间Log-rank检验差异无统计学意义(P=0.11)。同样WBRT分组,其1和2年PFS率分别为29%、11%、62%、62%和22%、11%、35%、23%;PFS中位数(PFS-MST)分别为5.2、4.8、17.2和13.3个月;组间比较Log-rank检验差异有统计学意义(P=0.04)。生存分析曲线见图 1。
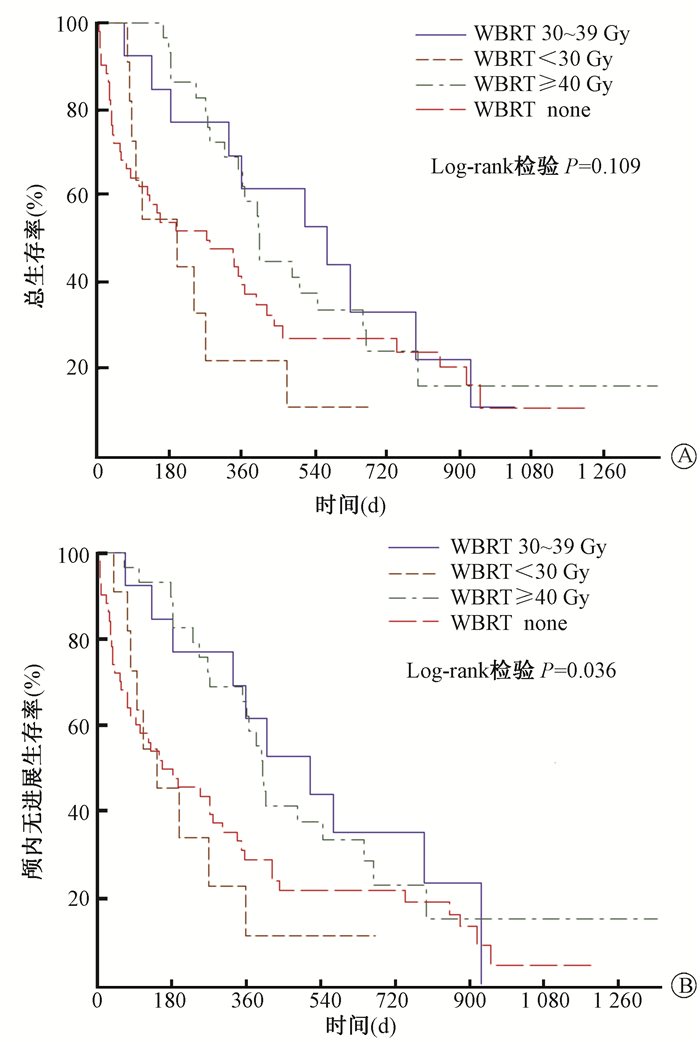
|
图 1 全脑放疗(WBRT)剂量分组下总体生存(A)和颅内无进展生存(B)曲线 Figure 1 Kaplan-Meier curves of overall survival (A) and intracranial progression-free survival (B)in 105 patients with breast cancer brain metastases by WBRT dose group |
3.协变量筛选和确定以及单因素Cox分析:单因素Cox分析比较OS,与无WBRT相比,其他WBRT由小到大剂量组HR值分别为1.456、0.621和0.658,差异均无统计学意义(P>0.05)。单因素Cox评估WBRT剂量组FPS,对应HR值分别为1.000、1.321、0.581和0.556;虽然30~39和≥40 Gy组均有较好的PFS(即HR < 1),但仅后者差异有统计学意义(P=0.03)。经筛选,非放疗非放疗因素协变量包括BCBM年龄、ECOG评分、转移灶数目、脑膜累及、乳癌肿瘤Ki-67表达、脑转移治疗(手术、化疗、内分泌治疗和靶向治疗)。
4.WBRT组间多因素Cox分析:结果见表 2。设WBRT 30~39 Gy为参考组,单因素和多因素Cox分析表明≥40 Gy与30~39 Gy相比OS和PFS差异均无统计学意义(P>0.05)。值得注意的是,WBRT剂量 < 30 Gy单因素下与高死亡有风险关系(即HR>1)已不存在(P>0.20)。
|
|
表 2 105例乳腺癌脑转移患者多因素Cox生存分析 Table 2 Multivariate Cox survival analysis on overall survival (OS) and intracranial progression-free survival(PFS) in 105 patients with breast cancer brain metastases |
在单纯局部或增量照射的脑病灶最高剂量方面,与0 Gy比较,意外发现 < 50 Gy组有异常高的死亡或复发风险(HRs 6.967~7.838,P < 0.01)但≥50 Gy高剂量组的HR < 1(P=0.16~0.18)。由于局部增量 < 50 Gy只有5例患者,且均为WBRT后(表 1),作者推测该组高死亡或复发风险可能是选择性偏差(由于并发症原因,其中3例均未完成放疗计划)所致。虽然局部或增量照射脑转移灶剂量≥50 Gy对提高肿瘤控制和生存有益处倾向,但关系不明确。表 2结果表明,SRS能够提高OS(HR=0.314,P=0.03),且对提高PFS(HR=0.430,P=0.08)可能有好处;由于SRS病例数(n=8)太少,且5例在无WBRT组,患者选择性偏差大,因此该结论值得进一步研究。
三、讨论WBRT除了能有效控制BCBM脑神经症状、降低复发和提高近期生活质量外,是否能够提高生存尚存争议[1-2]。本研究结论为WBRT 30~39 Gy能够独立提高OS和无颅内进展生存,40 Gy以上增益不再明显。
本研究数据是本院2013至2015年内所有科室收治的单侧乳腺癌(BM)患者,具有代表性。WBRT占51%。WBRT 30~39 Gy组比无WBRT组相比,OS中位期多10个月(19.0 vs. 9.0个月),PFS中位期多12个月(17.2 vs. 5.2个月),高于报道的4~6.5个月[15],除样本偏差外,笔者推测与更有效的系统治疗有关。多因素分析确定WBRT 30~39 Gy能降低死亡率73%,降低失败率(死亡或颅内进展)78%。该结论与部分文献报道一致[5, 12, 16]。Kim等[12]回顾性分析400例BCBM,其中WBRT占85%(339例中310例完成20 Gy以上),显示“足量”照射(≥20 Gy)组中位OS较未接受“足量”者长4.3个月(7.5 vs. 3.2个月,P < 0.001)。一项随机对照试验(RCT)研究359例脑转移灶1~4者(BCBM占12%)发现局部治疗(手术或SRS)后增加WBRT提高脑部局部控制但不改善OS[10]。Gaspar等[5]和Tsao等[16]行荟萃分析并不支持此结论。目前尚缺乏随机对照试验(RCT)研究评估WBRT对生存影响,尤其是按转移灶数目分层下,更无WBRT最佳剂量学研究。几个RCT只也是针对1~3脑转移灶手术或SRT后患者,发现增加WBRT虽能降低原灶复发和新灶出现率但不提高OS,同时认知功能明显下降[9-11]。鉴于此,目前临床指南推荐寡转移(≤3个病灶)时推迟或避免手术或SRS后增加WBRT[1]。值得注意的是,BCBM在这些RCT人群中所占比例并不高。
本研究把单纯局部/增量照射脑转移灶最高剂量分组作为一协变量,以避免或降低其对WBRT与生存关系评估干扰。本研究结果表明,脑转移灶剂量≥50 Gy(无论WBRT与否)可能有益于提高OS和PFS。Antoni等[17]按递归分区分析(recursive partitioning analysis, RPA)Ⅱ级1或2个脑转移灶208例(原发肿瘤137例肺癌,18例乳腺癌)发现,行WBRT(30 Gy/10次)后局部补量9 Gy/3次比单纯WBRT的中位OS长2.2个月(5.9 vs. 3.7个月,P=0.03),有较高局部控制率和OS。目前缺乏对BCBM行WBRT后补量照射的RCT研究。
本研究也考虑到SRS可能影响WBRT生存。对1~4个病灶脑转移者随机数据的荟萃分析研究显示,与联合WBRT相比,单独SRS在年龄≤50岁患者中的生存优势差异具有统计学意义(P=0.04)[18]。本研究仅8例(7.6%)SRS治疗,其中2例前期WBRT < 30 Gy,1例前期WBRT 40 Gy,5例未行WBRT;多因素分析SRS对OS有益处(HR=0.314,P=0.03),但对PFS改善不明确(P=0.08),可能与SRS人群少有关。
本研究同时考虑了手术对WBRT生存的影响。单灶脑转移者行WBRT前的手术切除能提高生存[19-20]。Patchell等[19]RCT随机单灶脑转移者48例发现手术切除组比单纯活检组(两组术后均行WBRT)有低复发率(20% vs. 52%,P < 0.02),长中位生存期(40周vs. 15周,P < 0.01)。但另一项RCT研究显示,84例单灶脑转移者行WBRT(30 Gy/10次)并未发现手术切除单灶有延长生存期(5.6 vs. 6.3个月,P=0.24)[20]。本研究9例手术(病灶完整或部分切除),其中3例术后行WBRT,2例术后行局部放疗。多因素分析未显示手术与OS和PFS有相关性(P >0.15),可能与例数少有关。
本研究也分析了其他生存相关因素。结果显示化疗(应用率38%)能够提高OS(HR= 0.41,P < 0.01)和PFS(HR=0.40,P < 0.01);内分泌治疗(24%)与生存无相关性;靶向治疗(14%)在提高OS上差异有统计学意义(HR=0.40,P=0.02)。本研究文献一致[12]。对这些因素调节提高了评估WBRT对生存影响的准确性。另外,文献常报道的危险因素如年轻(< 35岁)、低功能评分(低KPS或高ECOG)、多脑转移灶和脑膜累及也参与了分析[21-22]。因本研究数据受体状态不确定者比例偏高(10%~24%),最终多因素Cox分析并没有乳腺分子亚型的参与。然而,多因素分析显示,Ki-67高表达与OS和PFS呈负相关(P=0.01)。
总之,本研究提示在现代系统性治疗的背景下,乳腺癌脑转移时增加WBRT 30 Gy以上能改善OS和PFS,但剂量≥40 Gy增益不显著。该结论仍需要大样本和前瞻性研究提高证据水平。
利益冲突 无作者贡献声明 李振生负责研究设计、数据分析和论文撰写;申晓菲和申东星参与数据表设计和数据收集;张钧协助研究设计和负责整体研究监督;杨芳、韩慧娜、孔德友、孔洁、张舰、张安度负责部分资料整理和论文修改
| [1] |
Lin NU, Gaspar LE, Soffietti R. Breast cancer in the central nervous system:multidisciplinary considerations and management[J]. Am Soc Clin Oncol Educ Book, 2017, 37: 45-56. DOI:10.14694/EDBK_175338 |
| [2] |
Costa R, Carneiro BA, Wainwright DA, et al. Developmental therapeutics for patients with breast cancer and central nervous system metastasis:current landscape and future perspectives[J]. Ann Oncol, 2017, 28(1): 44-56. DOI:10.1093/annonc/mdw532 |
| [3] |
Anders CK, Deal AM, Miller CR, et al. The prognostic contribution of clinical breast cancer subtype, age, and race among patients with breast cancer brain metastases[J]. Cancer, 2011, 117(8): 1602-1611. DOI:10.1002/cncr.25746 |
| [4] |
Sperduto PW, Kased N, Roberge D, et al. Effect of tumor subtype on survival and the graded prognostic assessment for patients with breast cancer and brain metastases[J]. Int J Radiat Oncol Biol Phys, 2012, 82(5): 2111-2117. DOI:10.1016/j.ijrobp.2011.02.027 |
| [5] |
Gaspar LE, Mehta MP, Patchell RA, et al. The role of whole brain radiation therapy in the management of newly diagnosed brain metastases:a systematic review and evidence-based clinical practice guideline[J]. J Neurooncol, 2010, 96(1): 17-32. DOI:10.1007/s11060-009-0060-9 |
| [6] |
Soffietti R, Kocher M, Abacioglu UM, et al. A european organisation for research and treatment of cancer phase Ⅲ trial of adjuvant whole-brain radiotherapy versus observation in patients with one to three brain metastases from solid tumors after surgical resection or radiosurgery:quality-of-life results[J]. J Clin Oncol, 2013, 31(1): 65-72. DOI:10.1200/JCO.2011.41.0639 |
| [7] |
Aoyama H, Tago M, Kato N, et al. Neurocognitive function of patients with brain metastasis who received either whole brain radiotherapy plus stereotactic radiosurgery or radiosurgery alone[J]. Int J Radiat Oncol Biol Phys, 2007, 68(5): 1388-1395. DOI:10.1016/j.ijrobp.2007.03.048 |
| [8] |
Chang EL, Wefel JS, Hess KR, et al. Neurocognition in patients with brain metastases treated with radiosurgery or radiosurgery plus whole-brain irradiation:a randomised controlled trial[J]. Lancet Oncol, 2009, 10(11): 1037-1044. DOI:10.1016/S1470-2045(09)70263-3 |
| [9] |
Brown PD, Jaeckle K, Ballman KV, et al. Effect of radiosurgery alone vs radiosurgery with whole brain radiation therapy on cognitive function in patients with 1 to 3 brain metastases:a randomized clinical trial[J]. JAMA, 2016, 316(4): 401-409. DOI:10.1001/jama.2016.9839 |
| [10] |
Kocher M, Soffietti R, Abacioglu U, et al. Adjuvant whole-brain radiotherapy versus observation after radiosurgery or surgical resection of one to three cerebral metastases:results of the EORTC 22952-26001 study[J]. J Clin Oncol, 2011, 29(2): 134-141. DOI:10.1200/JCO.2010.30.1655 |
| [11] |
Aoyama H, Shirato H, Tago M, et al. Stereotactic radiosurgery plus whole-brain radiation therapy vs stereotactic radiosurgery alone for treatment of brain metastases:a randomized controlled trial[J]. JAMA, 2006, 295(21): 2483-2491. DOI:10.1001/jama.295.21.2483 |
| [12] |
Kim HJ, Im SA, Keam B, et al. Clinical outcome of central nervous system metastases from breast cancer:differences in survival depending on systemic treatment[J]. J Neurooncol, 2012, 106(2): 303-313. DOI:10.1007/s11060-011-0664-8 |
| [13] |
Pors H, von Eyben FE, Sørensen OS, et al. Longterm remission of multiple brain metastases with tamoxifen[J]. J Neurooncol, 1991, 10(2): 173-177. DOI:10.1007/BF00146879 |
| [14] |
Yap YS, Cornelio GH, Devi BC, et al. Brain metastases in Asian HER2-positive breast cancer patients:anti-HER2 treatments and their impact on survival[J]. Br J Cancer, 2012, 107(7): 1075-1082. DOI:10.1038/bjc.2012.346 |
| [15] |
章倩, 陈剑, 俞晓立, 等. 乳腺癌脑转移全脑放疗预后及预后指数分析[J]. 中华放射肿瘤学杂志, 2013, 22(3): 186-189. Zhang Q, Chen J, Yu XL, et al. Analysis of prognostic factors and prognostic indices in breast cancer patients with brain metastases after whole-brain radiotherapy[J]. Chin J Radiat Oncol, 2013, 22(3): 186-189. DOI:10.3760/cma.j.issn.1004-4221.2013.03.004 |
| [16] |
Tsao M, Xu W, Sahgal A. A meta-analysis evaluating stereotactic radiosurgery, whole-brain radiotherapy, or both for patients presenting with a limited number of brain metastases[J]. Cancer, 2012, 118(9): 2486-2493. DOI:10.1002/cncr.26515 |
| [17] |
Antoni D, Clavier JB, Pop M, et al. 3D radiation therapy boost improves the outcome of whole brain radiation therapy treated RPA Ⅱ patients with one or two brain metastases[J]. Int J Mol Sci, 2014, 15(5): 7554-7562. DOI:10.3390/ijms15057554 |
| [18] |
Sahgal A, Aoyama H, Kocher M, et al. Phase 3 trials of stereotactic radiosurgery with or without whole-brain radiation therapy for 1 to 4 brain metastases:individual patient data meta-analysis[J]. Int J Radiat Oncol Biol Phys, 2015, 91(4): 710-717. DOI:10.1016/j.ijrobp.2014.10.024 |
| [19] |
Patchell RA, Tibbs PA, Walsh JW, et al. A randomized trial of surgery in the treatment of single metastases to the brain[J]. N Engl J Med, 1990, 322(8): 494-500. DOI:10.1056/NEJM199002223220802 |
| [20] |
Mintz AH, Kestle J, Rathbone MP, et al. A randomized trial to assess the efficacy of surgery in addition to radiotherapy in patients with a single cerebral metastasis[J]. Cancer, 1996, 78(7): 1470-1476. |
| [21] |
Altundag K, Bondy ML, Mirza NQ, et al. Clinicopathologic characteristics and prognostic factors in 420 metastatic breast cancer patients with central nervous system metastasis[J]. Cancer, 2007, 110(12): 2640-2647. DOI:10.1002/cncr.23088 |
| [22] |
Niwińska A, Murawska M, Pogoda K. Breast cancer brain metastases:differences in survival depending on biological subtype, RPA RTOG prognostic class and systemic treatment after whole-brain radiotherapy (WBRT)[J]. Ann Oncol, 2010, 21(5): 942-948. DOI:10.1093/annonc/mdp407.) |
 2018, Vol. 38
2018, Vol. 38


