乳腺癌是影响女性生命健康的恶性肿瘤之一。保乳手术加术后辅助放化疗是目前治疗早期乳腺癌的最佳方式[1]。同步放化疗因其严重的不良反应不作为临床常用治疗方案,而先放疗还是先化疗目前仍无定论[2]。2016版美国国家综合癌症网(NCCN)乳腺癌诊治指南推荐早期乳腺癌保乳术后患者先行辅助化疗,化疗结束后再行全乳及瘤床加量放疗[2]。但一些研究认为延迟放疗会增加局部复发风险[3-4]。基于以上原因,本组重点对不同高危因素在不同放化疗顺序组中对患者预后影响进行研究,从而为指导早期乳腺癌保乳术患者的个体化治疗提供依据。
资料与方法1.临床资料:2006年1月1日至2015年12月31日大连医科大学附属第二医院收治的早期乳腺癌保乳术后患者191例,术后病理证实切缘阴性,无远处转移及其他肿瘤。191例患者按放化疗顺序分为3组:先放疗组32例、先化疗组107例、化疗-放疗-化疗(“三明治组”)续贯治疗52例。所有患者均签署知情同意书。
2.治疗情况:191例患者均接受保乳手术,腋窝淋巴结阴性者未进行腋窝淋巴结清扫,前哨淋巴结活检阳性行腋窝淋巴结清扫,病理标本证实切缘阴性。常规放疗采用乳腺托板6 MV X射线切线野照射(美国Varian公司),DT 46~50 Gy/23~25次,然后根据超声测得瘢痕下瘤床深度选用9~12 MeV电子线(美国Varian公司)加量10 Gy/5次。3D-CRT或IMRT患者CT下模拟定位,再进行靶区勾画,剂量95%计划靶区体积(PTV)50 Gy,瘤床区标记银夹的行同步瘤床加量,未标记银夹的同常规放疗方法。化疗中采用含紫杉类药物方案、含蒽环类药物方案、紫杉类及蒽环类药物方案。内分泌治疗雌激素/孕激素(ER/PR)受体阳性患者接受3~5年内分泌治疗。靶向治疗为Her-2过表达患者接受了化疗联合曲妥珠单抗治疗。
3.随访方法及研究终点:采用门诊复查、电话方式进行随访,治疗后2年内每3个月门诊随访1次,第3~5年,每6个月随访1次,5年以上每年随访1次,通过CT、超声、肿瘤标志物等检查有无局部和区域淋巴结复发及远地转移。最终随访为2016年10月31日,中位随访时间为58个月(8~122个月),失访6例,随访率97.8%。生存时间从患者保乳手术当日开始计算,研究终点定义为因乳腺癌相关疾病死亡,LRR定义为首次出现患侧乳房、锁骨上下及腋窝淋巴结转移。
4.统计学处理:采用SPSS 20.0统计软件包建立数据库并进行分析,组间构成比比较用卡方检验,Kaplan-Meier法生成生存曲线,组间差异采用Log-rank检验,多因素分析采用Cox模型。P<0.05为差异有统计学意义。
结果1.患者临床特征分析结果:对不同分组中患者构成比进行检验,显示年龄、是否绝经、肿瘤大小、脉管癌栓、乳腺癌分子分型、手术放疗间隔时间在先放疗、先化疗、三明治治疗3组中具有可比性。
2.患者特征单因素分析结果:依据患者生存函数,经单因素分析显示年龄、肿瘤大小、腋窝淋巴结转移、脉管癌栓、乳腺癌分子分型、手术放疗间隔时间是影响乳腺癌治疗的预后因素(χ2=4.211~5.64, P < 0.05),而是否绝经、病理分型、放疗方案与预后无关(P>0.05), 见表 1。
|
|
表 1 191例乳腺癌保乳术后患者临床特征单因素分析结果 Table 1 Results of univariate analysis of clinical features in 191 breast cancer patients with conserving surgery |
3.乳腺癌保乳术后患者特征多因素分析结果:对单因素分析具有统计学差异的临床特征进行Cox多因素分析,肿瘤大小、腋窝淋巴结浸润、脉管癌栓、手术-放疗间隔时间是独立预后危险因素(P<0.05),见表 2。
|
|
表 2 191例乳腺癌保乳术后患者Cox多因素分析结果 Table 2 Results of cox multivariate analysis of 191 breast cancer patients with conserving surgery |
4.先放疗组、先化疗组及三明治组治疗效果临床分析
(1) 肿瘤大小(T1、T2)与治疗顺序对患者预后的影响:T1患者在先放疗组、先化疗组、三明治组中5年LRR分别为5.3%、3.8%、4.3%,5年OS分别为87.4%、89.8%、92.5%(P>0.05)。T2患者5年LRR分别为14.7%、11.6%、3.5%,5年OS分别为82.3%、71.1%、93.6%,LRR和OS 2组差异均无统计学意义(P>0.05)。
(2) 淋巴分期与治疗顺序影响患者情况:因本研究中对于N1患者均先进行化疗,所以本次病例N1数据中没有先放疗组。N1患者先化疗组和三明治组5年LRR为4.5%和16.2%,3组差异有统计学意义(χ2=4.813,P=0.028,图 1),说明N1患者先化疗较三明治方案能取得更好的局部控制,但5年OS为81.3%和85.6%差异无统计学意义(P>0.05)。N0患者在先放疗组、先化疗组与三明治组5年LRR为别为11.2%、7.3%和5.8%,5年OS为92.3%、88.5%和96.7%,LRR和OS 3组比较,差异均无统计学意义(P>0.05)。
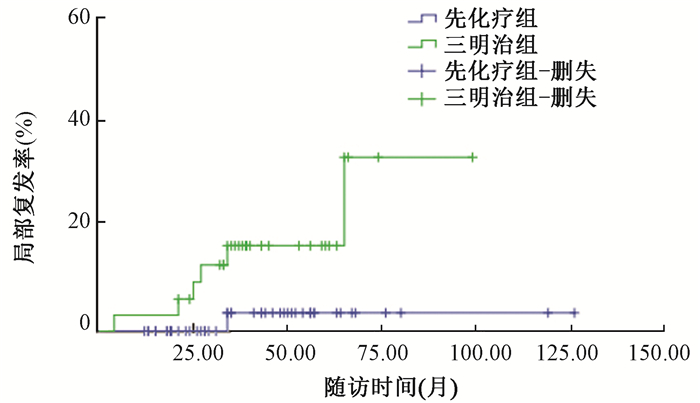
|
图 1 先化疗组和三明治组N1期患者生存函数 Figure 1 Survival function of N1 stage patients in chemotherapy and sandwich groups |
(3) 脉管癌栓与治疗顺序影响患者情况:对有脉管癌栓患者,先放疗组、先化疗组、三明治组5年OS分别为61.5%、90.1%、87.2%,3组比较差异有统计学意义(χ2=6.282,P=0.043),说明对有脉管癌栓患者,应先进行辅助化疗,而5年LRR分别为5.3%、9.2%、18.1%,3组差异无统计学意义(P>0.05)。对无脉管癌栓患者,5年LRR分别为4.5%、6.7%、8.6%,5年OS为89.7%、92.8%、90.1%,3组差异均无统计学意义(P>0.05)。
(4) 手术-放疗间隔时间与治疗顺序影响患者情况:手术放疗间隔时间>6个月患者均来自先化疗组,对先化疗组中手术放疗间隔≤6个月与>6个月进行比较,5年LRR分别为5.2%、14.1%(χ2=4.886,P=0.027),5年OS分别为96.9%、85.7%(χ2=5.758,P=0.038),见图 2。即手术放疗间隔>6个月会增加局部复发风险,影响总生存。手术放疗间隔时间≤6个月患者,先放疗组、先化疗组、三明治组5年LRR分别为3.1%、8.2%、17.5%,5年OS分别为83.9%、90.5%、88.6%,3组差异均无统计学意义(P>0.05)。
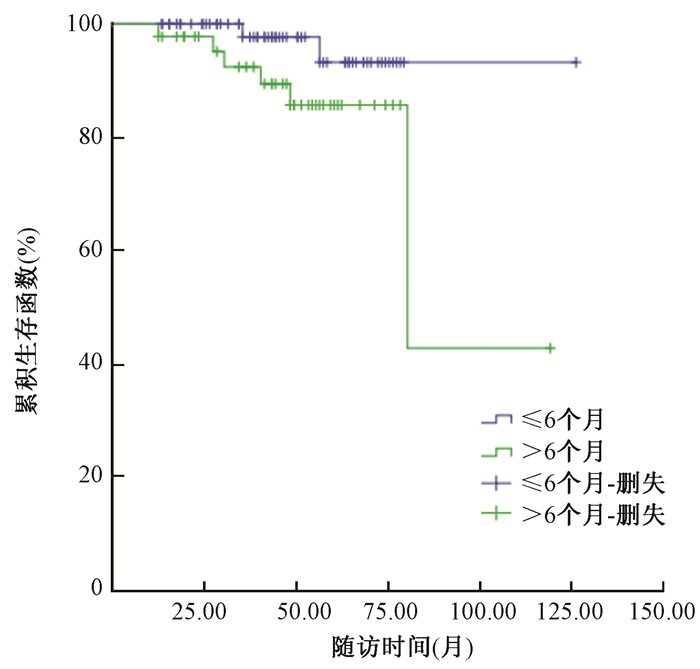
|
图 2 先化疗组中不同放疗时间间隔患者的生存函数 Figure 2 Survival function of patients with different radiotherapy intervals in chemotherapy groups |
讨论
保乳手术联合术后综合治疗已成为早期乳腺癌的规范化治疗。对于老年早期患者,保乳术后单纯放疗结合内分泌治疗就能明显改善预后[5]。但对于一般早期乳腺癌患者,保乳术后除辅助放疗以外,还需要辅助化疗以及内分泌治疗等,目前临床上常用的方法是先进行辅助化疗,但优先化疗会推迟放疗开始时间,并且化疗产生的骨髓抑制以及其他不良反应常导致放疗推迟,增加局部复发风险。而优先放疗有利于控制肿瘤原位复发,但有引起远地转移可能。应该优先放疗还是优先化疗,存在较大争议。
Recht等[6]报道了244名早期有全身转移风险的乳腺癌患者,均接受保乳手术及12周的全身化疗,手术后先放疗患者5年LRR为5%,而先化疗组为14%,两组5年总生存率为73%和81%,作者认为有全身转移风险的患者,先化疗能降低远地转移风险,提高总生存率。Jobsen等[7]比较了641名患者序贯方案中放疗优先和化疗优先对预后影响,结果认为放疗应首先进行,然后进行辅助化疗,可取得更好的预后。Huang等[8]对15 782例患者进行Meta分析,结果显示, 术后先放疗组5年LRR为6%,而先化疗组为15%,先放疗组能更好的控制肿瘤原位复发。除序贯化放疗和放化疗之外,序贯化放化方案(三明治)也是常用的治疗方法。Benchalal等[9]对1 831例早期保乳术后患者预后研究试验中,先放疗组、三明治组和先化疗组9年的局部无病生存率(L-DFS)分别为92.0%、81.5%和87.4%,三明治组无病生存率低于放疗组和先化疗组。Abbas等[10]研究267例保乳术后患者,放疗优先组、化疗优先组、三明治组3年DFS分别为83.5%、82.3%和80%,差异无统计学意义。所以早期保乳术后患者应该先放疗还是先化疗,仍需要更多随机对照研究来证实。
肿瘤大小是影响早期乳腺癌保乳术后独立危险因素,肿瘤越大,患者预后较差[11]。Recht等[6]研究中T1期患者先放疗组和先化疗组5年LRR为6%、10%,T2期患者5年LRR为4%、18%,差异均具有统计学意义,但OS差异无统计学意义。本组研究各组之间差异均无统计学意义,提示放化疗顺序影响不大。
腋窝淋巴结浸润是影响预后重要因素,有无淋巴结浸润临床治疗方法不同,而且受累淋巴结的数目与患者的生存时间呈负相关[12]。Recht等[6]研究中,先放疗组和先化疗组5年LRR在N0患者为0%、20%,N1患者为4%、10%,N2患者为9%、21%,差异均具有统计学意义。本组资料中,先放疗组、先化疗组与三明治组N0期患者5年LRR和OS差异均无统计学意义。N1期患者先化疗较三明治方案能取得更好的局部控制,但5年OS差异并无统计学意义。
脉管癌栓也是影响早期乳腺癌患者保乳术预后的关键因素[13]。本研究资料中,无脉管癌栓患者在先放疗组、先化疗组、三明治组5年LRR和OS差异均无统计学意义。对于有脉管癌栓患者,三明治方案较其他两组有较高的局部复发风险,而优先放疗会对预后产生不良影响,应先进行辅助化疗。
手术-放疗间隔时间也是影响预后的重要原因,推迟放疗会引起局部复发风险的增高。Recht等[14]对295例淋巴结转移患者进行分析,5年LRR在手术-放疗时间<16周为5%,而>16周的患者为35%。Buchholz等[15]研究了105例早期乳腺癌保乳术患者,术后6个月之内放疗LRR为2%,6个月之后放疗LRR为24%。本研究结果表明,术后放疗间隔时间≤6个月各组治疗不会影响LRR和OS;对于手术放疗间隔>6个月会增加局部复发风险,影响总生存,应尽量在术后6个月之内开始放疗。
总之,由于研究对象的不同特征,临床治疗时应该个体化选择方案。对于腋窝淋巴结阴性而局部存在复发高危因素的患者,可以先进行放疗;对于腋窝淋巴结转移或脉管癌栓的高危患者,应早期开始化疗,放疗可以延迟,但不能超过6个月。
利益冲突 无作者贡献声明 李娟负责数据整理、结果分析、论文撰写;李帅负责数据收集和整理;邹丽娟负责临床诊疗和指导论文写作;张卓负责设计研究方案、修改论文
| [1] |
Cojan TST, Vidrighin CD, Ciobanu M, et al. Breast-conserving surgery in breast cancer[J]. Chirurgia, 2012, 107(5): 616-625. DOI:10.1025/j.C,2012.107.025 |
| [2] |
Gradishar W, Salerno KE. NCCN guidelines update:breast cancer[J]. J Natl Compr Canc Netw, 2016, 14(5 Suppl): 641-644. DOI:10.6004/jnccn.2016.0181 |
| [3] |
Hébert-Croteau N, Freeman C, Latreille J, et al. Delay of radiation therapy and outcomes of breast cancer[J]. J Clin Oncol, 2004, 22(7): 1342-1343. DOI:10.1200/JCO.2004.99.066 |
| [4] |
Recht A. Impact on outcome of delay in starting radiotherapy[J]. J Clin Oncol, 2004, 22(7): 1341-1342. DOI:10.1200/JCO.2004.99.056 |
| [5] |
Daugherty EC, Daugherty MR, Bogart JA, et al. Adjuvant radiation improves survival in older women following breast-conserving surgery for estrogen receptor-negative breast cancer[J]. Clin Breast Cancer, 2016, 16(6): 500-506. DOI:10.1016/j.clbc.2016.06.017 |
| [6] |
Recht A, Come SE, Henderson IC, et al. The sequencing of chemotherapy and radiation therapy after conservative surgery for early-stage breast cancer[J]. N Engl J Med, 1996, 334(21): 1356-1361. DOI:10.1056/NEJM199605233342102 |
| [7] |
Jobsen JJ, van der Palen J, Brinkhuis M, et al. Sequence of radiotherapy and chemotherapy in breast cancer after breast-conserving surgery[J]. Int J Radiat Oncol Biol Phys, 2012, 82(5): e811-817. DOI:10.1016/j.ijrobp.2011.11.020 |
| [8] |
Huang J, Barbera L, Brouwers M, et al. Does delay in starting treatment affect the outcomes of radiotherapy? A systematic review[J]. J Clin Oncol, 2003, 21(3): 555-563. DOI:10.1200/JCO.2003.04.171 |
| [9] |
Benchalal M, Le Prise E, de Lafontan B, et al. Influence of the time between surgery and radiotherapy on local recurrence in patients with lymph node-positive, early-stage, invasive breast carcinoma undergoing breast-conserving surgery-results of the french adjuvant study group[J]. Cancer, 2005, 104(2): 240-250. DOI:10.1002/cncr.21161 |
| [10] |
Abbas H, Elyamany A, Salem M, et al. The optimal sequence of radiotherapy and chemotherapy in adjuvant treatment of breast cancer[J]. Int Arch Med, 2011, 4(1): 35-35. DOI:10.1186/1755-7682-4-35 |
| [11] |
Bellon JR, Harris EE, Arthur DW, et al. ACR Appropriateness Criteria (R) conservative surgery and radiation-stage Ⅰ and Ⅱ breast carcinoma[J]. Breast J, 2011, 17(5): 448-455. DOI:10.1111/j.1524-4741.2011.01132.x |
| [12] |
Beenken SW, Urist MM, Zhang YT, et al. Axillary lymph node status, but not tumor size, predicts locoregional recurrence and overall survival after mastectomy for breast cancer[J]. Ann Surg, 2003, 237(5): 732-738. DOI:10.1097/00000658-200305000-00016 |
| [13] |
赵卫红, 徐兵河, 张频. 乳腺癌合并脉管瘤栓的临床病理特点及预后因素分析[J]. 中华肿瘤杂志, 2007, 29(2): 137-141. Zhao WH, Xu BH, Zhang P, et al. Clinical characteristics and prognosis of breast cancer patients with vascular invasion[J]. Chin J Oncol, 2007, 29(2): 137-141. DOI:10.3760/j.issn.0253-3766.2007.02.016 |
| [14] |
Recht A, Harris JR, Come SE. Sequencing of irradiation and chemotherapy for early-stage breast cancer[J]. Oncology (Williston Park, NY), 1994, 8(3): 19-28, 31-32, 37. DOI:10.1102/J.oncol.1994.03.1937 |
| [15] |
Buchholz TA, Austin-Seymour MM, Moe RE, et al. Effect of delay in radiation in the combined modality treatment of breast-cancer[J]. Int J Radiat Oncol Biol Phys, 1993, 26(1): 23-35. DOI:10.1016/0360-3016(93)90169-V |
 2018, Vol. 38
2018, Vol. 38


