2. 610041 成都, 电子科技大学医学院附属肿瘤医院研究所;
3. 610041 成都, 电子科技大学医学院附属肿瘤医院放疗中心
2. Institute, Affiliated Tumor Hospital of Electronic Science and Technology University, Chengdu 610041, China;
3. Department of Radiation Oncology, Affiliated Tumor Hospital of Electronic Science and Technology University, Chengdu 610041, China
放疗在肺癌治疗中占有重要地位。肺癌的类型有小细胞肺癌和非小细胞肺癌两种,其中非小细胞肺癌约占所有肺癌类型80%以上[1],而肺腺癌属于非小细胞肺癌,对放射治疗的敏感性较差,且正常组织耐量和不良反应限制了放疗靶区的剂量提高。
纳米金是指粒径在1~100 nm范围的纳米颗粒,一般以金溶胶的形式存在于水溶液中[2]。纳米金具有稳定的金属特性、独特的光学性质[3]、良好的组织相容性[4]、易控的表面修饰性[5]和高X射线吸收系数等特性[6],使其在生物医学领域有了广阔的应用前景。目前纳米金粒子已被证实能够增加多种肿瘤细胞的放射敏感性[7-9],从而提高放疗疗效,但针对肺癌的报道较少,且机制不明确。本研究利用耦联葡萄糖的纳米金颗粒联合不同能量级别的X射线作用于人肺腺癌细胞,初步探讨其放射增敏作用,为提高肺癌放射治疗疗效提供一种新的方法。
材料与方法1.药品和试剂:耦联葡萄糖纳米金(Glu-GNPs)购于重庆曼纽艾克科技有限公司,吸收光谱特征λmax=523 nm,粒径≤20 nm;胎牛血清和RPMI 1640培养基分别购于美国Hyclone和GIBCO公司;一抗:兔抗人γ-H2AX(phospho S139);二抗:FITC标记的山羊抗兔抗体,购于北京中杉金桥生物技术有限公司。
2.细胞及培养:人肺腺癌A549细胞由四川省肿瘤研究所细胞库提供;用含10%胎牛血清、100 U/ml青霉素和40 U/ml庆大霉素的RPMI 1640全培养基,于37℃、5%CO2常规培养传代。
3.实验分组:将指数生长期的人肺腺癌A549细胞,分为对照组、Glu-GNPs组、单纯照射组(6 MV单纯照射组与160 kV单纯照射组)、Glu-GNPs联合照射组(6 MV+Glu-GNPs组、160 kV+Glu-GNPs组)。
4.照射方法:均采用室温条件下医用直线加速器垂直照射(160 kV:RS2000, 美国Rad Source公司;6 MV:Varian 600 CD, 美国Varian公司),射野12 cm×12 cm,源靶距(SSD)100 cm,吸收剂量率400 cGy/min。照射物表面覆盖2 cm厚填充物。
5.透射电镜观察:收集细胞,经3%戊二醛预固定和1%四氧化锇再固定,丙酮逐级脱水,Epon812包埋,半薄切片光学定位,超薄切片,醋酸铀及枸橼酸铅双重染色,用透射电镜(日本日立H-600Ⅳ型)观察。
6.Glu-GNPs的细胞毒作用:取指数生长期的A549细胞,消化制成细胞悬液(4×105细胞/ml), 取0.1 ml (4 000细胞/孔)接种于96孔板中,培养过夜后,再加入不同浓度梯度(0~100 nmol/L)Glu-GNPs试液;分别作用24和48 h后,吸弃培养上清,加入0.1 ml 0.2%结晶紫染色10 min,用自来水冲洗后,倒扣于吸水纸上吸尽余水,40℃烘干,加入0.2 ml 2%十二烷基磺酸钠(SDS)裂解细胞,用酶标仪于λ=570 nm测定吸光度(A)值,并按下式计算细胞存活率:细胞存活率(%)=(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值) ×100%。其中,实验孔:Glu-GNPs处理孔;对照孔:Glu-GNPs未处理孔;空白孔:结晶紫未处理孔。
7.Glu-GNPs的增殖抑制实验:取0.1 ml(4×104细胞/ml)A549细胞接种于96孔板中培养过夜后,加入不同浓度(0~100 nmol/L) Glu-GNPs处理24 h后,分别用160 kV和6 MV X射线照射2 Gy照射,继续培养24 h,用结晶紫法测定Glu-GNPs联合照射组细胞存活率(同方法6),绘制浓度-细胞存活率曲线。
8.细胞克隆形成实验:取A549单细胞悬液,分别接种于ϕ60 mm的培养皿中,培养过夜后加入20 nmol/L Glu-GNPs作用48 h后,分别给予160 kV和6 MV X射线照射0、2、4、6和8 Gy,继续培养12~14 d后,用0.5%结晶紫染色液染色10 min,计数≥50个细胞克隆,计算细胞存活分数(SF)并绘制剂量效应曲线。克隆形成率(PE, 100%)=克隆数/接种细胞数×100%,以PE作为校正系数计算SF,SF=受照射细胞PE/对照组细胞PE。用单击多靶模型拟合细胞存活曲线,计算出单纯照射组与Glu-GNPs联合照射组的放射生物学参数(准阈剂量Dq,平均致死剂量D0,2 Gy时细胞的存活分数SF2和放射增敏比SERD0。
9.γ-H2AX免疫荧光法:取4×105细胞/ml单细胞悬液0.1 ml接种于24孔板中,加入20 nmol/L Glu-GNPs作用48 h后,行2 Gy X射线照射,24 h后用-20℃预冷甲醇固定5 min,磷酸盐缓冲液(PBS)洗涤3次,用0.1%TritonX-100-PBS处理10 min,3%牛血清白蛋白(BSA)封闭,加入一抗4℃孵育过夜,PBS洗涤3次后,加入二抗孵育1 h,0.5 μg/ml 4′6-二脒基-2-苯基吲哚(DAPI)染色,PBS洗涤3次后, 置于荧光显微镜下观察细胞DNA双链断裂的荧光焦点(foci),计数3个视野60个细胞,并计算平均每个细胞荧光焦点数。实验重复3次。
10.统计学处理:采用SPSS 19.0软件进行数据分析。计量资料符合正态分布,以x±s表示。方差齐性检验后采用单因素方差分析,两组间比较采用独立样本t检验,克隆形成实验采用GraphPad Prism 5.0软件拟合细胞存活曲线。P < 0.05为差异有统计学意义。
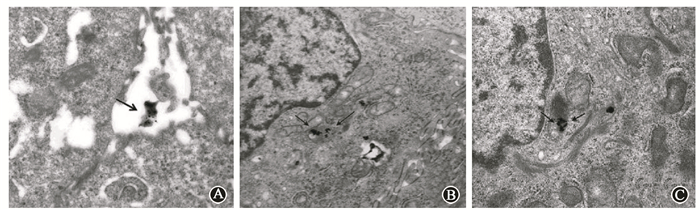
结果1.Glu-GNPs在A549细胞中的分布:投射电子显微镜(TME)观察显示,Glu-GNPs处理A549细胞24 h后,Glu-GNPs未进入细胞内;而作用48 h后,可观察到Glu-GNPs进入细胞内,主要分布于胞质线粒体或内涵体中(图 1)。
|
图 1 TME观察Glu-GNPs在A549细胞中的分布 A.作用24 h后Glu-GNPs分布于细胞外;B、C.作用48 h后,Glu-GNPs进入细胞质,分别分布于内涵体和线粒体内 注:箭头所指Glu-GNPs的位置 Figure 1 TME images of the distribution of Glu-GNPs in A549 cell A. Extracellular distribution of Glu-GNPs after 24hof Glu-GNPs treatment; B-C. Glu-GNPs enter into cytoplasm and distribute in endosomes and mitochondria after 48hof Glu-GNPs treatment |
2.Glu-GNPs对A549细胞毒作用:不同浓度(0~100 nmol/L)Glu-GNPs分别处理A549细胞24和48 h后,Glu-GNPs组与对照组细胞的存活率无明显差异(P=0.064)。提示Glu-GNPs浓度在≤100 nmol/L时无明显的细胞毒作用。因此以下实验,采用Glu-GNPs的浓度≤100 nmol/L。
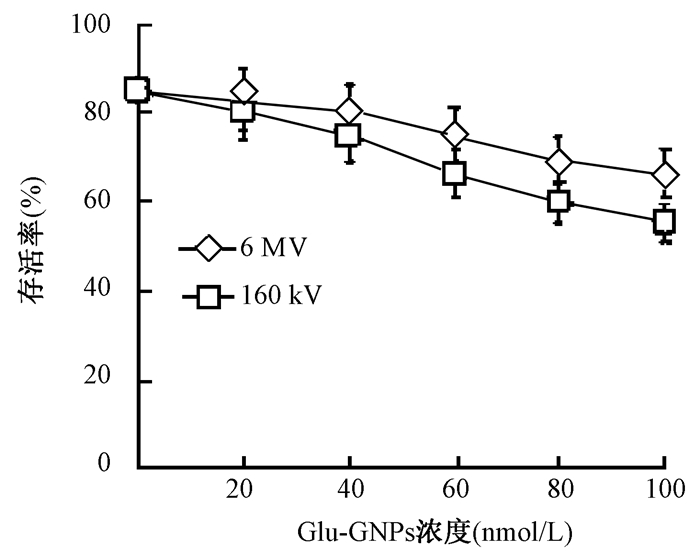
3.Glu-GNPs增加放射诱导的生长抑制作用:剂量为2 Gy射线处理单纯照射组(即Glu-GNPs浓度为0)及Glu-GNPs联合照射组后,单纯照射组细胞存活率为(83.74±1.56)%,Glu-GNPs联合照射组较单纯照射组存活率降低,细胞生长抑制明显,其抑制作用随Glu-GNPs的浓度增加而增大,且在联合照射组中160 kV+Glu-GNPs组的生长抑制作用较6 MV+Glu-GNPs组更加明显(F=42.92,P=0.034),见图 2。
|
图 2 2 Gy不同射线联合不同浓度Glu-GNPs作用A549细胞后的存活率 注:160 kV+Glu-GNPs组与6 MV+Glu-GNPs组比较,F=42.92,P=0.034 Figure 2 Survival of A549 cells after 2 Gy irradiation combined with different concentrations of Glu-GNPs |
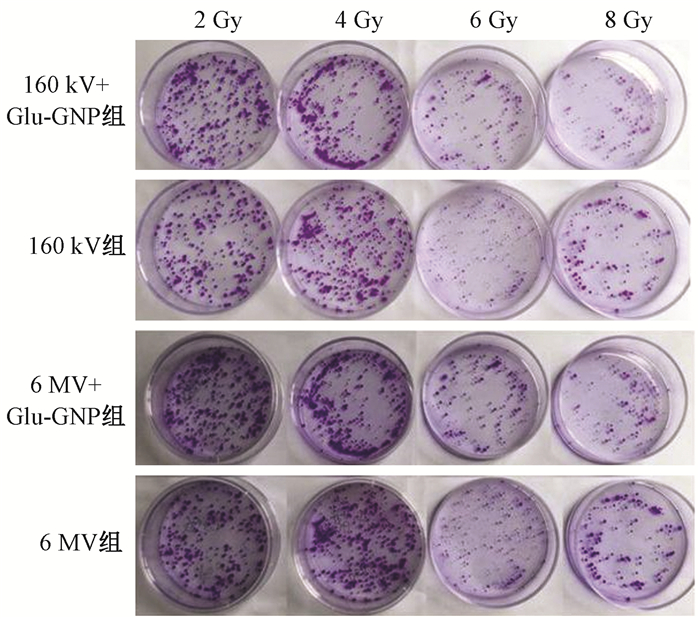
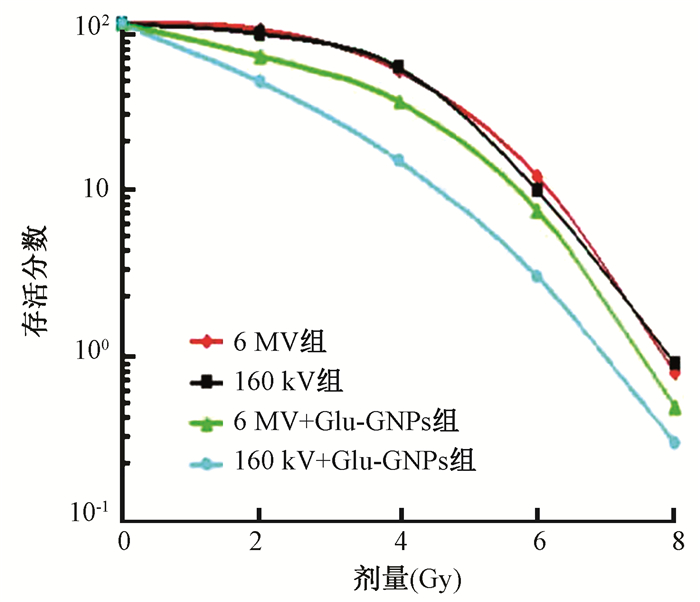
4.Glu-GNPs对放射诱导细胞克隆形成的影响:A549细胞克隆试验各组细胞集落形成情况见图 3。A549细胞经2、4、6、8 Gy照射后,Glu-GNPs联合照射组中,160 kV+Glu-GNPs组与6 MV+Glu-GNPs组相比各剂量点SF显著降低(P=0.003、0.001、0.000、0.000),且呈放射剂量依赖性。相对于单纯照射组(6 MV单纯照射组与160 kV单纯照射组)、Glu-GNPs联合照射组(6 MV+Glu-GNPs组、160 kV+Glu-GNPs组)D0、Dq及SF2均降低,其增敏比分别为1.15和1.41(图 4,表 1)。
|
图 3 A549细胞克隆试验各组细胞集落形成图 Figure 3 Colony formation of A549 cells in each group |
|
图 4 克隆形成实验检测Glu-GNPs对A549细胞放射敏感性影响 Figure 4 Radiosensitization effect of Glu-GNPs on A549 cells evaluated by clonogenic survival assay |
|
|
表 1 单击多靶模型拟合各组A549细胞存活曲线相关生物学参数 Table 1 Biological parameters of survival curves of A549 cells fitted by the multi-target model |
5.Glu-GNPs增加放射诱导的DNA双链断裂:联合照射组较单纯照射组均有更多的DNA损伤(t=3.345、4.534、6.763,P < 0.05;t=7.738、9.546、12.652,P < 0.05)。而联合照射组中,Glu-GNPs+160 kV组较Glu-GNPs+6 MV组中DNA损伤更加明显(t=12.392、14.893、18.947,P < 0.05),见图 5,表 2。
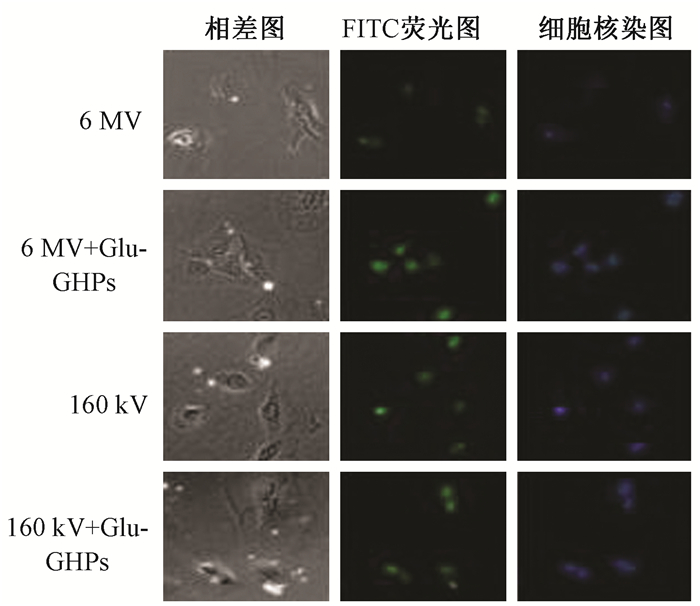
|
图 5 不同条件处理A549细胞的γ-H2AX荧光显微镜图像 Figure 5 Fluorescence microscopy images of γ-H2AX foci in A549 cells with different treatments |
|
|
表 2 不同射线条件诱导的A549细胞DNA损伤焦点数(个,x±s) Table 2 Radiation-induced γ-H2AX foci in A549(x±s) |
讨论
随着医学技术的不断提高以及医疗设备的不断更新,肺癌的治疗效果取得了一定的进步但仍不理想,ⅢA期以上肺癌的5年生存率不足20%,而ⅢB期仅8%[10]。但由于放疗的治疗模式决定了其在射线照射的路径上,肿瘤组织和正常组织都会受到辐射[11-12]。肿瘤组织的抗辐射性及相关放疗并发症使放疗应用受到很大限制[13]。因此,提高肺癌患者的放射敏感性,减少放疗并发症至关重要。
Herold等[14]首次发现了纳米金材料的辐射增敏作用,他们将纳米金颗粒与肿瘤细胞混合或注射至肿瘤组织中,使用光子束照射后,与对照组比较,结果显示纳米金能够增加辐射生物有效剂量。近年来随着纳米金研究的深入,辐射增敏相关的研究逐渐增多,大部分研究均一致认同纳米金具有辐射增敏作用。有研究显示,采用140 kV X射线照射的肿瘤组织中,肿瘤物理剂量增强率可达到200%,而对于4和6 MV的X射线,纳米金对肿瘤组织的物理剂量增强率仅有7%[15]。其剂量增强作用的机制为光子束与聚集于肿瘤组织的纳米金相互作用发生光电效应,产生大量的次级电子,次级电子的射程非常短,其能量最终被纳米金周围的肿瘤细胞所吸收,在kV级的光子束与物质发生光电效应为主,故其物理剂量增强效应显著,对于MV级的高能光子束,主要发生的不是光电效应,而是康普顿效应,因而纳米金对高能光子的增敏作用不明显。如果增敏效应的出现仅仅是因为上述物理机制,那么据此推断纳米金在以康普顿效应为主的兆伏级能量下应该不会有明显的放射增敏作用。但是事实并非如此。Jain等[16]的生物学效应研究发现纳米金颗粒分别在160 kV、6和15 MV X射线中对人乳腺癌细胞MDA-MB-231的辐射增敏率为1.41、1.29和1.16,其结果表明纳米金对kV和MV级X射线都能发挥相近的辐射增敏生物学效应。那么在肺癌细胞中,不同能级对其放射增敏的强弱如何?
目前,纳米金对肺癌细胞的增敏研究相对较少,并且仅仅局限于单一能量射线条件下辐射增敏现象的发现。本研究在细胞实验的基础上,通过两种不同照射能量对A549细胞进行处理,来进一步探讨不同能级条件下纳米金的辐射增敏作用。首先将纳米金与葡萄糖耦联结合形成具有一定靶向作用的葡萄纳米金(Glu-GNPs);通过不同时间段电镜成像,来观察Glu-GNPs进入细胞的时间和进入细胞后的聚集位置;并在其无毒的浓度条件下,利用细胞存活实验来对其放射增敏效应进行研究;通过细胞克隆形成验证其放射增敏作用的强弱;最终利用γ-H2AX试剂定量的检测出DNA双链损伤的情况,进一步从本质上解释其放射增敏的作用。初步发现Glu-GNPs进入细胞后呈聚集状态停留于胞质内有膜细胞器中,其在kV及MV条件下均有辐射增敏效应,但160 kV相对于6 MV的辐射剂量中,纳米金的增敏效果更佳,可造成更多的DNA损伤。本实验研究结果与前期国内外学者研究结论较为一致。那么以康普顿效应为主的MV射线产生的次级能量极少,为什么也能产生增敏效应,这提示纳米金的增敏并非单纯的依靠次级电子能量来对肿瘤细胞进行更多的杀伤。Porcel等[17]提出,纳米金增敏机制除了其与射线产生次级电子外,还可能与其导致更多的自由基产生有关。带正电荷的纳米金离子(光子或俄歇电子发射后)与射线作用后导致周围水分子变得不稳定而极易解离,进一步提高了自由基产率,且次级电子还可电离水分子,产生更多的自由基。以上是目前国内外比较认同的纳米金增敏机制。本实验结果也验证了其合理性。
本实验结果中也发现了一些问题,比如Glu-GNPs处理细胞24 h后电镜切片并未观察到Glu-GNPs进入到细胞内,这可能与实验中用到的Glu-GNPs的粒径和细胞种类有关。细胞增殖抑制实验中,随着Glu-GNPs浓度的增大,A549细胞存活率降低明显,是否可以继续增大Glu-GNPs的浓度来提高放射敏感性?笔者认为,理论上可以无限增大Glu-GNPs的浓度来提高放射效果,但需要考虑其细胞毒性,尽管纳米金具有相对惰性及生物相容性,前期研究中也发现它不会对人源细胞产生急性毒性反应,但越来越多的毒性相关研究结果提示纳米金并非完全没有毒性[18-19]。因此,Glu-GNP进入细胞的影响因素、潜在的细胞毒性作用等,还需进一步研究来探讨。
总之,纳米金与放射线结合,通过造成更多的DNA损伤来起到辐射增敏作用,这为肺癌的放射治疗提供一种新的思路。当然,关于纳米金的辐射增敏机制有待进一步深入研究。
利益冲突 本研究接受四川省卫生和计划生育委员会重点研究项目(16ZD031)资助,署名作者按以下贡献申明独立开展本研究,不涉及任何利益冲突,再次对此研究的独立性及科学性予以保证作者贡献声明 张国军进行试验并撰写论文初稿;杨川协助实验进行;黄建鸣、吕家华、李涛负责实验指导、论文审阅及修改
| [1] |
Hanahan D, Weinberg RA. Hallmarks of cancer:the next generation[J]. Cell, 2011, 144(5): 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [2] |
Jain S, Hirst DG, O'Sullivan JM, et al. Gold nanoparticles as novel agents for cancer therapy[J]. Br J Radiol, 2012, 85(1010): 101-113. DOI:10.1259/bjr/59448833 |
| [3] |
Liu W, Zhu Z, Deng K, et al. Gold nanorod@chiral mesoporous silica core-shell nanoparticles with unique optical properties[J]. J Am Chem Soc, 2013, 135(26): 9659-9664. DOI:10.1021/ja312327m |
| [4] |
Hu X, Gao X. Multilayer coating of gold nanorods for combined stability and biocompatibility[J]. Phys Chem Chem Phys, 2011, 13(21): 10028-10035. DOI:10.1039/c0cp02434a |
| [5] |
Ding H, Yong KT, Roy I, et al. Gold nanorods coated with multilayer polyelectrolyte as contrast agents for multimodal imaging[J]. J Phys Chem C, 2007, 111(34): 12552-12557. DOI:10.1021/jp072524s |
| [6] |
Rana S, Bajaj A, Mout R, et al. Monolayer coated gold nanoparticles for delivery applications[J]. Adv Drug Deliv Rev, 2012, 64(2): 200-216. DOI:10.1016/j.addr.2011.08.006 |
| [7] |
Zhang X, Xing JZ, Chen J, et al. Enhanced radiation sensitivity in prostate cancer by gold-nanoparticles[J]. Clin Invest Med, 2008, 31(3): E160-167. DOI:10.25011/cim.v31i3.3473 |
| [8] |
Geng F, Song K, Xing JZ, et al. Thio-glucose bound gold nanoparticles enhance radio-cytotoxic targeting of ovarian cancer[J]. Nanotechnology, 2011, 22(28): 285101. DOI:10.1088/0957-4484/22/28/285101 |
| [9] |
Kong T, Zeng J, Wang X, et al. Enhancement of radiation cytotoxicity in breast cancer cells by localized attachment of gold nanoparticles[J]. Small, 2008, 4(9): 1537-1543. DOI:10.1002/smll.200700794 |
| [10] |
Travis WD, Brambilla E, Noguchi M, et al. International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society:international multidisciplinary classification of lung adenocarcinoma:executive summary[J]. Proc Am Thorac Soc, 2011, 8(5): 381-385. DOI:10.1513/pats.201107-042ST |
| [11] |
Greish K. Enhanced permeability and retention of macromolecular drugs in solid tumors:a royal gate for targeted anticancer nanomedicines[J]. J Drug Target, 2007, 15(7-8): 457-464. DOI:10.1080/10611860701539584 |
| [12] |
Hainfeld JF, Dilmanian FA, Slatkin DN, et al. Radiotherapy enhancement with gold nanoparticles[J]. J Pharm Pharmacol, 2008, 60(8): 977-985. DOI:10.1211/jpp.60.8.0005 |
| [13] |
Petrelli F, Comito T, Ghidini A, et al. Stereotactic body radiation therapy for locally advanced pancreatic cancer:a systematic review and pooled analysis of 19 trials[J]. Int J Radiat Oncol Biol Phys, 2017, 97(2): 313-322. DOI:10.1016/j.ijrobp.2016.10.030 |
| [14] |
Herold DM, Das IJ, Stobbe CC, et al. Gold microspheres:a selective technique for producing biologically effective dose enhancement[J]. Int J Radiat Biol, 2000, 76(10): 1357-1364. DOI:10.1080/09553000050151637 |
| [15] |
Cho SH. Estimation of tumour dose enhancement due to gold nanoparticles during typical radiation treatments:a preliminary Monte Carlo study[J]. Phys Med Biol, 2005, 50(15): N163-173. DOI:10.1088/0031-9155/50/15/N01 |
| [16] |
Jain S, Coulter JA, Hounsell AR, et al. Cell-specific radiosensitization by gold nanoparticles at megavoltage radiation energies[J]. Int J Radiat Oncol Biol Phys, 2011, 79(2): 531-539. DOI:10.1016/j.ijrobp.2010.08.044 |
| [17] |
Porcel E, Liehn S, Remita H, et al. Platinum nanoparticles:a promising material for future cancer therapy?[J]. Nanotechnology, 2010, 21(8): 85103. DOI:10.1088/0957-4484/21/8/085103 |
| [18] |
Tsoli M, Kuhn H, Brandau W, et al. Cellular uptake and toxicity of Au55 clusters[J]. Small, 2005, 1(8-9): 841-844. DOI:10.1002/smll.200500104 |
| [19] |
Pan Y, Neuss S, Leifert A, et al. Size-dependent cytotoxicity of gold nanoparticles[J]. Small, 2007, 3(11): 1941-1949. DOI:10.1002/smll.200700378 |
 2018, Vol. 38
2018, Vol. 38


