2. 210003 南京, 东南大学附属第二医院放疗科;
3. 210061 南京至泰生物医药科技有限公司
2. Department of Radiotherapy, The Second Hospital Affiliated to Southeast University, Nanjing 210003, China;
3. Nanjing Zetect Bioscience Incorporated, Nanjing 210061, China
外泌体(exosome,EXO)是一种能被大多数细胞分泌的双层脂质结构的微小膜泡,直径大约30~150 nm。近年来人们发现外泌体膜泡中含有细胞特异的蛋白、mRNA、microRNA(miRNA)、lncRNA、双链DNA等[1-2],外泌体通过膜融合或胞吞的方式将其携带的核酸、蛋白释放到受体细胞中,通过分子生物信号的传递改变受体细胞的功能和生理状态[3-4]。在微环境中,原发肿瘤来源的外泌体能够诱导形成肿瘤预转移龛(pre-metastatic niche),使肿瘤细胞的侵袭性增强、扩散并对放化疗产生耐受[5]。在乏氧环境中肿瘤细胞逐步会对射线产生抗拒性,而肿瘤细胞释放的外泌体正是促使其适应环境的重要物质[6-8]。本研究通过收集乏氧条件下(1% O2浓度)人肺癌A549细胞所产生的外泌体(hypoxia exosome, H-EXO),与常氧条件下细胞产生的外泌体(normoxic exosome, N-EXO)对比,观察H-EXO对常氧条件下A549细胞对X射线敏感性的变化。该研究结果有望为改善实体肿瘤乏氧区的放射治疗效果提供新的实验和理论依据。
材料与方法1.主要试剂与仪器:DMEM培养基、无血清培养基、胎牛血清购自美国Invitrogen公司,含2% EDTA胰酶、CD-63、RIPA裂解液、PKH67、GAPDH抗体和二抗购自美国Sigma公司,青霉素和链霉素购自美国Hycolone公司,二喹啉甲酸(BCA)分析试剂盒购自美国Life Technologies公司,低氧CO2细胞培养箱购自德国Thermo Scientific公司,Transwell小室购自美国BD公司,MMP2、MMP9 ELISA试剂盒购自武汉华美生物工程有限公司,UV-2300紫外分光光度计购自天津港东科技发展有限公司,荧光显微镜购自德国Zeiss公司,NanoSight纳米颗粒跟踪分析仪购自英国Malvern公司,扫描电子显微镜Quata 400购自荷兰FEI公司,医用电子直线加速器购自德国Siemens Primus公司,酶标仪购自美国BioRad公司。
2.细胞培养:人肺腺癌A549细胞,购自美国模式培养物集存库(ATCC)。细胞均在含10%胎牛血清、100 μm/L青霉素和100 μm/L链霉素的DMEM完全培养基中培养,种植在T-225细胞培养瓶中,常氧条件为:37℃、21%O2、5%CO2、74%N2、饱和湿度。乏氧细胞生长在乏氧培养仓中,培养条件:37℃、1%O2、5%CO2、94%N2、饱和湿度。收集外泌体时使用无血清培养基培养细胞。细胞经0.25%胰酶(含EDTA)传代和收获,取对数生长期细胞进行实验。
3.外泌体的分离:采用经典的超高速离心法收集。使用无血清培养基培养细胞48 h后,收集细胞培养液,30 ml培养液培养3×108细胞,首先用孔径为0.22 μm的过滤器过滤,除去杂质和悬浮细胞;然后300×g离心10 min,2 000×g离心10 min,10 000×g离心30 min,以除去细胞碎片,取上清;采用体积为15 ml、分子拦截量为100 000的超滤离心管浓缩上清液。浓缩后上清再经100 000×g离心120 min,获得的沉淀即为细胞分泌的外泌体;将外泌体沉淀重悬于磷酸盐缓冲液PBS中,-80℃保存备用。所有离心步骤均在4℃条件下进行。
4.外泌体计数:采用NanoSight进行检测。将收集的外泌体稀释,取样约300 μl加载到NanoSight的光学玻璃片上,避免气泡产生。手动聚焦,然后用自带软件进行拍照、录像、分析数量和大小分布。
5.扫描电镜观察外泌体外观和大小:将收集到的5 μl外泌体样品滴加在硅片上,用4%多聚甲醛固定10 min,然后用20%、30%、50%、70%、85%、95%和100%的梯度乙醇脱水各15 min。样品过夜冷冻干燥后表面喷涂金属,外观用扫描电镜观察拍照。
6.蛋白印迹实验:蛋白样品提取时,使用含1%蛋白酶抑制剂的RIPA裂解液在4℃下充分消化30 min,再用超声处理1 min。蛋白总量测定用BCA分析试剂盒,操作方法可参考产品说明书。绘制完标准曲线后,根据样品的荧光强度来计算蛋白总量。蛋白印记对GAPDH、CD63做表征。具体而言,用含8 mol/L尿素的2.5%的十二烷基硫酸钠(SDS),5 μg/ml亮抑酶肽,1 μg/ml抑肽素和1 mmol/L的苯甲磺酰氟去裂解。经蛋白浓度测定后,跑12%聚丙烯酰胺电泳。之后将蛋白转移到PVDF膜上,并用含5%无脂奶,0.05%吐温(Tween-20)常温下封闭1 h,再4℃与一抗孵育过夜,然后用二抗标记。样品用含0.05%吐温的PBS彻底清洗后用化学发光法观察印记条带。
7.乏氧细胞对射线的耐受性实验:CCK8法检测不同时间点细胞的增殖水平。A549细胞以相同数量(2 000/孔)接种在96孔板中,分别在乏氧和常氧条件下培养(每个条件下细胞重复分3组),待细胞融合至80%时,使用2 Gy 300 kV的X射线(德国西门子Primus直线加速器,2 Gy/min)照射细胞,CCK8法检测照射后不同时间点(0、2、4、6 d)细胞的存活率。按照CCK8试剂盒操作, 每孔加入20 μl CCK8孵育4 h。酶标仪检测分析仪测定490 nm处吸光度(A)值,计算不同浓度下的细胞存活率,存活率(%)=(实验组A值/对照组A值)×100%,使用Graphpad prism 6软件做存活曲线。
8.细胞摄取外泌体实验:使用PKH67标记外泌体检测细胞对外泌体的摄取及内化。标记步骤:将收集到的外泌体使用100 μl PBS重悬后加0.4 ml稀释液(Diluent C)混匀,将4 μl PKH67加入到0.5 ml Diluent C中,然后将含外泌体的溶液和含4 μl PKH67溶液均匀混合,室温下孵育10 min,加入1 ml浓度为10%生物血清白蛋白(BSA)终止染色,加9 ml的PBS后采用超高速离心法重新提取PKH67标记的外泌体,100 μl PBS重悬后加入到预先接种有A549细胞含有玻片的35 mm直径培养皿中,在37℃、5%CO2条件下孵育4 h,细胞用PBS洗2次,4%多聚甲醛固定10 min,浓度为10 μg/ml的DAPI染色2 min,PBS洗涤3次,抗荧光淬灭液封片,荧光显微镜下观察拍照。
9.划痕实验:实验分3组,即H-EXO组、N-EXO组和对照组。先用标记笔在6孔板背后均匀划横线,每隔1 cm一道,横穿过孔。每孔穿过5条线。每孔中加入约5×105细胞。细胞过夜培养后长至约80%融合,第2天用20 μl的枪头垂至于背后的横线划痕。用PBS洗细胞3次去除划下的细胞,分别加入2 ml无血清培养基和4 μg外泌体。放入37℃、5% CO2培养箱培养。按0、12、24、48 h取样,普通显微镜拍照,使用AxioVision Rel.4.7软件分析划痕刻度变化。
10.Transwell实验:实验分组同方法9。将A549细胞消化、计数调整浓度为2×105/ml。Transwell chamber下室加入600 μl含10%胎牛血清(FBS)的培养基,上室加入150 μl细胞悬液(含0.5% BSA)和0.1 μg外泌体,继续在细胞培养箱中培养24 h。取出小室、吸干上室的培养液,加入含有800 μl甲醇室温固定20 min。去除上室的甲醇,移到加入含有800 μl结晶紫染液的孔中,室温染色30 min。用清水冲洗小室3次、晾干,移至载玻片上,中性树胶封片。显微镜下取9个随机视野计数,统计结果进行分析。
11.基质金属蛋白酶检测:采用酶联免疫吸附试验(ELISA)法检测细胞上清液中基质金属蛋白酶MMP2、MMP9。取对数生长期的A549细胞,接种于无菌24孔培养板中,每孔l ml培养液,培养24 h待细胞贴壁,分别加入0.5 μg外泌体后常规培养。48 h后,取出培养液300×g离心10 min,仔细收集上清液,按照ELISA试剂盒说明检测细胞上清液中MMP2、MMP9浓度测定。
12.细胞克隆形成实验:将对数生长期的A549细胞以每孔100个接种于6孔板中,每组均设3个皿,第2天分别更换为新鲜培养液或者条件培养液在37℃、5%CO2条件下静置培养14 d。细胞照射采用Pantak X射线装置,射线能量为240 kV,吸收剂量率为0.73 Gy/min,弃去培养基,用甲醇固定,亚甲基蓝染色,镜下计数含50个细胞以上的集落数。计算克隆形成率和细胞克隆存活率:克隆形成率(%)=(克隆数/接种细胞数) × 100%;细胞克隆存活率=处理组克隆形成率/对照组克隆形成率。
13.统计学处理:数据经正态性检验符合正态分布,以x±s表示,每组实验数据重复3次,每次设≥3个平行样。用Graphpad Prism 6软件分析单击多靶模型拟合细胞存活曲线,组间比较采用t检验,采用Graphpad prism 6软件计算t值。P < 0.05为差异有统计学意义。
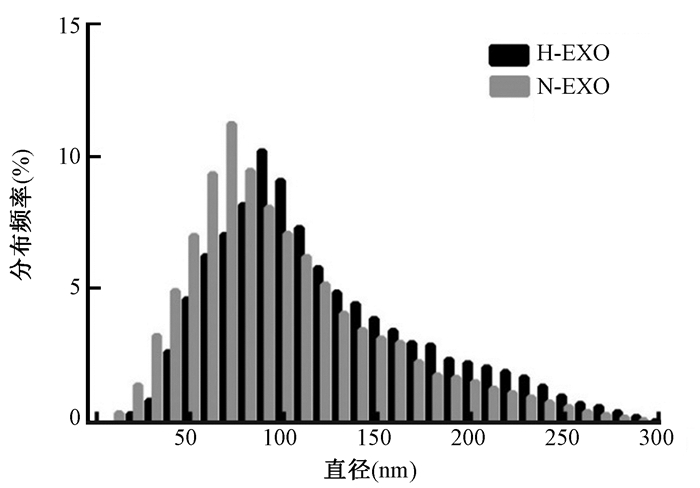
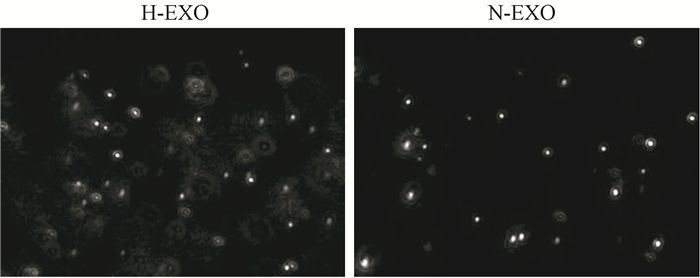
结果1.乏氧和常氧外泌体外观、大小、数量比较:如图 1所示,扫描电镜显示H-EXO直径变小,两种外泌体呈现典型的环饼状。H-EXO的粒径分布范围为30~200 nm,小于N-EXO的粒径(50~220 nm),NanoSight结果显示H-EXO为(16.26±2.73)×109/ml,较N-EXO的(6.42±2.28)×109/ml明显增多(t=15.71,P < 0.01),见图 2。
|
图 1 扫描电镜测算两种外泌体直径分布范围 Figure 1 The distribution of diameter of two kinds of exosomes detected by a scanning electron microscopy |
|
图 2 NanoSight显示两种外泌体的荧光点 Figure 2 The fluorescent dots of two kinds of exosomes shown in Nanosight |
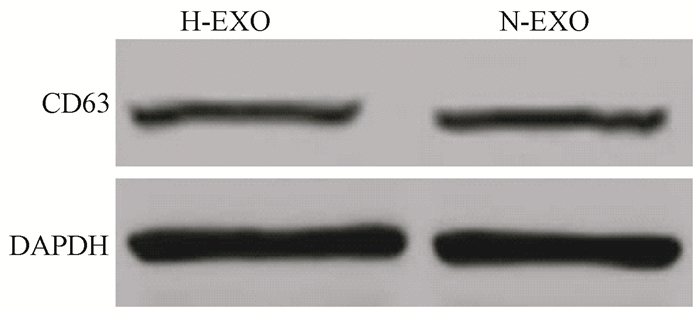
2.蛋白印迹实验结果:结果如图 3显示,H-EXO和N-EXO均能表达外泌体标志物CD63,且二者表达水平无明显差别。
|
图 3 蛋白印迹检测外泌体表面标记蛋白CD63的表达 Figure 3 Exosomes marker protein CD63 expression was detected by Western blot |
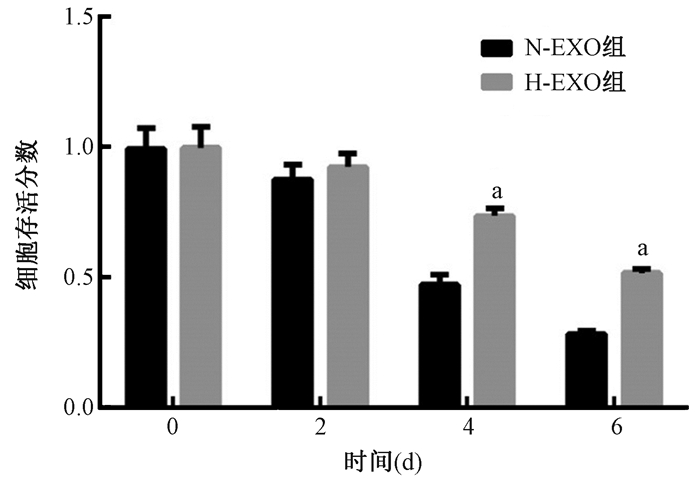
3.细胞增殖抑制实验结果:见图 4。乏氧条件培养的A549细胞接受2 Gy X射线照射,细胞增殖水平在2 d时与常氧细胞无明显差别,而在4和6 d时乏氧细胞的增殖水平远高于常氧条件下的细胞(t=9.44、19.66,P < 0.05),提示乏氧条件能提高细胞对X射线的耐受水平。
|
图 4 2 Gy X射线照射后A549细胞的存活分数 注:a与同一时间乏氧组比较,t=9.44、19.66,P < 0.05 Figure 4 The survival rate of A549 cells after 2 Gy X-rays irradiation |
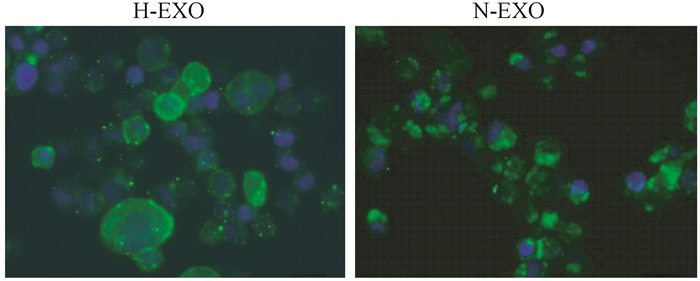
4.细胞摄取外泌体实验结果:图 5显示两种外泌体与肺癌A549细胞共培养4 h后,采用PKH67绿色荧光标记的外泌体分布在细胞内,且靠近细胞膜的边缘区域分布更多,结果说明H-EXO和N-EXO两种外泌体均可以被细胞摄取、内化。
|
图 5 两种外泌体与肺癌A549细胞共培养4 h后的摄取实验 注:绿色荧光为PKH67标记的外泌体,蓝色荧光为DAPI染色,标尺长度为10 μm Figure 5 The uptake assay of two kinds of exosomes after co-culture with A549 cells for 4 h |
5.划痕实验和Transwell实验结果:见图 6。将收集到的H-EXO和N-EXO加入到常规培养的A549细胞中,发现在12、24、48 h后,H-EXO组细胞划痕宽度远小于N-EXO组(t=2.96、6.76、3.35,P < 0.05)。Transwell实验结果同样证实H-EXO组穿膜细胞数(37.33±6.11)个大于N-EXO组(16.00±4.58)和对照组(8.66±1.52)个(t=4.84、7.88,P < 0.01),提示H-EXO对细胞迁移和侵袭能力的影响强于N-EXO。

|
图 6 3组细胞划痕宽度的比较 注:a与N-EXO组比较,t=2.96、6.76、3.35,P < 0.05 Figure 6 Comparison of the scratch width among three groups |
6.MMP2和MMP9检测结果:见表 1。ELISA结果显示,H-EXO组上清液中MMP2和MMP9表达水平较对照组(t=4.70、3.21,P < 0.05)和N-EXO组(t=5.61、3.76,P < 0.05)均明显增高。
|
|
表 1 3组细胞上清液中MMP2、MMP9的表达水平(ng/ml, x±s) Table 1 The contents of MMP2 and MMP9 in cell suspension of three groups (ng/ml, x±s) |
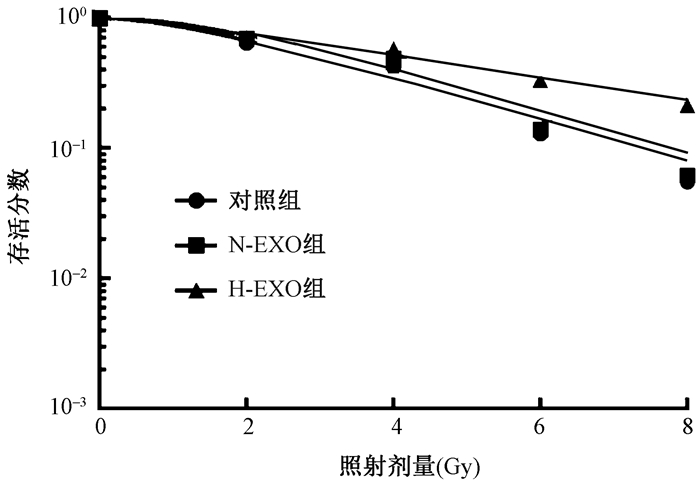
7.细胞克隆形成实验结果:见图 7。通过单击多靶模型计算对照组、N-EXO组和H-EXO组3组的D0值分别为2.614、2.552、4.850 Gy,提示H-EXO较N-EXO可以明显增强A549细胞的放射抵抗性。
|
图 7 细胞克隆形成实验检测H-EXO和N-EXO对A549细胞的放射敏感性 Figure 7 The radiosensitization effect of H-EXO and N-EXO on A549 cells evaluated by cell clonogenic formation assay |
讨论
研究发现外泌体携带丰富的脂质、蛋白质和多种核酸,在细胞间的通讯发挥重要作用。肿瘤来源的外泌体在微环境中能够使肿瘤细胞扩散并对放化疗产生耐受。通过控制、消除肿瘤释放的外泌体或针对其携带的物质,有可能抑制肿瘤的放化疗耐受、侵袭和扩散[9-10]。在乏氧微环境下,乳腺癌细胞表现出由缺氧诱导因子1-α(HIF1-α)调节的导致外泌体释放增加[11]。人多发性骨髓瘤细胞在乏氧条件下产生的外泌体可以促使周围新生血管的生成,而这一促进肿瘤进展的现象正是由外泌体携带的miRNA-135b通过调控HIF-1/FIH信号通路实现的[8]。
本研究通过模拟肿瘤乏氧微环境培养A549细胞,探讨外泌体在乏氧条件下自身生理功能的变化以及对周围细胞放射抗拒的影响。本研究首先观察到乏氧条件下培养的A549细胞对X射线的耐受性明显增强。收集细胞在乏氧和常氧条件下所释放的H-EXO和N-EXO,电镜和Nanosight检测证实乏氧条件下的A549细胞释放的外泌体比常氧细胞分泌的外泌体尺寸小。研究中还发现在相同条件下乏氧细胞释放的外泌体数量更多。国外近期也有乏氧促进细胞分泌外泌体的报道[12-13]。这种外泌体大小和数量的差异提示外泌体成分可能发生了变化。国内有学者发现肺癌H460细胞在接受不同剂量的辐射后所产生的外泌体大小也不尽相同[14]。本研究的发现与文献结果基本一致,同时也提示细胞在不同条件下培养所释放的外泌体可能携带不同的信号分子,但蛋白印迹实验显示两种外泌体的表面蛋白标记物CD63表达并无明显差别,这提示仅仅检测一个蛋白标志物可能在数量上是不够的。
直接内吞是外泌体进入受体细胞的常见方式,而受体细胞的类型和状态影响外泌体内吞过程。有研究证明外泌体通过内吞过程进入受体细胞的程度依赖于接收细胞的吞噬能力[15]。本研究采用PKH67免疫荧光染色外泌体,将两种外泌体分别和A549细胞共培养,通过定位实验观察细胞对外泌体的吞噬能力。结果显示H-EXO和N-EXO均可以迅速进入接收细胞,且外泌体更多地分布于细胞膜附近,这也提示外泌体可能通过膜融合的方式发挥后续功能。划痕实验和Transwell实验证实H-EXO较N-EXO更能增加A549细胞的迁移性和侵袭性,进一步通过对细胞侵袭性标志物之一的金属基质蛋白酶的表达量进行检测,证实H-EXO组细胞产生了更多的MMP2和MMP9。国外学者分别在1%和21%氧含量环境下培养前列腺癌LNCaP和PC3细胞,结果发现乏氧环境下培养的细胞侵袭性明显增强,且出现干细胞表达的特性,作者认为乏氧外泌体蛋白是促进细胞侵袭性增强、干细胞化的可能原因[16]。但更多的研究发现,外泌体miRNA在促进细胞增殖、转移、耐药中发挥重要作用[8, 17-19],但在乏氧条件下外泌体miRNA与放射抵抗之间的研究未见报道,这也是笔者在本研究后续的实验方向。
本实验通过克隆形成实验进一步证实,H-EXO加入到常氧A549细胞后,较N-EXO可以明显增强细胞对X射线的抵抗性。Yuan等[20]研究电离辐射旁效应中外泌体的功能时,发现接受X射线照射后细胞分泌的外泌体可以提高常规细胞放射抗性,本研究结果与此相似。其后续的研究认为细胞放射抗性的增加是通过外泌体miRNA调节的。源自高恶性的多形性胶质瘤(GBM)细胞的外泌体在缺氧条件下,可以通过刺激细胞因子和内皮细胞生长因子的产生诱导血管生成,从而促进周围细胞迁移[21]。此外,GBM患者来源的外泌体富含多种参与GBM发病机制的缺氧调节蛋白。这些观察结果表明,原发性肿瘤的缺氧微环境可能会显著影响外泌体的功能,发挥局部和全身作用。
综上,本研究表明乏氧环境下A549细胞释放的外泌体可以增强常氧细胞的侵袭性,并使其对放射的耐受性增强,结果提示乏氧外泌体直接将信号分子传递进受体细胞。但导致受体细胞放射抵抗性发生变化的乏氧细胞所分泌的外泌体的构成成分,尤其是RNA、蛋白质等引发生物学效应的信号分子需要进一步研究。
利益冲突 本研究还接受南京市科技发展计划项目(201715034)资助。本文作者与单位不存在与本工作职责相冲突的任何个人经济利益或非经济利益,以及任何直接或间接的义务和责任可能影响或潜在影响稿件的内容作者贡献声明 朱传东负责实验设计、细胞培养、外泌体收集、外泌体表征以及论文撰写;王礼学负责划痕实验、细胞克隆形成实验;王国相负责蛋白印迹实验;魏娟和张启佳负责细胞侵袭性实验、金属基质蛋白酶检测实验;徐瀚峰负责细胞放射增敏实验;童金龙负责放射操作;郑勤负责实验设计
| [1] |
Abels ER, Breakefield XO. Introduction to extracellular vesicles:biogenesis, RNA cargo selection, content, release, and uptake[J]. Cell Mol Neurobiol, 2016, 36(3): 301-312. DOI:10.1007/s10571-016-0366-z |
| [2] |
Thakur BK, Zhang H, Becker A, et al. Double-stranded DNA in exosomes:a novel biomarker in cancer detection[J]. Cell Res, 2014, 24(6): 766-769. DOI:10.1038/cr.2014.44 |
| [3] |
Raposo G, Stoorvogel W. Extracellular vesicles:exosomes, microvesicles, and friends[J]. J Cell Biol, 2013, 200(4): 373-383. DOI:10.1083/jcb.201211138 |
| [4] |
Cocucci E, Meldolesi J. Ectosomes and exosomes:shedding the confusion between extracellular vesicles[J]. Trends Cell Biol, 2015, 25(6): 364-372. DOI:10.1016/j.tcb.2015.01.004 |
| [5] |
Becker A, Thakur BK, Weiss JM, et al. Extracellular vesicles in cancer:cell-to-cell mediators of metastasis[J]. Cancer Cell, 2016, 30(6): 836-848. DOI:10.1016/j.ccell.2016.10.009 |
| [6] |
Kucharzewska P, Christianson HC, Welch JE, et al. Exosomes reflect the hypoxic status of glioma cells and mediate hypoxia-dependent activation of vascular cells during tumor development[J]. Proc Natl Acad Sci USA, 2013, 110(18): 7312-7317. DOI:10.1073/pnas.1220998110 |
| [7] |
Tadokoro H, Umezu T, Ohyashiki K, et al. Exosomes derived from hypoxic leukemia cells enhance tube formation in endothelial cells[J]. J Biol Chem, 2013, 288(48): 34343-34351. DOI:10.1074/jbc.M113.480822 |
| [8] |
Umezu T, Tadokoro H, Azuma K, et al. Exosomal miR-135b shed from hypoxic multiple myeloma cells enhances angiogenesis by targeting factor-inhibiting HIF-1[J]. Blood, 2014, 124(25): 3748-3757. DOI:10.1182/blood-2014-05-576116 |
| [9] |
Costa-Silva B, Aiello NM, Ocean AJ, et al. Pancreatic cancer exosomes initiate pre-metastatic niche formation in the liver[J]. Nat Cell Biol, 2015, 17(6): 816-826. DOI:10.1038/ncb3169 |
| [10] |
Melo SA, Sugimoto H, O'Connell JT, et al. Cancer exosomes perform cell-independent microRNA biogenesis and promote tumorigenesis[J]. Cancer Cell, 2014, 26(5): 707-721. DOI:10.1016/j.ccell.2014.09.005 |
| [11] |
King HW, Michael MZ, Gleadle JM. Hypoxic enhancement of exosome release by breast cancer cells[J]. BMC Cancer, 2012, 12: 421. DOI:10.1186/1471-2407-12-421 |
| [12] |
Orriss IR, Knight GE, Utting JC, et al. Hypoxia stimulates vesicular ATP release from rat osteoblasts[J]. J Cell Physiol, 2009, 220(1): 155-162. DOI:10.1002/jcp.21745 |
| [13] |
Wysoczynski M, Ratajczak MZ. Lung cancer secreted microvesicles:underappreciated modulators of microenvironment in expanding tumors[J]. Int J Cancer, 2009, 125(7): 1595-1603. DOI:10.1002/ijc.24479 |
| [14] |
陈纤, 蒋友芹, 尹晓明, 等. 外泌体-电离辐射诱导旁效应的另一种机制[J]. 辐射研究与辐射工艺学报, 2014, 32(3): 24-30. Chen X, Jiang YQ, Yin XM, et al. Exosomes-another underlying mechanism of radiation-induced bystander effects[J]. J Rad Res Rad Proc, 2014, 32(3): 24-30. DOI:10.11889/j.1000-3436.2014.rrj.32.030203 |
| [15] |
Feng D, Zhao WL, Ye YY, et al. Cellular internalization of exosomes occurs through phagocytosis[J]. Traffic, 2010, 11(5): 675-687. DOI:10.1111/j.1600-0854.2010.01041.x |
| [16] |
Ramteke A, Ting H, Agarwal C, et al. Exosomes secreted under hypoxia enhance invasiveness and stemness of prostate cancer cells by targeting adherens junction molecules[J]. Mol Carcinog, 2015, 54(7): 554-565. DOI:10.1002/mc.22124 |
| [17] |
Chen C, Luo F, Liu X, et al. NF-κB-regulated exosomal miR-155 promotes the inflammation associated with arsenite carcinogenesis[J]. Cancer Lett, 2017, 388: 21-33. DOI:10.1016/j.canlet.2016.11.027 |
| [18] |
Sakha S, Muramatsu T, Ueda K, et al. Exosomal microRNA miR-1246 induces cell motility and invasion through the regulation of DENND2D in oral squamous cell carcinoma[J]. Sci Rep, 2016, 6: 38750. DOI:10.1038/srep38750 |
| [19] |
Tomasetti M, Lee W, Santarelli L, et al. Exosome-derived microRNAs in cancer metabolism:possible implications in cancer diagnostics and therapy[J]. Exp Mol Med, 2017, 49(1): e285. DOI:10.1038/emm.2016.153 |
| [20] |
Yuan D, Xu J, Wang J, et al. Extracellular miR-1246 promotes lung cancer cell proliferation and enhances radioresistance by directly targeting DR5[J]. Oncotarget, 2016, 7(22): 32707-32722. DOI:10.18632/oncotarget.9017 |
| [21] |
Kucharzewska P, Christianson HC, Welch JE, et al. Exosomes reflect the hypoxic status of glioma cells and mediate hypoxia-dependent activation of vascular cells during tumor development[J]. Proc Natl Acad Sci USA, 2013, 110(18): 7312-7317. DOI:10.1073/pnas.1220998110 |
 2018, Vol. 38
2018, Vol. 38


