2. 475000 开封, 河南大学淮河医院放疗科
2. Department of Radiotherapy, Huaihe Hospital of Henan University, Kaifeng 475000, China
舌鳞癌是一种口腔鳞癌,是常见的恶性肿瘤之一,能够通过淋巴管或者是微血管向周围组织中转移[1]。舌鳞癌常见的治疗方法为手术治疗、放疗及化疗,这些治疗方法取得了一定的成效,但仍然不能满足需求。放疗对肿瘤细胞具有杀伤力,同时也会损害周围正常的细胞,因此,放疗剂量受到正常组织的限制,同时还会增加并发症和后遗症的发生概率[2]。提高肿瘤放射敏感性是放射治疗追求的目标。zeste基因增强子同源物2(enhancer of zeste homolog 2,EZH2)是一种与果蝇zeste增强子同源的基因,与肿瘤的发生有关[3]。近年来的研究表明,EZH2在舌鳞癌、食管鳞癌、肝癌、乳腺癌等癌症中过度表达,并且与肿瘤的恶性程度有关[4-6]。下调EZH2表达后的食管鳞癌、舌鳞癌、乳腺癌、胶质母细胞瘤等癌细胞的生长受到抑制,凋亡数目增加,肿瘤细胞的裸鼠成瘤能力下降[7]。本研究以舌鳞癌细胞为研究对象,通过小干扰RNA技术下调细胞中EZH2的表达,探讨下调EZH2对舌鳞癌细胞放射敏感性的影响,以期为靶向EZH2提高舌鳞癌细胞放射敏感性提供理论基础。
材料与方法1.材料:Tca-8113细胞购自于中科院细胞库;EZH2小干扰RNA(EZH2 siRNA1、EZH2 siRNA2)及小干扰RNA阴性对照(siRNA对照组)均为美国Cell Signaling公司产品;胰蛋白酶、青霉素、链霉素、胎牛血清、RPMI 1640均为美国GIBCO公司产品;甘油醛-3-磷酸脱氢酶(GAPDH)、EZH2引物均由上海生物制品研究所合成;二喹啉甲酸(BCA)蛋白浓度检测试剂盒、反转录试剂盒均为大连TaKaRa公司产品;Real\|time PCR试剂盒、蛋白提取试剂盒、RNA提取试剂盒均为上海吉玛公司产品;兔抗EZH2多克隆抗体为美国Invitrogen公司产品;兔抗磷酸化的STAT3(p-STAT3)单克隆抗体、兔抗信号转导与转录因子3(STAT3)单克隆抗体为美国SAB公司产品;兔抗活化的含半胱氨酸的天冬氨酸蛋白水解酶3(Cleaved Caspase-3)单克隆抗体为美国Cell Signaling公司产品。
2.细胞培养:Tca-8113细胞培养用含有1%的青霉素和链霉素、10%胎牛血清的pH=7.2的RPMI 1640细胞培养液培养。培养于37℃、5% CO2培养箱,观察细胞密度达到80%时,弃细胞培养液,用PBS洗涤2次细胞后,加入3 ml的0.25%的胰蛋白酶消化液,在37℃消化1 min,加入2 ml的细胞培养液终止消化,离心半径10 cm, 1 000 r/min离心10 min,弃上清,用5 ml的细胞培养液悬浮细胞后,以1:2的比例接种到细胞培养瓶中继续培养。
3.细胞转染:Tca-8113细胞培养至对数期后,以106/ml种植于6孔细胞培养板中,每孔加入1 ml的细胞悬浮液,观察细胞融合度超过60%时,进行细胞转染。转染步骤参照Lip2000转染试剂说明书。依次把EZH2小干扰RNA(EZH2 siRNA1、EZH2 siRNA2)及小干扰RNA阴性对照(siRNA对照组)转染至细胞中,命名为:EZH2 siRNA1组、EZH2 siRNA2组、siRNA-NC组,同时把没有转染的细胞作为对照组。每个组设置3个复孔。
4.RT-PCR检测转染后细胞中EZH2表达水平:取转染后48 h的对照组、siRNA-NC组、EZH2 siRNA1组和EZH2 siRNA2组细胞,按照RNA提取试剂盒提取细胞中的RNA。根据反转录试剂盒合成EZH2 cDNA,用Real-time PCR试剂盒检测EZH2表达水平。GAPDH正向引物为5′CGCTGAGTACGTCGTGGAGTC 3′,反向引物5′GCTGATGATCTTGAGGCTGTTGTC 3′。EZH2正向引物为5′CGCTTTTCTGTAGGCGATGT 3′,反向引物5′TGGGTGTTGCATGGAA 3′。反应程序为:95℃预变性5 min,1个循环;95℃ 15 s,60℃ 60 s,40个循环。反应结束后得到目的基因和内参基因GAPDH的Ct值,2-ΔΔCt法分析ANXA2水平。
5.Western blot检测转染后细胞中EZH2表达水平:取转染后48 h的对照组、siRNA-NC组、EZH2 siRNA1组和EZH2 siRNA2组细胞,加入1 ml的裂解液,冰上裂解30 min后,4℃,离心半径10 cm, 12 000 r/min离心10 min,用BCA蛋白浓度检测试剂盒检测蛋白样品浓度。将蛋白样品与2×Loading buffer煮沸5 min,10%分离胶和5%的浓缩胶进行电泳,每孔加入30 μg变性蛋白样品,在浓缩胶中用90 V电泳,在分离胶中用120 V电泳。100 V恒压转膜70 min,5%的牛血清白蛋白室温封闭2 h,依次与1:1 000稀释的一抗在4℃孵育过夜后,与1:2 000倍稀释的二抗室温孵育90 min,显色后,以GAPDH为内参,Image J分析蛋白表达水平。
6.四甲基偶氮唑盐(MTT)检测细胞增殖:取siRNA-NC组、EZH2 siRNA2组细胞以每孔接种3 000细胞种植到96孔细胞培养板中,经过8 Gy放射处理后记为照射组和联合组,照射方法为:能量为1.25 MeV γ射线,细胞和照射源的距离为80 cm,吸收剂量率为1.61×10-1Gy/min。照射处理后,培养24、48、72、96 h,每孔中加入20 μl的MTT溶液,在37℃孵育4 h后,弃上清液,加入二甲基亚砜溶液150 μl,观察结晶物融化后,检测490 nm的吸光度(A)值。同时检测siRNA-NC组、EZH2 siRNA2组细胞不经放射处理的A值。每组设置6个复孔,实验重复3次,取均值。
7.流式细胞术检测细胞凋亡:按照方法6处理siRNA-NC组、照射组、EZH2 siRNA2组、联合组细胞,培养48 h后,收集106细胞,用冰预冷的PBS重悬细胞2次,加入500 μl的Binding buffer混合后,依次加入5 μl的膜联蛋白V-FITC(Annexin V-FITC)和碘化丙啶(PI),避光反应5 min。流式细胞仪检测细胞凋亡情况。
8.细胞克隆实验:siRNA-NC组、EZH2 siRNA2组细胞培养至对数期后,分别用0、2、4、6、8 Gy γ射线处理后,培养12 d,吸除培养液,用甲醇固定20 min后,干燥,用1%的结晶紫染色,洗涤后,干燥,在光学显微镜下计数观察>50个的细胞克隆数目,计算细胞克隆形成率。拟合细胞存活曲线。根据单击多靶模型参数值计算放射增敏比。克隆形成率(%)=克隆数/接种细胞数×100%;存活分数=受照射细胞克隆形成率/对照细胞克隆形成率×100%。
9.Western blot检测p-STAT3、STAT3、Cleaved Caspase-3水平:按照方法6处理siRNA-NC组、照射组、EZH2 siRNA2组、联合组细胞后,培养48 h,提取细胞蛋白,Western blot检测p-STAT3、STAT3、Cleaved Caspase-3表达水平,步骤参照5。
10.统计学处理:所有实验重复3次,取均值。采用SPSS 22.0统计软件分析。数据符合正态分布,以x±s表示。两组数据比较用独立样本t检验。P < 0.05为差异有统计学意义。
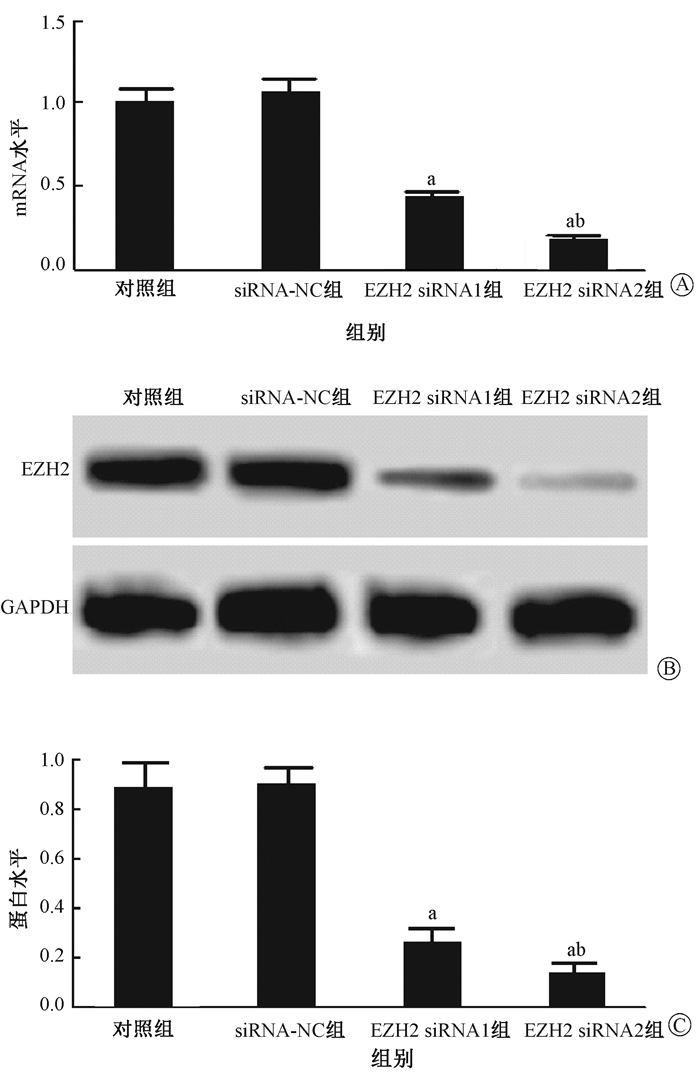
结果1.转染后细胞中EZH2表达检测结果:结果见图 1和表 1。对照组、siRNA-NC组、EZH2 siRNA1组和EZH2 siRNA2组EZH2 mRNA水平依次为:1.00±0.09、1.06±0.16、0.43±0.04、0.18±0.03,EZH2蛋白水平依次为:0.88±0.11、0.90±0.07、0.26±0.06、0.13±0.05。细胞转染EZH2 siRNA1、EZH2 siRNA2后细胞中EZH2 mRNA和蛋白表达均受到抑制作用,并且EZH2 siRNA2干扰作用更强,后续选用EZH2 siRNA2组细胞继续研究。
|
图 1 Western blot检测转染后细胞中EZH2表达 A.EZH2 mRNA水平;B.Western blot检测EZH2水平;C.EZH2蛋白水平 注:a与对照组相比,tmRNA=9.859、13.583,P < 0.001;t蛋白=8.570、10.751,P < 0.05;b与EZH2 siRNA1组相比,tmRNA=8.660,P < sub>mRNA < 0.01;t蛋白=2.883,P蛋白 < 0.05 Figure 1 The expressions of EZH2 mRNA and protein in cells after siRNA transfection A. EZH2 mRNA expression in cells; B. EZH2 protein bands detected by Western blot; C. Relative protein level of EZH2 in cells |
|
|
表 1 细胞转染后不同时间点的A值比较(x±s) Table 1 Cell proliferation levels (A values) at different time points after different treatments(x±s) |
2.细胞增殖检测结果:结果见表 1中所示。干扰EZH2表达能够抑制舌鳞癌细胞增殖,并且对射线抑制舌鳞癌细胞增殖作用具有协同效应。
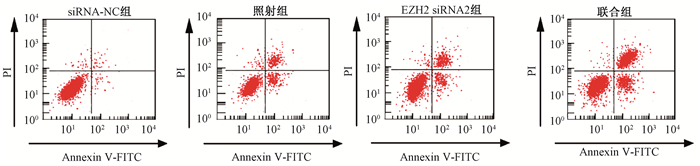
3.细胞凋亡检测结果:结果如图 2所示,siRNA-NC组、照射组、EZH2 siRNA2组、联合组细胞凋亡率依次为(6.99±1.63)%、(25.13±4.49)%、(29.90±1.64)%、(38.17±1.59)%。与siRNA-NC组相比,差异有统计学意义(t=6.578、17.161、23.717,P < 0.05)。联合组与照射组相比,差异有统计学意义(t=4.742,P < 0.05)。干扰EZH2表达不仅能够促进舌鳞癌细胞凋亡而且能够协同放射促进舌鳞癌细胞凋亡。
|
图 2 各组细胞凋亡检测结果 Figure 2 Cell apoptosis after different treatments |
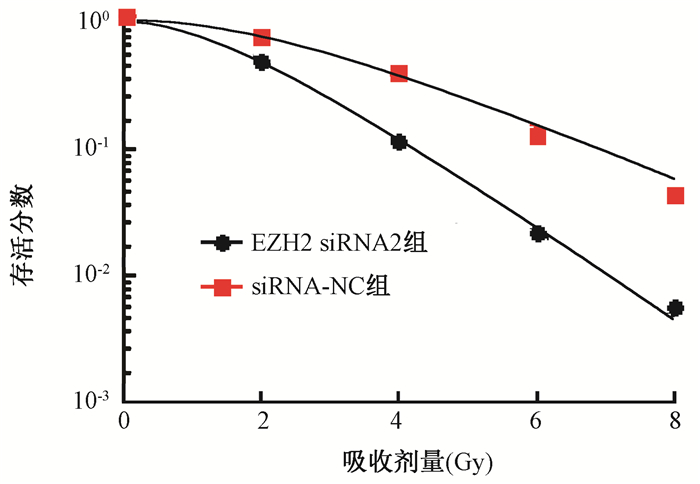
4.放射敏感性检测结果:结果如图 3和表 2所示,干扰EZH2表达能够增加细胞放射敏感性,辐射增敏比为1.668。
|
图 3 干扰EZH2后经不同剂量照射处理的细胞存活曲线 Figure 3 Survival curves of Tca-8113 cells after EZH2 interference |
|
|
表 2 单击多靶模型参数值 Table 2 The parameter values of survive curves fitted with the multi-target model |
5.Western blot检测p-STAT3、STAT3、Cleaved Caspase-3水平:结果见图 4中所示。下调EZH2表达或者照射均能够抑制细胞中p-STAT3表达,促进细胞中Cleaved Caspase-3表达。干扰EZH2表达能够协同照射抑制舌鳞癌细胞中p-STAT3表达,促进舌鳞癌细胞中Cleaved Caspase-3表达。

|
图 4 不同处理前后细胞中p-STAT3、STAT3、Cleaved Caspase-3蛋白的表达 A. Western blot检测;B.蛋白表达半定量分析 注:a与siRNA-NC组相比,t=4.677、6.355、9.876、8.834、8.807、10.644,P < 0.05;b与照射组相比,t=5.765、3.311,P < 0.05 Figure 4 Expression of p-STAT3, STAT3 and Cleaved Caspase-3 in Tca-8113 cells with different treatments A. Western blot assay; B. Semi-quantitative analysis of protein expressions |
讨论
舌鳞癌的发生受到多种基因的共同调控作用,其中癌基因和抑癌基因的激活和转录、细胞内信号转导过程、表观遗传学等均参与癌症的发生[8-9]。PcG(polycomb group)是表观遗传学中高度保守的多基因家族,含有多个致癌基因,在细胞分化、胚胎发育过程中均具有调控作用[10]。EZH2是PcG的核心成员之一,在多种原发性的肿瘤中表达[11]。后续的研究表明,EZH2在前列腺癌、肝癌等癌症组织中高度表达,可以作为潜在的预后指标[12]。Kidani等[13]研究表明,EZH2在舌黏膜和舌鳞癌组织中的阳性表达率依次为20%和77%,并且与舌鳞癌的预后、恶性程度等有关。魏秀娟等[14]通过siRNA干扰舌鳞癌细胞中EZH2表达发现,下调EZH2表达后舌鳞癌细胞的侵袭、迁移、增殖能力均下降,细胞凋亡增加。本研究同之前的研究报道相符,均说明下调EZH2表达能够促进舌鳞癌细胞凋亡,抑制舌鳞癌细胞增殖。
提高癌细胞放射敏感性一直是研究的热点也是难点,EZH2能够影响癌症的放射敏感性。徐望和季平[15]研究表明,下调EZH2表达能够增加Hut78和Jurkat细胞对放射处理的敏感性,促进放射治疗诱导的细胞凋亡,提示EZH2可能影响肿瘤细胞的放射敏感性。本研究发现,下调EZH2表达后的舌鳞癌细胞经过射线处理后的细胞增殖较单纯照射后下降更多,凋亡较单纯照射后增加更多。提示下调EZH2表达能够协同照射抑制舌鳞癌细胞生长,促进舌鳞癌细胞凋亡。同时,本研究还发现,下调EZH2表达后的舌鳞癌细胞放射敏感性增加。
癌细胞的生长和凋亡与细胞内多种信号通路和蛋白的表达有关。Caspase-3是Caspase蛋白家族成员之一,在Caspase级联反应中发挥凋亡执行的作用,是目前研究较多的能够促进细胞凋亡发生的蛋白之一[16-17]。正常情况下,Caspase-3以酶原的形式存在,其活化后形成Cleaved Caspase-3发挥凋亡促进作用[18]。STAT3信号通路在生命机体内广泛存在,能够调控细胞生长和凋亡,与多种疾病的发生有关[19]。有研究表明,STAT3信号通路在肿瘤中过度活化,而抑制STAT3磷酸化后,肿瘤的生长受到阻碍[20-21]。本研究结果显示,单纯下调EZH2或者是单纯照射后的舌鳞癌细胞中Cleaved Caspase-3水平均升高,STAT3磷酸化水平均降低,并且二者联合后Cleaved Caspase-3升高更多,STAT3磷酸化水平下降也最多。这提示,下调EZH2可能通过作用于STAT3信号通路协同照射促进舌鳞癌细胞凋亡,提高舌鳞癌细胞放射敏感性。
综上所述,下调EZH2能够增加舌鳞癌细胞放射敏感性,促进放射诱导的舌鳞癌细胞凋亡。本研究为后续进一步探讨EZH2在舌鳞癌细胞中的作用奠定了基础,为提高舌鳞癌放射敏感性提供了新思路。本研究也存在一定的局限性,只在体外对EZH2在舌鳞癌放射敏感性中的作用做了初步探讨,后续实验中会对其具体的作用机制做深入的研究。
利益冲突 无作者贡献声明 方政负责实验和论文撰写;袁惠芳、李新明、孙强协助完成实验;赵军方参与研究设计与指导,提出修改意见;孙明磊、乔彬、吴大鹏负责数据统计
| [1] |
Gillison ML, Chaturvedi AK, Anderson WF, et al. Epidemiology of human papillomavirus-positive head and neck squamous cell carcinoma[J]. J Clin Oncol, 2015, 33(29): 3235-3242. DOI:10.1200/JCO.2015.61.6995 |
| [2] |
Herman MP, Dagan R, Amdur RJ, et al. Postoperative radiotherapy for patients at high risk of recurrence of oral cavity squamous cell carcinoma[J]. Laryngoscope, 2015, 125(3): 630-635. DOI:10.1002/lary.24938 |
| [3] |
Yang WS, Chadalapaka G, Cho SG, et al. The transcriptional repressor ZBTB4 regulates EZH2 through a MicroRNA-ZBTB4-specificity protein signaling axis[J]. Neoplasia, 2014, 16(12): 1059-1069. DOI:10.1016/j.neo.2014.09.011 |
| [4] |
Wu Y, Zhang L, Zhang L, et al. Long non-coding RNA HOTAIR promotes tumor cell invasion and metastasis by recruiting EZH2 and repressing E-cadherin in oral squamous cell carcinoma[J]. Int J Oncol, 2015, 46(6): 2586-2594. DOI:10.3892/ijo.2015.2976 |
| [5] |
Liu F, Gu L, Cao Y, et al. Aberrant overexpression of EZH2 and H3K27me3 serves as poor prognostic biomarker for esophageal squamous cell carcinoma patients[J]. Biomarkers, 2016, 21(1): 80-90. DOI:10.3109/1354750X.2015.1118537 |
| [6] |
Sudo T, Utsunomiya T, Mimori K, et al. Clinicopathological significance of EZH2 mRNA expression in patients with hepatocellular carcinoma[J]. Br J Cancer, 2005, 92(9): 1754-1758. DOI:10.1038/sj.bjc.6602531 |
| [7] |
Kim E, Kim M, Woo DH, et al. Phosphorylation of EZH2 activates STAT3 signaling via STAT3 methylation and promotes tumorigenicity of glioblastoma stem-like cells[J]. Cancer Cell, 2013, 23(6): 839-852. DOI:10.1016/j.ccr.2013.04.008 |
| [8] |
Lingen MW, Xiao W, Schmitt A, et al. Low etiologic fraction for high-risk human papillomavirus in oral cavity squamous cell carcinomas[J]. Oral Oncol, 2013, 49(1): 1-8. DOI:10.1016/j.oraloncology.2012.07.002 |
| [9] |
Lee AY, Fan CC, Chen YA, et al. Curcumin inhibits invasiveness and epithelial-mesenchymal transition in oral squamous cell carcinoma through reducing matrix metalloproteinase 2, 9 and modulating p53-E-cadherin pathway[J]. Integr Cancer Ther, 2015, 14(5): 484-490. DOI:10.1177/1534735415588930 |
| [10] |
Zhang Y, Liu G, Lin C, et al. Silencing the EZH2 gene by RNA interference reverses the drug resistance of human hepatic multidrug-resistant cancer cells to 5-Fu[J]. Life Sci, 2013, 92(17-19): 896-902. DOI:10.1016/j.lfs.2013.03.010 |
| [11] |
Svedlund J, Barazeghi E, Stålberg P, et al. The histone methyltransferase EZH2, an oncogene common to benign and malignant parathyroid tumors[J]. Endocr Relat Cancer, 2014, 21(2): 231-239. DOI:10.1530/ERC-13-0497 |
| [12] |
Bachmann IM, Halvorsen OJ, Collett K, et al. EZH2 expression is associated with high proliferation rate and aggressive tumor subgroups in cutaneous melanoma and cancers of the endometrium, prostate, and breast[J]. J Clin Oncol, 2006, 24(2): 268-273. DOI:10.1200/JCO.2005.01.5180 |
| [13] |
Kidani K, Osaki M, Tamura T, et al. High expression of EZH2 is associated with tumor proliferation and prognosis in human oral squamous cell carcinomas[J]. Oral Oncol, 2009, 45(1): 39-46. DOI:10.1016/j.oraloncology.2008.03.016 |
| [14] |
魏秀娟, 吴修胤, 佟冬冬, 等. BDNF/TrkB在舌鳞状细胞癌中的表达及BDNF对其增殖能力的影响[J]. 山东大学学报(医学版), 2016, 54(6): 50-54. Wei XJ, Wu XY, Tong DD, et al. Expression of BDNF/TrkB and effect of BDNF on the proliferation ability of tongue squamous cell carcinoma[J]. J Shandong Univ (Health Sciences), 2016, 54(6): 50-54. DOI:10.6040/j.issn.1671-7554.0.2015.1222 |
| [15] |
徐望, 季平. 5-氟尿嘧啶对人舌鳞癌Tca8113中肿瘤干细胞的富集作用[J]. 中国组织工程研究, 2015, 19(10): 1482-1487. Xu W, Ji P. 5-Fluorouracil enriches cancer stem cells in tongue squamous cell carcinoma Tca8113[J]. J Clin Rehabil Tis Eng Res, 2015, 19(10): 1482-1487. DOI:10.3969/j.issn.2095-4344.2015.10.002 |
| [16] |
Silva KA, Dong J, Dong Y, et al. Inhibition of Stat3 activation suppresses caspase-3 and the ubiquitin-proteasome system, leading to preservation of muscle mass in cancer cachexia[J]. J Biol Chem, 2015, 290(17): 11177-11187. DOI:10.1074/jbc.M115.641514 |
| [17] |
Okada K, Hakata S, Terashima J, et al. Combination of the histone deacetylase inhibitor depsipeptide and 5-fluorouracil upregulates major histocompatibility complex class Ⅱ and p21 genes and activates caspase-3/7 in human colon cancer HCT-116 cells[J]. Oncol Rep, 2016, 36(4): 1875-1885. DOI:10.3892/or.2016.5008 |
| [18] |
Yu H, Lee H, Herrmann A, et al. Revisiting STAT3 signalling in cancer:new and unexpected biological functions[J]. Nat Rev Cancer, 2014, 14(11): 736-746. DOI:10.1038/nrc3818 |
| [19] |
Siveen KS, Sikka S, Surana R, et al. Targeting the STAT3 signaling pathway in cancer:role of synthetic and natural inhibitors[J]. Biochim Biophys Acta, 2014, 1845(2): 136-154. DOI:10.1016/j.bbcan.2013.12.005 |
| [20] |
Chung SS, Giehl N, Wu Y, et al. STAT3 activation in HER2-overexpressing breast cancer promotes epithelial-mesenchymal transition and cancer stem cell traits[J]. Int J Oncol, 2014, 44(2): 403-411. DOI:10.3892/ijo.2013.2195 |
| [21] |
Sanchez-Lopez E, Flashner-Abramson E, Shalapour S, et al. Targeting colorectal cancer via its microenvironment by inhibiting IGF-1 receptor-insulin receptor substrate and STAT3 signaling[J]. Oncogene, 2016, 35(20): 2634-2644. DOI:10.1038/onc.2015.326 |
 2018, Vol. 38
2018, Vol. 38


