2. 010050 呼和浩特, 内蒙古医科大学附属医院放疗科
2. Department of Radiotherapy, Affiliated Hospital of Inner Mongolia Medical University, Hohhot 010050, China
宫颈癌是常见的女性恶性肿瘤之一,居于女性恶性肿瘤的第2位,严重威胁女性生命健康[1]。随着医学技术的进步,宫颈癌患者的预后已有明显改善,但是仍不能令人满意。同时,越来越多的研究发现,同一期别恶性肿瘤的不同个体对于放化疗治疗的敏感性具有明显差异,因此,寻找对治疗敏感的特异性生物治疗指标成为一个亟待解决的问题[2]。PBK(PDZ binding kinase)是DNA损伤修复因子,研究证实其在宫颈癌中呈阳性表达,并与宫颈癌的分期、肿瘤的浸润程度和淋巴结转移密切相关[3-5],而MMP-9(matrix metalloproteinase 9)是基质金属蛋白酶家族的重要因子之一,其在宫颈癌的侵袭及转移中具有重要作用[6-9]。目前研究表明,PBK能够促进恶性肿瘤的侵袭和转移,但是其机制尚未明确。因此,本研究拟通过检测宫颈癌中PBK和MMP-9的表达情况,探讨PBK联合MMP-9检测是否能够评价宫颈癌患者同步放化疗疗效。
资料与方法1.研究对象:收集2014年1月至2016年7月在内蒙古医科大学附属医院放疗科完成根治性同步放化疗且随访资料完整的65例宫颈癌患者的病理标本。患者确诊宫颈癌年龄33~81岁,中位年龄56岁。根据国际妇产科学联盟(FIGO)分期,ⅡA期12例,ⅡB期19例,ⅢA期16例,ⅢB期18例。
2.同步放化疗方法及疗效评价
(1) 放射治疗方法:包括体外照射+腔内后装治疗,其中外照射采用调强放射治疗,CT模拟机定位,DT 50 Gy/25次;外照射18次后予以高剂量率后装治疗,30~36Gy/5~6次,3~4周,A点剂量90~98 Gy(2 Gy分次等效放射剂量)。
(2) 化疗方法:外照射开始后给予每周化疗,采用单药顺铂方案,顺铂(DDP) 40 mg/m2静脉滴注,2~6周。
(3) 治疗结果随访:对放疗后1个月的患者按照实体瘤疗效评价标准(RECIST) 1.1进行疗效评价。完全缓解(CR)、部分缓解(PR)、疾病进展(PD)和疾病稳定(SD)。
3.实验方法及结果判定
(1) 免疫组织化学法:病理标本为活检组织,切片执行脱蜡与水化之后,置入3%过氧化氢溶液中,室温孵育10 min;抗原修复10 min;执行一抗,4℃过夜;执行二抗,常温孵育30 min,进行二氨基连苯胺(DBA)溶液显色,复染,脱水透明封片,光镜下仔细获取结果。
(2) 结果判定:PBK和MMP-9蛋白呈棕黄色颗粒;依照着色细胞构成比进行计分,切片均取高倍视野10个,每个视野计数100个肿瘤细胞,阳性细胞构成比0~5%为0分,5%~25%为1分,25%~50%为2分,50%~75%为3分,75%以上为4分。按着色强度计分,深褐色颗粒为3分,棕黄色颗粒为2分,淡黄色颗粒为1分,无着色为0分,将阳性细胞构成比计分与着色强度计分相乘,通过统计学进行阈值区分PBK和MMP-9联合高表达组和联合低表达组,由2名高年资病理科医师双盲独立检测。
4.统计学处理:利用受试者最佳曲线(ROC)的曲线下面积(AUC),选择拟然比最高点作为区分蛋白表达高低的阈值(cut-off value)[10]。选取7分为PBK区分蛋白表达高低的阈值,选取6分为MMP-9区分蛋白表达高低的阈值。利用SPSS 22.0软件进行分析,单因素分析采用Kaplan-Meier法计算生存率,组间比较采用Log-rank法。P < 0.05为差异有统计学意义。
结果1.总体生存情况:截止2016年11月5日,随访率100%,患者中位随访时间为18个月,65例患者中,1例患者出现局部复发,13例患者出现远处转移,其中11例患者死亡。
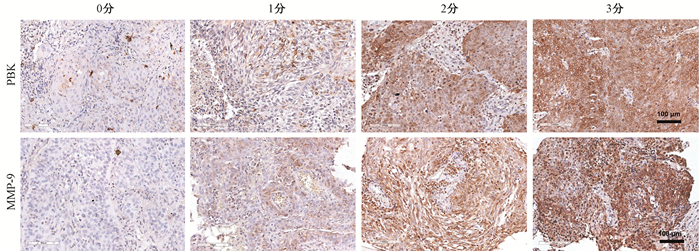
2. PBK和MMP-9在宫颈癌中表达情况与其临床特征之间的关系:PBK和MMP-9在宫颈癌组织中均为细胞质阳性表达,呈棕黄色颗粒(图 1)。对65例宫颈癌患者的病理标本检测PBK,结果显示阳性表达率为92.3%。MMP-9在65例宫颈癌组织中的阳性表达率为69.2%。本研究发现,PBK高表达与宫颈癌的临床分期相关(P < 0.05),与病理分化程度、年龄分组、后续放化疗无关(P>0.05),而MMP-9高表达证实与宫颈癌的临床分期、病理分化程度、年龄分组与后续放化疗无关(P>0.05), 见表 1。
|
图 1 PBK和MMP-9在宫颈癌组织中的表达水平 免疫组织化学染色×200 Figure 1 The expression of PBK and MMP-9 in cervical cancer Immunohistochemical staining ×200 |
|
|
表 1 PBK和MMP-9在宫颈癌组织中表达情况与患者临床特征的关系 Table 1 The relationship between patients clinical characters and PBK and MMP expression in cervical cancer tissue |
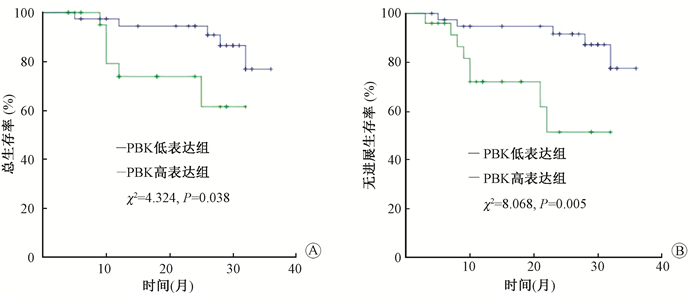
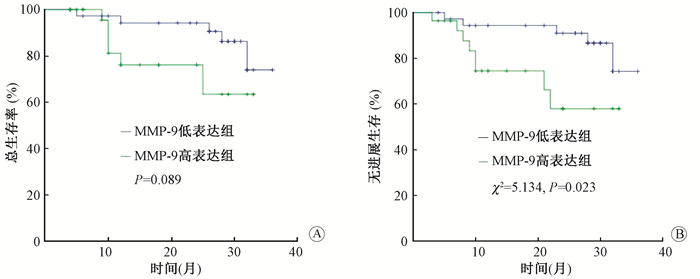
3. PBK和MMP-9与宫颈癌患者预后之间的关系:结果示于图 2,3。由图 2可见,高表达PBK组的宫颈癌患者OS、PFS均明显低于PBK表达低的患者(χ2=4.324、8.068,P < 0.05)。对于MMP-9在宫颈癌组织中的表达研究,由图 3可见,高表达MMP-9组的宫颈癌患者,PFS明显低于低表达组(χ2=5.134,P < 0.05),两组OS差异无统计学意义(P>0.05)。
|
图 2 PBK表达与宫颈癌预后的相关性 A.总生存率;B.无进展生存率 Figure 2 The relationship between PBK expression and prognosis of cervical cancer A. Overall survival; B. Progress free survival |
|
图 3 MMP-9表达与宫颈癌预后之间的关系 A.总生存率;B.无进展生存率 Figure 3 The relationship between MMP-9 expression and prognosis of cervical cancer A. Overall survival; B. Progress free survival |
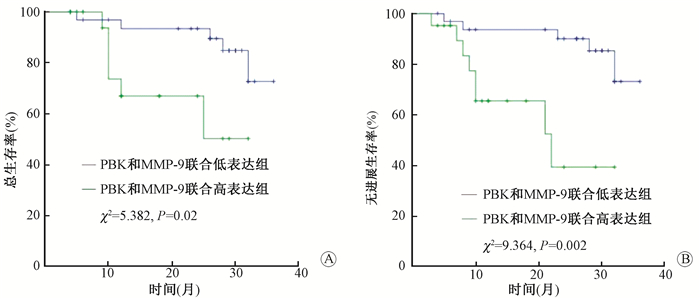
4. PBK和MMP-9联合表达与宫颈癌患者预后之间的关系:结果示于图 4。由图 4可见,PBK和MMP-9在宫颈癌组织中的表达均升高,按照表达程度不同,分为PBK和MMP-9联合高表达组和联合低表达组,统计分析显示,联合高表达组的OS和PFS比联合低表达组的低(χ2=5.382、9.364,P < 0.05)。
|
图 4 PBK和MMP-9联合检测与宫颈癌预后之间的关系 A.总生存率;B.无进展生存率 Figure 4 The relationship between PBK and MMP-9 combination detection and prognosis of cervical cancer A.Overall survival; B. Progress free survival |
讨论
宫颈癌是一类常见的女性生殖系统恶性肿瘤,其发病率和死亡率较高[1-2],尽管目前对于宫颈癌患者提倡进行同步放化疗的个体化治疗,但是患者预后仍不尽人意[3]。因此,对于寻找宫颈癌临床诊断、治疗及预后的分析标志物成为亟待解决的问题。
PBK是一类DNA损伤修复因子,为MAPPK家族成员。研究发现,多种恶性肿瘤中PBK均呈不同程度的表达[4]。在非霍奇金淋巴瘤的研究中发现,PBK在侵袭性淋巴瘤中表达显著高于惰性淋巴瘤,提示PBK与非霍奇金淋巴瘤的恶性进展相关[5]。肺癌研究证实,PBK在肺癌组织中高表达,通过统计分析发现,119例肺癌患者的预后与PBK相关,PBK高表达的患者预后差,肿瘤复发率高,提示PBK是肺癌预后的预测因子[6]。此外,肺癌研究证实PBK可以通过影响PTEN/AKT通路促进恶性肿瘤细胞侵袭和迁移[6],在结直肠癌研究中发现PBK通过调控ERK通路促进恶性肿瘤细胞侵袭和迁移[7]。
基质金属蛋白酶(MMP)属于锌依赖性内肽酶家族,其主要功能是降解细胞外基质,维持细胞外基质的动态平衡。在组织重构、器官发生、炎症调控和肿瘤等多种生理和病理过程中发挥作用[8-9]。属于明胶类的MMP-9相对分子质量为92 000,具有13个外显子和9个内含子,因参与肿瘤基底膜的降解,在肿瘤的转移起到重要作用[11]。研究表明,头颈部肿瘤中,MMP-9高表达能够促进肿瘤的恶性转移[12]。在胃癌组织中MMP-9的表达率明显较正常组织表达高,且其高表达与胃癌的发生、侵袭、淋巴转移、分期和5年生存率相关[13]。在结直肠癌中MMP-9亦广泛表达,被认为可以作为结直肠癌干预和治疗的靶标[14]。在非小细胞肺癌的研究中,MMP-9过表达的非小细胞肺癌预后不良,其亚型分析也检测到明显的相关性[15]。在女性恶性肿瘤的研究中报道,MMP-9与女性肿瘤包括乳腺癌和卵巢癌明显相关[16-17]。在宫颈癌中,宫颈鳞癌相比慢性宫颈炎和宫颈上皮内瘤变的MMP-9表达阳性率明显升高,差异有显著性意义,并且研究证实在宫颈鳞癌的发展、侵袭和转移过程中MMP-9发挥了一定作用[18-19]。
本研究通过联合检测PBK和MMP-9在宫颈癌组织中的表达,发现在65例患者中PBK的阳性表达率为92.3%,MMP-9的阳性表达率为69.2%,与张伟[20]和安风仙等[21]报告的宫颈癌MMP-9表达率基本一致。同时发现,PBK高表达组患者的OS和PFS均低于低表达组,尽管目前尚未见到关于PBK和宫颈癌预后的相关报道,但是在非小细胞肺癌和乳腺癌的预后研究中发现PBK高表达提示患者预后差[22-23],然而在口腔癌的研究中则显示PBK高表达患者的生存期延长[24],说明PBK因子在不同的恶性肿瘤中可能发挥不同的效应,尚需要进一步深入研究。另外还发现,在本研究中MMP-9的表达与患者OS无关,但是高表达MMP-9组患者的PFS与低表达组相比较显著降低。Wang等[25]研究证实MMP-9在宫颈癌中高表达,并且提示MMP-9及MMP-2在宫颈癌中高表达联合RECK的低表达能够预测浸润性宫颈癌患者的远期生存,造成这种现象的原因可能是MMP-9在肿瘤转移中发挥重要作用。此外,通过将PBK和MMP-9二者联合表达分组与患者OS和PFS进行统计分析后,发现二者联合高表达组的OS与低表达组的OS之间差异具有统计学意义,并且二者联合后高表达组PFS比低表达组显著降低,提示在宫颈癌中二者同时高表达时,患者的PFS降低,复发或转移的可能性升高。
尽管目前在宫颈癌中关于PBK机制的研究尚未明确,但是结合PBK在其他恶性肿瘤中的初步机制研究结果,考虑PBK可能通过促进PTEN表达降低,进而导致FAK表达升高,增加MMP-9表达,从而促进肿瘤转移[6-7, 26],导致患者无进展生存期降低。
另外,就临床而言,不仅肿瘤基因的表达可能预测患者的治疗结果,其他一些临床相关因素诸如:患者年龄的分组、病理的分化程度、临床分期、放射治疗剂量、化疗的强度等均可能影响患者的预后。本研究在进行单因素分析前,从患者的一般情况分析中可见本研究的两种蛋白的低表达和高表达组间,上述可能影响预后的临床因素是完全相互匹配的。因此单进行单因素分析对结果的判断也是合理的。
综上所述,PBK和MMP-9在宫颈癌组织中均表达升高,并且两者表达水平均与宫颈癌的预后相关,联合检测PBK和MMP-9的表达水平可能有助于预测宫颈癌同步放化疗后的疗效,但是由于本研究样本量较小,病例数有限,并且因部分样本资料不够完整被剔除,因此结果分析可能会有偏倚,仍需进一步进行大样本随机研究加以证实。
志谢 感谢武汉大学中南医院孙英明博士参与本文图片制作及文字修改利益冲突 无
作者贡献声明 孙晓革负责实验实施、数据统计和论文撰写;宝莹娜、邱惠、郁志龙进行论文审校;石静负责收集随访资料;张薇负责准备实验试剂和实验材料;谢丛华负责实验设计和论文审校
| [1] |
Arians N, Lindel K, Krisam J, et al. Prospective phase-Ⅱ-study evaluating postoperative radiotherapy of cervical and endometrial cancer patients using protons-the APROVE-trial[J]. Radiat Oncol, 2017, 12(1): 188. DOI:10.1186/s13014-017-0926-5 |
| [2] |
Song B, Ding C, Chen W, et al. Incidence and mortality of cervical cancer in China, 2013[J]. Chin J Cancer Res, 2017, 29(6): 471-476. DOI:10.21147/j.issn.1000-9604.2017.06.01 |
| [3] |
Katanyoo K. Comparing treatment outcomes of stage ⅢB cervical cancer patients between those with and without lower third of vaginal invasion[J]. J Gynecol Oncol, 2017, 28(6): e79. DOI:10.3802/jgo.2017.28.e79 |
| [4] |
何芙蓉, 黄高昇, 王娟红, 等. 应用组织芯片研究PBK/TOPK在人体正常及肿瘤组织中的表达[J]. 临床与实验病理学杂志, 2007, 23(4): 450-452. He FR, Huang GS, Wang JH, et al. PBK/TOPK expression in human normal and tumor tissues by tissue microarray[J]. Chin J Clin Experiment Pathol, 2007, 23(4): 450-452. DOI:10.3969/j.issn.1001-7399.2007.04.017 |
| [5] |
刘宇宏, 刘延香, 黄高昇, 等. B细胞非霍奇金淋巴瘤PBK/TOPK表达与增殖活性的关系[J]. 临床与实验病理学杂志, 2006, 22(5): 541-544. Liu YH, Liu YX, Huang GS, et al. Correlation of the expression of PBK/TOPK with the proliferation of B cell non-Hodgkin's lymphoma[J]. Chin J Clin Experiment Pathol, 2006, 22(5): 541-544. DOI:10.3969/j.issn.1001-7399.2006.05.007 |
| [6] |
Shih MC, Chen JY, Wu YC, et al. TOPK/PBK promotes cell migration via modulation of the PI3K/PTEN/AKT pathway and is associated with poor prognosis in lung cancer[J]. Oncogene, 2012, 31(19): 2389-2400. DOI:10.1038/onc.2011.419 |
| [7] |
Zhu F, Zykova TA, Kang BS, et al. Bidirectional signals transduced by TOPK-ERK interaction increase tumorigenesis of HCT116 colorectal cancer cells[J]. Gastroenterology, 2007, 133(1): 219-231. DOI:10.1053/j.gastro.2007.04.048 |
| [8] |
Borbély AA, Murvai M, Kónya J, et al. Effects of human papillomavirus type 16 oncoproteins on survivin gene expression[J]. J Gen Virol, 2006, 87(Pt 2): 287-294. DOI:10.1099/vir.0.81067-0 |
| [9] |
Chambers AF, Matrisian LM. Changing views of the role of matrix metalloproteinases in metastasis[J]. J Natl Cancer Inst, 1997, 89(17): 1260-1270. DOI:10.1093/jnci/89.17.1260 |
| [10] |
Zhou Y, Shi D, Miao J, et al. PD-L1 predicts poor prognosis for nasopharyngeal carcinoma irrespective of PD-1 and EBV-DNA load[J]. Sci Rep, 2017, 7: 43627. DOI:10.1038/srep43627 |
| [11] |
奚美丽, 李俊, 鹿欣. Ezrin蛋白在宫颈癌中表达的临床意义及其与PCNA、MMP-2、MMP-9、HPV E6蛋白的关系[J]. 中国癌症杂志, 2013(11): 904-909. Xi ML, Li J, Lu X. Differential expression of Ezrin in cervical cancer tissues and the relationship between Ezrin and PCNA, MMP-2, MMP-9, HPV[J]. China Oncol, 2013(11): 904-909. DOI:10.3969/j.issn.1007-3969.2013.11.009 |
| [12] |
Garavello W, Maggioni D, Nicolini G, et al. Association between metalloproteinases 2 and 9 activity and ERK1/2 phosphorylation status in head and neck cancers:an ex vivo study[J]. Oncol Rep, 2010, 24(4): 1073-1078. |
| [13] |
Yang S, Zhao Z, Wu R, et al. Expression and biological relationship of vascular endothelial growth factor-A and matrix metalloproteinase-9 in gastric carcinoma[J]. J Int Med Res, 2011, 39(6): 2076-2085. DOI:10.1177/147323001103900603 |
| [14] |
Omran OM, Thabet M. Gelatinases A and B expression in human colorectal cancer in upper Egypt:a clinicopathological study[J]. Ultrastruct Pathol, 2012, 36(2): 108-116. DOI:10.3109/01913123.2011.641671 |
| [15] |
Peng WJ, Zhang JQ, Wang BX, et al. Prognostic value of matrix metalloproteinase 9 expression in patients with non-small cell lung cancer[J]. Clin Chim Acta, 2012, 413(13-14): 1121-1126. DOI:10.1016/j.cca.2012.03.012 |
| [16] |
Baldwin RM, Haghandish N, Daneshmand M, et al. Protein arginine methyltransferase 7 promotes breast cancer cell invasion through the induction of MMP-9 expression[J]. Oncotarget, 2015, 6(5): 3013-3032. DOI:10.18632/oncotarget.3072 |
| [17] |
Huang J, Hu W, Sood AK. Prognostic biomarkers in ovarian cancer[J]. Cancer Biomark, 2010, 8(4-5): 231-251. DOI:10.3233/CBM-2011-0212 |
| [18] |
Lin LF, Chuang CH, Li CF, et al. ZBRK1 acts as a metastatic suppressor by directly regulating MMP-9 in cervical cancer[J]. Cancer Res, 2010, 70(1): 192-201. DOI:10.1158/0008-5472.CAN-09-2641 |
| [19] |
Brooks R, Kizer N, Nguyen L, et al. Polymorphisms in MMP-9 and SIPA1 are associated with increased risk of nodal metastases in early-stage cervical cancer[J]. Gynecol Oncol, 2010, 116(3): 539-543. DOI:10.1016/j.ygyno.2009.09.037 |
| [20] |
张伟. PBK/TOPK在宫颈癌组织中的表达及临床意义[J]. 中国免疫学杂志, 2015, 31(12): 1688-1691. Zhang W. Expression and clinical significance of PBK/TOPK in cervical cancer tissues[J]. Chin J Immunol, 2015, 31(12): 1688-1691. DOI:10.3969/j.issn.1000-484X.2015.12.022 |
| [21] |
安风仙, 王晓, 刘雯, 等. 磷酸化细胞外信号调节激酶1/2和基质金属蛋白酶-9在宫颈鳞状细胞癌癌变过程中的表达及相关性[J]. 中国医学科学院学报, 2012, 34(6): 590-594. An FX, Wang X, Liu W, et al. Expressions of clinical significances of P-extracellular regulated kinase 1/2 and matrix metalloproteinase-9 in cervical squamous cell carcinoma[J]. Acta Acad Med Sine, 2012, 34(6): 590-594. DOI:10.3881/j.issn.1000-503X.2012.06.010 |
| [22] |
Lei B, Liu S, Qi W, et al. PBK/TOPK expression in non-small-cell lung cancer:its correlation and prognostic significance with Ki67 and p53 expression[J]. Histopathology, 2013, 63(5): 696-703. DOI:10.1111/his.12215 |
| [23] |
O'Leary PC, Penny SA, Dolan RT, et al. Systematic antibody generation and validation via tissue microarray technology leading to identification of a novel protein prognostic panel in breast cancer[J]. BMC Cancer, 2013, 13: 175. DOI:10.1186/1471-2407-13-175 |
| [24] |
Chang CF, Chen SL, Sung WW, et al. PBK/TOPK expression predicts prognosis in oral cancer[J]. Int J Mol Sci, 2016, 17(7). DOI:10.3390/ijms17071007 |
| [25] |
Wang L, Wang Q, Li HL, et al. Expression of MiR200a, miR93, metastasis-related gene RECK and MMP2/MMP-9 in human cervical carcinoma--relationship with prognosis[J]. Asian Pac J Cancer Prev, 2013, 14(3): 2113-2118. DOI:10.7314/APJCP.2013.14.3.2113 |
| [26] |
Sun H, Zhang L, Shi C, et al. TOPK is highly expressed in circulating tumor cells, enabling metastasis of prostate cancer[J]. Oncotarget, 2015, 6(14): 12392-12404. DOI:10.18632/oncotarget.3630 |
 2018, Vol. 38
2018, Vol. 38


