2. 213003 常州, 南京医科大学附属常州市第二人民医院放疗科
2. Department of Radiotherapy, Changzhou No.2 People's Hospital, Affiliated Hospital of Nanjing Medical University, Changzhou 213003, China
手术治疗是胸段食管癌首选治疗手段,但术后常有气管食管沟淋巴结(tracheoesophageal groove lymph nodes,TGLN)转移发生。放射治疗是食管癌TGLN转移的主要手段,近年来,调强放疗技术(IMRT)的广泛应用不仅提高了靶区的适形性和剂量的均匀性、减少正常组织的放射剂量,还提高了局控率和生存率。研究显示,食管癌同步放化疗疗效和预后明显优于单纯放疗,且不良反应可耐受[1]。食管癌大多采用常规分割放疗,也有文献报道大分割治疗中晚期食管癌是可行的,有潜在提高生存率的可能[2-3]。本研究对食管癌术后TGLN转移的患者进行大分割放射治疗,并同期联合紫杉醇单药周剂量化疗,观察其治疗不良反应、近期疗效以及预后。
资料与方法1.入组与排除标准:2013年1月至2015年6月盐城市第三人民医院收治的53例食管癌术后TGLN淋巴结转移的患者。入组标准:①年龄≤75岁。②临床表现为声嘶和呛咳,排除声带器质性病变。③经CT/MRI/PET-CT诊断为气管食管沟淋巴结转移。④排除全身其他脏器或淋巴结转移。⑤无严重心脑血管疾病,肝肾功能正常。⑥预期寿命≥3月。排除标准:①妊娠或哺乳期妇女。②合并其他恶性肿瘤。③有放化疗禁忌者。④随访资料不全者。将53例患者通过抛硬币的方法随机分为大分割组(25例)和常规分割组(28例)。两组患者临床基线资料比较差异均无统计学意义(P>0.05),具有可比性,见表 1。本研究经过东南大学附属盐城市第三人民医院伦理委员会批准(审批号:2013031)。
|
|
表 1 两组食管癌术后气管食管沟淋巴结转移患者临床基线资料比较 Table 1 Comparison of baseline clinical data in post-operative esophageal cancer patients with TGLD metastasis between the two groups |
2.放射治疗:所有患者均采用头颈肩热塑模固定,通过CT模拟机(美国GE公司)进行扫描定位,扫描范围包括颈部和胸部,层厚2.5 mm,将获得的CT图像传输到Eclipse计划系统,以TGLN为肿瘤体积(GTV),GTV外放0.5~0.8 cm为计划靶区体积(PTV)。大分割组照射剂量60 Gy/20次,共4周,常规分割组照射剂量60 Gy/30次,共6周。危及器官剂量限制,常规分割组:脊髓最大剂量<45 Gy,肺平均剂量<13 Gy,肺V20<25%;大分割组:脊髓最大剂量<40 Gy,肺平均剂量<11 Gy,肺V20<20%。采用美国Varian Unique直线加速器6 MV X射线调强放疗。
3.化疗:每周1次,患者放疗前静滴50 mg紫杉醇(海口市制药公司,国药准字H20043045),化疗前予止吐、抗过敏处理,大剂量组同步化疗4周,常规分割组同步化疗6周。
4.评价标准和随访:急性放射性食管损伤和肺损伤的评定和分级采用北美放射肿瘤协作组(RTOG)1997年拟定的分级标准[4]。按实体瘤疗效评价标准(RECIST 1.1版)评估淋巴结转移灶疗效。治疗结束2年内每3个月随访1次,2年后每6个月随访1次;随访内容包括病史、体格检查、实验室检查、心电图、腹部B超、胸部CT等;以总生存(OS)、无疾病进展生存(PFS)、局部控制率(LC)为评价指标。随访截至2017年11月30日,随访率100%。
5.统计学处理:采用SPSS 21.0软件进行统计分析,计量资料均数用x±s表示,两组计量资料呈正态分布,采用比较t检验,计数资料比较采用χ2检验或精确概率法,等级资料采用非参数统计,采用Kaplan-Meier法计算生存率和无进展生存率,Logrank进行单因素预后分析,多因素分析采用Cox比例风险模型。P < 0.05为差异有统计学意义。
结果1.放射治疗剂量学参数:大分割组和常规分割组肺V20分别为(5.13±2.1)%和(5.61±2.4)%,两组V60分别为(15.32±6.10)%和(15.50±5.80)%,两组的V20和V60比较,差异均无统计学意义(P>0.05)。
2.不良反应:放疗早期患者不良反应主要表现为放射性食管炎和气管炎,大分割组和常规分割组3~4级放射性食管炎发生率分别为44.0%和25.0%,3~4级放射性肺炎发生率分别为16.0%和7.1%,两组比较,差异均无统计学意义(P>0.05)。两组患者均未出现晚期脊髓放射性损伤症状;大分割组和常规分割组分别有4例和2例患者肺部出现斑片状纤维化改变,差异无统计学意义(P>0.05);全组未出现食管出血、穿孔病例,大分割组和常规分割组分别有4例和1例患者因进食困难行吻合口扩张(2~3级放射性食管损伤),差异无统计学意义(P>0.05)。
3.近期疗效:放疗结束后2个月评估所有患者近期疗效,完全缓解率(CR)28.3%,部分缓解率(PR)49.1%,总有效率(OR)77.3%。大分割组和常规分割组CR率、PR率分别为36.0%、44.0%和21.4%、53.6%,两组比较,差异无统计学意义(P>0.05)。淋巴结转移灶直径≤2 cm和>2 cm的患者CR率、PR率分别为36.1%、55.6%和0.0%、52.9%,两者比较,差异有统计学意义(P<0.05)。
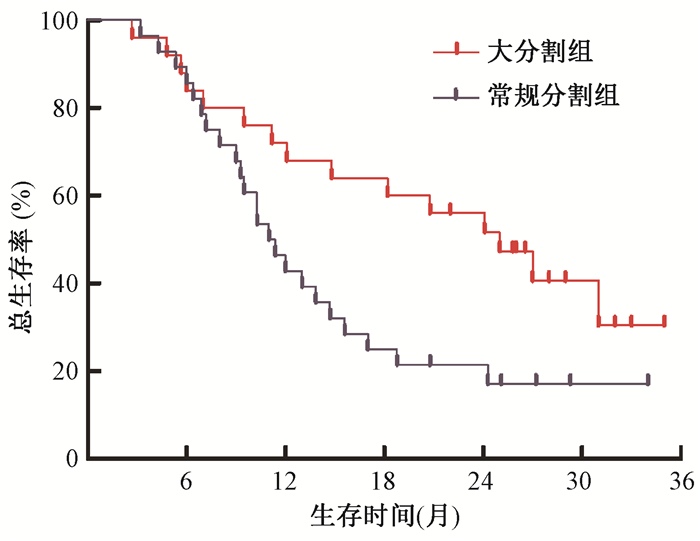
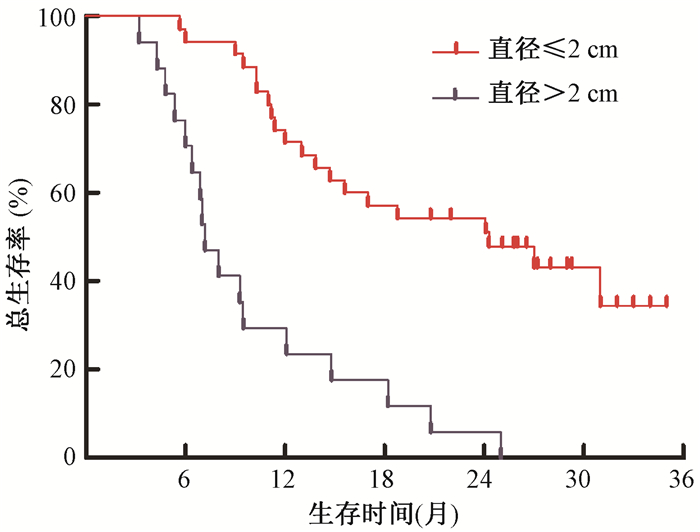
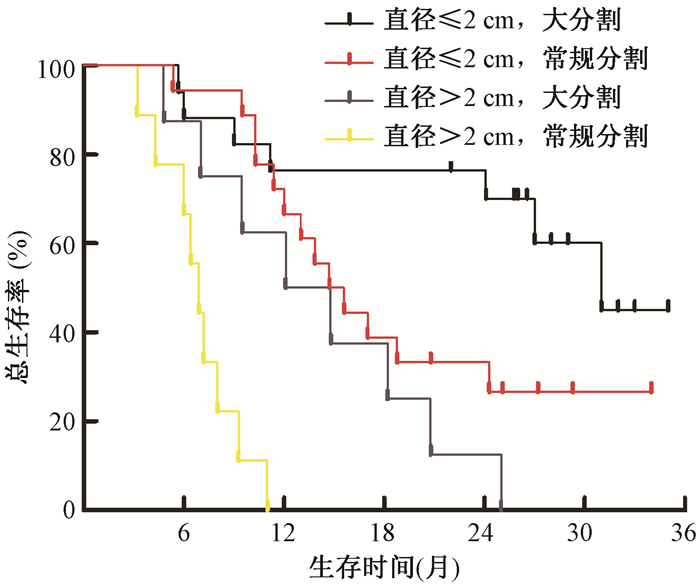
4.生存分析:所有患者1年和2年总生存率为56.6%和35.6%,中位OS为14.7个月(95%CI 9.6~19.8)。大分割组和常规分割组中位OS分别为24.2个月(95%CI 16.2~32.1)和11.8个月(95%CI 9.2~14.4),两组比较,差异有统计学意义(χ2=5.063,P < 0.05),见图 1。淋巴结转移灶直径≤2 cm和>2 cm的患者中位OS分别为24.1个月(95%CI 12.0~36.1)和7.3个月(95%CI 6.2~8.2),两者比较,差异有统计学意义(χ2=23.479,P < 0.05),见图 2。淋巴结转移灶直径≤2 cm患者大分割治疗OS曲线优于常规分割(χ2=4.249,P < 0.05);淋巴结转移灶直径>2 cm患者大分割治疗OS曲线优于常规分割(χ2=4.907,P < 0.05),见图 3。单因素分析显示,气管食管沟淋巴结直径(P<0.001)和放疗分割方式(P=0.028)是影响患者预后的因素。将年龄、性别、气管食管沟淋巴结直径和放疗分割方式纳入多因素分析模型,淋巴结直径≤2 cm(调整HR=0.108,95%CI 0.047~0.249)和大分割治疗(调整HR=0.236,95%CI 0.105~0.528)是患者预后较好的独立因素,见表 2。
|
图 1 食管癌术后气管食管沟淋巴结转移大分割和常规分割放疗总生存比较 注:χ2=5.063,P < 0.05 Figure 1 Comparison of OS in post-operative esophageal cancer patients with TGLD metastasis between HFR group and CFR group |
|
图 2 食管癌术后不同直径气管食管沟淋巴结转移的患者总生存比较 注:两组比较χ2=23.479,P<0.05 Figure 2 Comparison of OS with various TGLN diameters metastasis in post-operative esophageal cancer patients with TGLD metastasis |
|
图 3 食管癌术后TGLN转移直径不同的患者不同分割方式治疗生存比较 注:大分割、淋巴结直径≤2 cm与常规分割、淋巴结直径≤2 cm比较,χ2=4.249,P < 0.05;大分割、淋巴结直径>2 cm与常规分割、淋巴结直径>2 cm比较, χ2=4.907,P < 0.05 Figure 3 Comparison of OS in post-operative esophageal cancer patients treating with different fractioned with various TGLD metastasis diameters |
|
|
表 2 影响食管癌术后TGLN淋巴结转移患者OS协变量的单因素和多因素分析 Table 2 Univariate and multivariate analysis of OS covariants in post-operative esophageal cancer patients with TGLN metastasis |
5.死因分析:全组38例死亡,28例明确死亡原因,15例死于气管食管沟淋巴结复发,10例死于其他脏器转移,3例死于其他原因(2例肺栓塞和1例心功能衰竭)。大分割组和常规分割组死于气管食管沟淋巴结复发分别为12.0%(3/25)和42.9%(12/28),大分割组明显低于常规分割组(P < 0.05)。
讨论手术治疗是胸段食管癌首选治疗方法,食管癌术后TGLN转移率为12% ~80%[5-7]。且右侧淋巴结转移多见[8],TGLN转移是食管癌手术治疗常见失败模式。患者一旦发生淋巴结转移,喉返神经极易受损,从而导致声嘶、进食呛咳,降低患者的生活质量严重影响患者预后。
对食管癌术后TGLN转移尚无统一的治疗模式,通常以局部放射治疗为主辅以全身化疗。食管癌术后TGLN淋巴结血供下降,放射敏感性较差,常规分割放疗难以达到理想的治疗效果。因担心气管或食管穿孔等严重并发症的发生,食管癌治疗中大分割放射治疗的临床研究较少。Song等[2]报道,局部晚期食管癌患者每日接受≤5 Gy的大分割照射是可行的,且患者耐受性好。Ma等[3]认为,食管癌患者54~60 Gy/18~20次的照射未明显增加放疗不良反应,且有潜在增加疗效可能。本研究中,大分割组放射性脊髓、肺和食管放射性损伤与常规分割组比较均无明显差异,同样证实大分割治疗食管癌术后气管JGLN转移是安全的。单纯放疗仅可治疗局部肿瘤及周围浸润,改善症状,无法控制远处转移[9]。紫杉醇是作用机制独特的抗肿瘤药物,它通过改变有丝分裂过程,使细胞的有丝分裂停止, 尤其是将细胞阻滞于G2/M期。肿瘤细胞在G2/M期对放射线作用最为敏感,所以紫杉醇既有直接的抗肿瘤作用,同时可作为放射增敏剂,同步放化疗时亦可看作放射增敏剂[10]。放疗同时联合小剂量紫杉醇化疗,可提高食管癌细胞放射敏感性[11],并杀灭远处转移的肿瘤细胞,提高远期生存率。
本研究将食管癌术后TGLN转移的患者大分割等效生物剂量约80 Gy。大分割组3~4级放射性食管损伤和放射性肺损伤均略高于常规分割组,但差异无统计学意义(P>0.05)。淋巴结直径≤2 cm患者OS好于淋巴结直径>2 cm的患者,提示食管癌术后患者定期复查胸部CT或PET-CT,尽早发现TGLN转移并及时治疗有助于改善预后。不管是在淋巴结直径≤2 cm还是>2 cm的患者中,大分割放疗OS均好于常规分割,提示所有体积的转移淋巴结都可能从较高强度的放射治疗中获益。本研究显示TGLN直径≤2 cm和大分割治疗是提高患者预后的独立因素,这是因为患者一旦发生TGLN转移即改变了原有的分期状态,所有患者均为N+。
总之,食管癌术后单纯TGLN转移的患者,采用大分割放疗联合紫杉醇小剂量化疗有助于改善患者预后,且患者的放疗不良反应未明显增加。
利益冲突 本研究接受盐城市卫生局医学科技发展计划项目(YK2104070)和常州市卫生计生委重大科技项目(ZD201710)资助。所有作者无任何利益冲突作者贡献声明 朱海文提供研究思路和研究方案起草论文;于静萍、王坚负责论文起草和最终版本修订;蒋友芹、裴冬负责病例入组、治疗和随访,汪建林负责数据整理和分析
| [1] |
孙志强, 于静萍, 王坚, 等. 沙利度胺联合放化疗治疗食管癌随机对照研究[J]. 中华放射医学与防护杂志, 2016, 36(11): 815-821. Sun ZQ, Yu JP, Wang J, et al. A randomized controlled study of thalidomide combined with radiochemotherapy in treating esophageal cancer[J]. Chin J Radiol Med Prot, 2016, 36(11): 815-821. DOI:10.3760/cma.j.issn.0254-5098.2016.11.004 |
| [2] |
Song YP, Ma JB, Hu LK, et al. Phase Ⅰ/Ⅱ study of hypofractioned radiation with three-dimensional conformal radiotherapy for clinical T3~4N0~1M0 stage esophageal carcinoma[J]. Technol Cancer Res Treat, 2011, 10(1): 25-30. DOI:10.7785/tcrt.2012.500176 |
| [3] |
Ma JB, Wei L, Chen EC, et al. Moderately hypofractionated conformal radiation treatment of thoracic esophageal carcinoma[J]. Asian Pac J Cancer Prev, 2012, 13(8): 4163-4167. DOI:10.7314/APJCP.2012.13.8.4163 |
| [4] |
殷蔚伯, 余子豪, 徐国镇, 等. 肿瘤放射治疗学[M]. 4版. 北京: 中国协和医科大学出版社, 2008, 546-573. Yin WB, Yu ZH, Xu GZ, et al. radiation oncology [M]. 4th edit. Beijing: Chinese Peking Union Uedical Uollege Press, 2008, 546-573. |
| [5] |
Chen J, Cai W, Zheng X, et al. The pattern of cervical lymph node metastasis in thoracic esophageal squamous cell carcinoma may affect the target decision for definitive radiotherapy[J]. Radiother Oncol, 2017, 123(3): 382-386. DOI:10.1016/j.radonc.2017.04.011 |
| [6] |
Luo Y, Wang X, Liu Y, et al. Identification of risk factors and the pattern of lower cervical lymph node metastasis in esophageal cancer:implications for radiotherapy target delineation[J]. Oncotarget, 2017, 8(26): 43389-43396. DOI:10.18632/oncotarget.14761 |
| [7] |
Kang Y, Hwang Y, Lee HJ, et al. Patterns and prognostic significance of cervical lymph node metastasis and the efficacy of cervical node dissection in esophageal cancer[J]. Korean J Thorac Cardiovasc Surg, 2017, 50(5): 329-338. DOI:10.5090/kjtcs.2017.50.5.329 |
| [8] |
毛友生, 赫捷, 董静思, 等. 胸段食管癌左右胸入路清扫淋巴结的结果比较[J]. 中华肿瘤杂志, 2012, 34(4): 296-300. Mao YS, He J, Dong JS, et al. Comparison of the results of lymph node dissection via left versus right thoracotomy[J]. Chin J Oncol, 2012, 34(4): 296-300. DOI:10.3760/cma.j.issn.0253-3766.2012.04.013 |
| [9] |
Haefner MF, Lang K, Krug D, et al. Prognostic factors, patterns of recurrence and toxicity for patients with esophageal cancer undergoing definitive radiotherapy or chemo-radiotherapy[J]. J Radiat Res, 2015, 56(4): 742-749. DOI:10.1093/jrr/rrv022 |
| [10] |
邓家营, 王春雨, 赵快乐. 紫杉醇(PTX)在食管癌同期放化疗中的研究进展[J]. 复旦学报(医学版), 2014, 41(5): 697-700, 705. Deng JY, Wang CY, Zhao KL. Research progress of paclitaxel(PTX) in concurrent chemoradiotherapy of esophageal carcinoma[J]. Fudan Univ J Med Sci, 2014, 41(5): 697-700. DOI:10.3969/j.issn.1672-8467.2014.05.023 |
| [11] |
Tu L, Sun L, Xu Y, et al. Paclitaxel and cisplatin combined with intensity-modulated radiotherapy for upper esophageal carcinoma[J]. Radiat Oncol, 2013, 8: 75. DOI:10.1186/1748-1717X-8-75 |
 2018, Vol. 38
2018, Vol. 38


