2. 223600 沭阳, 江苏省沭阳县人民医院放疗科
2. Department of Radiotherapy, Shuyang People's Hospital, Shuyan 223600, China
术后放疗是乳腺癌患者重要的局部治疗手段,可以使术后残留病灶及微转移病灶得到有效治疗,从而减少患者的局部复发风险。对于原发肿瘤≥T3期及腋窝淋巴结转移≥4个(≥N2期)的复发高危乳腺癌患者,术后行胸壁及锁骨上淋巴引流区的预防性放疗在临床上已达成共识。但对于T1~2N1M0期复发中危乳腺癌患者,术后辅助放疗是否获益一直存有争议。由于乳腺癌独特的生物学行为及组织学特征,根据组织学及基因表型的差异,乳腺癌可分为多种类型,其中三阴乳腺癌(triple-negative breast cancer,TNBC)约占全部乳腺癌的15%~20%[1]。对于T1~2N1M0这类早期三阴乳腺癌患者术后预后危险因素,是否能从术后放疗中获益,具体的放疗指证尚无定论。本研究通过回顾性分析87例T1~2期1~3枚淋巴结转移三阴乳腺癌患者的临床资料,比较不同临床病理特征对5年局部区域复发率、远处转移率、无复发生存率、总生存率的影响,探讨放疗应用价值及影响预后危险因素,为早期中危三阴乳腺癌术后患者治疗方案的选择提供临床证据。
资料与方法1.一般临床资料及分组:2006年1月至2011年10月大连医科大学附属二院诊治的术后病理分期T1~2N1M0乳腺癌患者87例,均为女性,87例患者中位年龄46岁,年龄≤35岁8例,35~50岁46例,>50岁33例;53例患者未绝经,34例患者绝经;21例体质量指数(BMI)<25 kg/m2,66例BMI≥25 kg/m2。术后均完成6~8周期方案化疗,化疗方案包括蒽环类药物或蒽环联合紫杉醇类药物,化疗后进行放射治疗。所有患者术后病理明确,免疫组学检测雌激素受体(ER)、孕激素受体(PR)、人类表皮生长因子受体-2(Her-2)均为阴性。ER、PR阴性为在肿瘤细胞核内阳性表达≤1%,Her-2阴性为Her2-/+或者Her-2++再经原位荧光免疫杂交(FISH)检测为阴性,扩增比<2.2。其中放疗组53例,未放疗组34例。具体临床病理特征见表 1。
|
|
表 1 87例术后三阴乳腺癌患者临床特征 Table 1 Clinical features of 87 triple-negative breast cancer patients |
2.治疗方法:所有患者均行改良根治术,术后病理明确,切缘阴性。72例术后化疗方案中含有紫杉类药物,其他15例化疗方案中不含紫杉类药物(5例CAF方案,8例CEF方案,2例CMF方案),均行全身化疗6~8周期。化疗结束后行常规放疗,射野范围包括胸壁及锁骨上下照射野(其中下界健侧乳腺皱褶下2 cm水平线,上界环甲膜)。锁骨上下野采用6 MV X射线,DT 50 Gy/5周,胸壁6 MeV电子线,DT 50 Gy/5周。照射方式参照目前中国医学科学院肿瘤医院照射技术进行。
3.疗效评价指标:评价指标包括局部区域复发(locoregional recurrence,LRR)、远处转移(distant metastasis,DM)、无复发生存(recurrence-free survival,RFS)及总生存(overall survival,OS)。
4.统计学处理:采用SPSS 17.0统计软件进行数据分析。计数资料采用χ2检验,单因素分析采用Kaplan-Meier法进行生存分析并使用Log-rank进行分组检验,多因素分析采用Cox回归模型进行预后分析,所有统计检验均为双侧概率检验。P<0.05为差异有统计学意义。
结果1.随访结果:所有患者局部区域复发率、远处转移率、无复发生存率及总生存率随访截至2016年12月,随访时间20~119个月,中位随访时间83个月。87例患者5年LRR、DM、RFS和OS分别为16.0%、18.9%、75.5%和84.0%。
2.局部区域复发率、远处转移率、无复发生存及总生存率预后的单因素分析结果。
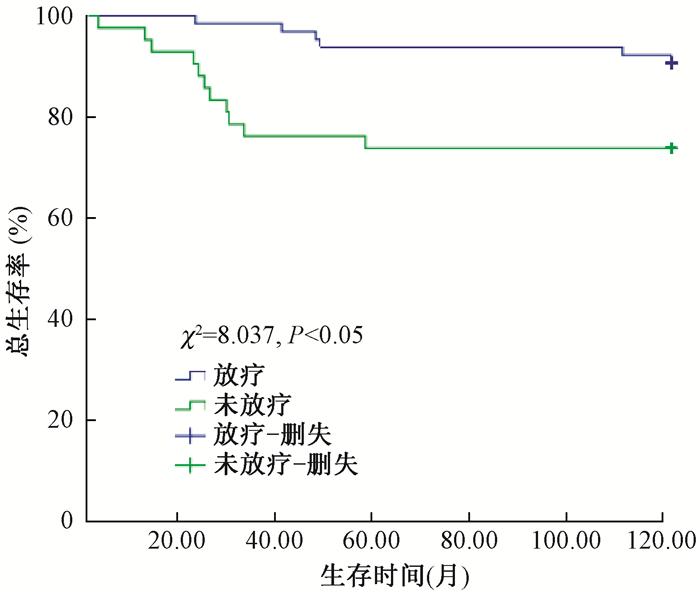
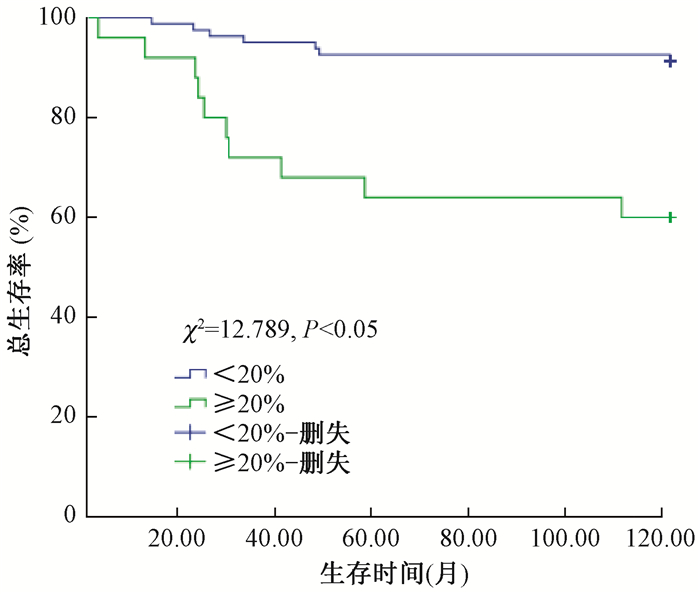
(1) 局部区域复发率:术后放疗组与未放疗组患者5年LRR分别为9.4%和15.2%(χ2=8.037,P<0.05);淋巴结转移率≥20%与<20%的患者5年LRR分别为27.2%和8.6%(χ2=12.789,P<0.05),见图 1、2;年龄≤35岁、35~50岁及>50岁患者5年LRR为41.7%、14.8%和10.0%(χ2=6.561,P<0.05);Ki-67≥15%与<15%的患者5年LRR为20.7%和6.8%(χ2=9.092,P<0.05)。单因素分析显示, 术后放疗、年龄≤35岁、淋巴结转移率≥20%、Ki-67≥15%是影响5年LRR的危险因素。
|
图 1 放疗与未放疗组患者区域复发的生存率 Figure 1 The LRR survival function of the radiotherapy group and the non-radiotherapy group |
|
图 2 不同淋巴结转移率患者区域复发生存率 Figure 2 The LRR survival function in patients with different lymph node metastasis |
(2) 远处转移率:脉管癌栓阳性与阴性患者5年DM分别为41.2%和14.3%(χ2=8.479,P<0.05);淋巴结转移率≥20%与<20%的患者5年DM分别为32.0%和14.8%(χ2=3.908,P<0.05)。单因素分析显示,脉管癌栓和淋巴结转移率≥20%是影响5年DM的危险因素。
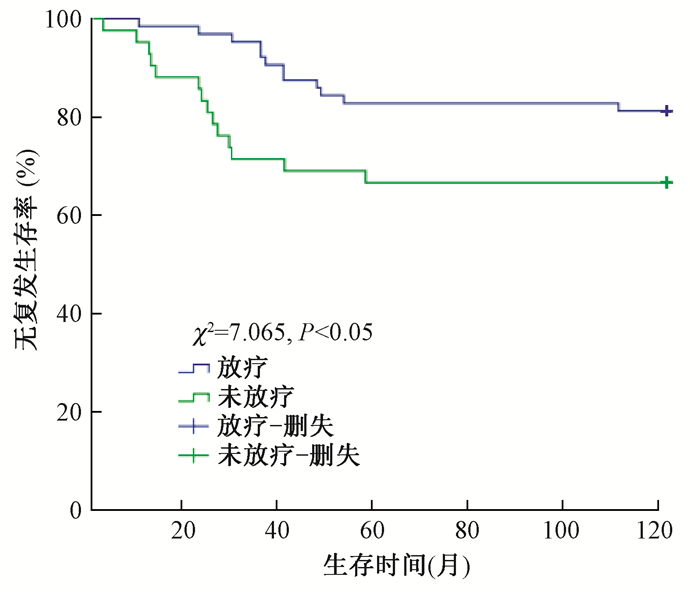
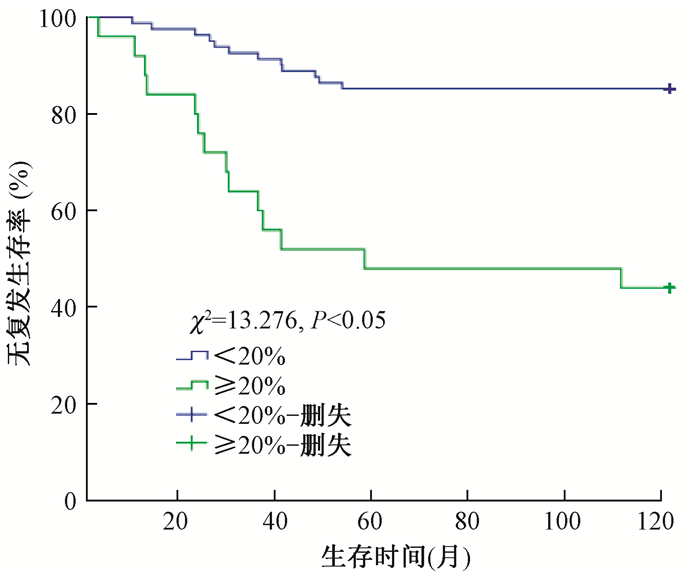
(3) 无复发生存率:术后放疗与未放疗患者5年RFS分别为81.3%和66.7%(χ2=7.065,P<0.05),见图 3;脉管癌栓阳性与脉管癌栓阴性患者5年RFS为57.1%和81.0%(χ2=9.436,P<0.05);淋巴结转移率≥20%与<20%的患者5年RFS分别为67.1%和85.2%(χ2=13.276,P<0.05),见图 4;Ki-67≥15%与<15%的患者5年RFS分别为68.1%和84.9%(χ2=15.052,P<0.05)。单因素分析显示,术后放疗、脉管癌栓阳性、淋巴结转移率≥20%及Ki-67≥15%是影响5年RFS的危险因素。
|
图 3 放疗与未放疗患者无复发生存情况 Figure 3 No recurrent survival in patients with radiotherapy and non-radiotherapy |
|
图 4 淋巴结转移率<20%与≥20%患者无复发生存情况 Figure 4 No recurrent survival in patients with lymph node metastasis of < 20% and ≥20% |
(4) 总生存率:年龄、月经状态、肿瘤大小、腋窝淋巴结状态、是否放疗等上述预后因素对5年OS影响不显著,差异均无统计学意义(P>0.05)。
3.影响局部控制率、远处转移率、无复发生存率及总生存率预后多因素分析结果:在单因素分析结果的基础上,进一步行Cox模型多因素分析结果显示,淋巴结转移率(P=0.013,HR=5.227;95%CI 1.416~19.296)、是否放疗(P=0.042,HR=0.279;95%CI 0.082~0.952)是影响术后T1~2N1M0期早期三阴乳腺癌5年LRR的独立危险因素。淋巴结转移率≥20%的局部复发风险是淋巴结转移率<20%的5.227倍,未放疗的局部复发风险是放疗的0.279倍。淋巴结转移率≥20%及术后辅助放疗是影响5年LRR的独立危险因素。脉管癌栓是影响5年DM的独立危险因素(P=0.030, HR=2.313;95%CI 1.087~4.924)。脉管癌栓(P=0.016,HR=2.350;95%CI 1.169~4.723)、淋巴结转移率(P=0.001,HR=5.804;95%CI 2.907~16.068)、是否放疗(P=0.041,HR=0.378;95%CI 0.149~0.959)是影响术后T1~2N1M0期早期三阴乳腺癌5年RFS的独立危险因素。肿瘤大小、淋巴结状态、脉管癌栓及是否放疗不是影响5年OS的独立危险因素。
讨论乳腺癌是一种基因异质性疾病,肿瘤谱极为广泛,其发生是基因、遗传和环境因素共同作用的产物,因此其临床表现及预后存在着明显的差异[1-3]。目前,放射治疗在乳腺癌术后治疗应用范围扩大,其价值越来越被肯定,但对于T1~2N1M0的患者术后是否需要接受放疗仍存在争议。纵观美国国立综合癌症网络(NCCN)乳腺癌临床实践指南,对于术后病理≥4个阳性腋窝淋巴结的浸润性乳腺癌行辅助放疗已成为浸润性乳腺癌治疗的共识,而对于术后病理1~3枚阳性腋窝淋巴结的浸润性乳腺癌术后辅助的治疗经历了由考虑到强烈考虑的发展历程,对证据和共识的分类也从3类证据改为2B类证据。由此可见放射治疗在乳腺癌的术后辅助治疗中发挥着越来越重要的作用。Sharma等[4]研究表明这类患者改良根治术后复发率低,不建议在复发风险低的情况下行放射治疗。另有研究表明,乳腺癌术后1~3枚腋窝淋巴结阳性的T1~2期患者术后放疗可以提高OS及RFS,并且降低局部区域的复发率及远处转移率[5-6]。但是上述研究对此类患者并未进行三阴乳腺癌和非三阴乳腺癌的区分,经过长期的临床实践研究发现,三阴乳腺癌在药物疗效、复发风险、转移特征、分子分型等诸多方面,存在显著的异质性,部分三阴乳腺癌容易早期转移甚至死亡。因此,三阴乳腺癌的异质性研究是临床研究的热点问题。
多项回顾性研究发现TNBC这一分子亚型乳腺癌术后局部复发高于其他分子亚型,是不良预后因素。Kraeima等[7]通过回顾性研究分析17 762例乳腺癌患,其中三阴乳腺癌1 888例,结果显示,三阴乳腺癌具有更高的LRR。Park等[8]通过回顾性分析韩国11家医疗机构中1 382例乳腺癌术后T1~2N1M0患者临床资料,其中三阴乳腺癌157例,通过统计分析年龄、肿瘤大小、术后切缘状态(阳/阴性)、淋巴结转移个数、肿瘤浸润等级、分子分型6项指标,单因素结果显示三阴乳腺癌和管腔B型(luminal B)较管腔A型(luminal A)乳腺癌具有较高的LRR, 多因素分析研究发现三阴这一乳腺癌分子表型是乳腺癌患者5年OS的独立预后危险因素;Kong与Hong[9]研究乳腺癌术后T1~2N1M0患者预后危险因素发现,术后放疗组5年、10年LRR均为6.2%,未放疗组5年、10年LRR分别为10.4%、14.6%,此外研究表明,术后放疗组与未放疗组的无转移生存率、总生存率比较差异无统计学意义,多因素分析结果显示分子分型为三阴具有更高的局部区域复发风险(P=0.030)。以上研究表明,由于乳腺癌高度异质性,其临床诊断和治疗手段都与分子分型紧密联系,三阴乳腺癌较其他乳腺癌具有更高的局部区域复发危险,与本研究结果一致。
术后辅助放疗能提高乳腺癌局部控制率,但三阴乳腺癌的局部控制率较其他分子表型的乳腺癌低。本研究结果显示,术后放疗与未放疗患者的5年局部控制率、无复发生存率差异均有统计学意义,5年无远处转移生存率、总生存率差异均无统计学意义。本研究中单因素分析结果表明,术后未放疗是T1~2N1M0乳腺癌患者5年LRR和5年RFS预后危险因素,但对5年DM和OS的影响不明显,多因素分析表明术后未放疗是5年LRR和5年RFS独立预后危险因素,表明术后辅助放疗可提高三阴乳腺癌术后T1~2N1M0局部控制率,但对远处转移率及总生存率不存在显著影响。吴涛等[10]以215例(术后放疗66例,术后未放疗149例)改良根治术后T1~2N1M0三阴乳腺癌患者为研究对象结果显示,术后辅助放疗提高了5年无局部区域复发生存率(LRRFS),术后放疗组与未放疗组5年LRRFS差异显著,多因素预后分析结果表明局部区域复发率仅和术后未行辅助放疗相关,提示术后放疗可以使这类患者获益,延长其无复发生存时间,但对患者5年OS的研究结果显示两组之间并不存在显著差异。研究报道早期乳腺癌患者即使完整切除肿块,63%的患者肿块切除2~4 cm范围内仍存在小量残留[11-12],术后行辅助放疗与未行放疗3年无复发生存率差异显著,术后放疗可以消灭潜在的残留病灶,提高局部控制,进一步降低远处转移风险及乳腺癌死亡率。本研究结果提示术后放疗对于早期TNBC提高局部控制有一定疗效,术后放疗获益,但本研究采取回顾性研究方法,可能存在放疗选择偏倚等情况,仍需前瞻性实验进一步证实。
在所有的预后因素中,肿瘤大小、腋窝淋巴结情况仍然是乳腺癌患者无病生存率和总生存率的最有价值的预测指标,并且是决定乳腺癌的分期的主要因素[13]。学者普遍认为乳腺癌原发肿瘤的大小及淋巴结分期与患者的复发及转移是一种反比的关系。本研究并未得出肿瘤大小与预后关系的阳性结果,这和文献中报道一致,早期乳腺癌患者预后与肿瘤大小之间并不存在相关性[14]。考虑到入组的患者都是早期乳腺癌患者,肿瘤T分期较早,而且随访时间短,所以对预后影响可能不显著。淋巴结受累的数量和远处转移的风险间存在着直接关系,目前国际上公认UICC/AJCC联合制定的乳腺癌TNM分期沿用至今,但是关于淋巴结的分期一定程度上取决于腋窝淋巴结清扫的总数。腋窝淋巴结清扫的范围不够可能会降低乳腺癌的病理分期,影响临床治疗方案的决策,使一部分患者失去原本拥有的治疗机会。本研究通过分析T1~2N1M0期三阴乳腺癌患者淋巴结阳性个数及淋巴结转移率对预后影响结果显示,淋巴结个数对患者预后影响差异不显著;单因素及多因素研究一致表明淋巴结转移率>20%的较 < 20%的患者拥有更高的局部复发风险,差异具有统计学意义,但对DM及OS影响不显著。近年来越来越多的研究表明淋巴结转移率与淋巴结转移个数相比,对于预后的评价更有价值[15]。邢鹏等[16]研究1 192例乳腺癌患者预后资料,多因素研究结果显示,淋巴结转移个数在评价乳腺癌患者无瘤生存时间上不具有统计学意义,当以淋巴结转移率评价预后指标显示出统计学意义。因此,相对于淋巴结转移个数而言,淋巴结转移率能更好的评价T1~2N1M0期三阴乳腺癌患者术后5年LRR和RFS。本研究结果亦显示,淋巴结转移率是影响早期TNBC术后5年LRR和RFS的独立危险因素。
目前,国内外对于年龄、月经状态对三阴乳腺癌患者预后影响的研究结果不一致。多数学者认为年轻的三阴乳腺癌患者往往伴随大肿块及淋巴结转移、诊断分期晚,更容易出现复发转移,预后较差。研究表明,<35岁的青年乳腺癌患者大多数病理分化差,易出现腋窝淋巴结转移[17-18]。也有研究报道称年轻并不是三阴乳腺癌的独立预后危险因素[19-20],年轻的三阴乳腺癌患者相对其他年龄段的乳腺癌患者虽然临床诊断分期晚,但是整体生存情况无明显差异,分析其原因可能是由于年轻乳腺癌患者更多的进行了乳腺癌根治术及腋窝淋巴结清扫术,同时年轻患者接受化疗比例比较高,更加重视整体的综合治疗,这些因素可能使年轻患者获益。本研究结果显示,绝经后三阴乳腺癌局部复发率更高,这与Iwase等[21]研究一致,绝经后的三阴乳腺癌患者与绝经前的三阴乳腺癌患者相比,更容易发生淋巴结转移。
肿瘤组织的血供丰富,存在许多微血管,很容易形成脉管癌栓,大量研究显示脉管癌栓浸润是乳腺癌局部复发和远处转移的重要危险因素,是恶性肿瘤常见的病理表现之一,具有独立的预后意义。由于三阴乳腺癌的侵袭性高,脉管癌栓阳性的患者可能早期已经通过淋巴管和血管形成全身的微转移。本研究单因素分析结果显示脉管癌栓是影响远处转移率和无复发生存率的预后危险因素;多因素分析结果也提示,脉管癌栓是影响远处转移率的独立预后危险因素;但对于LRR、RFS及OS影响不显著。这与国内外研究报道一致,早期乳腺癌患者局部复发风险脉管癌栓阳性相对脉管癌栓阴性,更容易发生远处转移[22-23]。因此在临床诊疗中,需要让这类患者进行定期复查,以便尽早的发现肿瘤的转移,并及时诊治,改善预后。Ki-67是一种细胞增殖标志物,早期乳腺癌中反映肿瘤的恶性程度,在增殖细胞中普遍表达且不同细胞周期表达存在差异,Ki-67阳性的定义为>15%的细胞核阳性着色。Ki-67增殖指数高与预后不良、肿瘤侵袭性高、较高的组织学分级等密切相关。本研究单因素显示,Ki-67≥15%与LRR、DM、RFS均显示出相关性,是预后的危险因素,但是多因素分析并未显示出统计学意义,关于Ki-67指数以及增殖指数与T1~2N1M0乳腺癌预后的关系,需要进一步前瞻性研究证实。
综上所述,术后早期三阴乳腺癌预后除与治疗方案的选择密不可分外,不同的临床病理因素也与预后密切相关,本研究进一步肯定了术后放疗能降低早期三阴乳腺癌患者的LRR,但对5年DM和OS影响不显著,并发现术后放疗、淋巴结转移率、脉管癌栓、Ki-67指数和年龄为早期三阴乳腺癌预后影响因素。
利益冲突 本文作者与单位未因此项研究接受过第三方资助或服务,没有引起利益冲突的其他关系作者贡献声明 张锋负责论文设计和撰写;张卓负责总体设计和审校;邹丽娟负责论文整体指导;宣伟负责资料收集及数据统计学处理
| [1] |
Clarke M, Collins R, Darby S, et al. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival:an overview of the randomised trials[J]. Lancet, 2005, 366(9503): 2087-2106. DOI:10.1016/S0140-6736(05)67887-7 |
| [2] |
Fisher B, Anderson S, Bryant J, et al. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer[J]. N Engl J Med, 2002, 347(16): 1233-1241. DOI:10.1056/NEJMoa022152 |
| [3] |
Fisher B, Jeong JH, Bryant J, et al. Treatment of lymph-node-negative, oestrogen-receptor-positive breast cancer:long-term findings from National Surgical Adjuvant Breast and Bowel Project randomised clinical trials[J]. Lancet, 2004, 364(9437): 858-868. DOI:10.1016/S0140-6736(04)16981-X |
| [4] |
Sharma R, Bedrosian I, Lucci A, et al. Present-day locoregional control in patients with T1 or T2 breast cancer with 0 and 1 to 3 positive lymph nodes after mastectomy without radiotherapy[J]. Ann Surg Oncol, 2010, 17(11): 2899-2908. DOI:10.1245/s10434-010-1089-x |
| [5] |
Overgaard M, Nielsen HM, Overgaard J. Is the benefit of postmastectomy irradiation limited to patients with four or more positive nodes, as recommended in international consensus reports? A subgroup analysis of the DBCG 82 b&c randomized trials[J]. Radiother Oncol, 2007, 82(3): 247-253. DOI:10.1016/j.radonc.2007.02.001 |
| [6] |
McGale P, Taylor C, Correa C, et al. Effect of radiotherapy after mastectomy and axillary surgery on 10-year recurrence and 20-year breast cancer mortality:meta-analysis of individual patient data for 8135 women in 22 randomised trials[J]. Lancet, 2014, 383(9935): 2127-2135. DOI:10.1016/S0140-6736(14)60488-8 |
| [7] |
Kraeima J, Siesling S, Vliegen IM, et al. Individual risk profiling for breast cancer recurrence:towards tailored follow-up schemes[J]. Br J Cancer, 2013, 109(4): 866-871. DOI:10.1038/bjc.2013.401 |
| [8] |
Park HJ, Shin KH, Kim JH, et al. Incorporating risk factors to identify the indication of post-mastectomy radiotherapy in n1 breast cancer treated with optimal systemic therapy:a multicenter analysis in Korea (KROG 14-23)[J]. Cancer Res Treat, 2017, 49(3): 739-747. DOI:10.4143/crt.2016.405 |
| [9] |
Kong M, Hong SE. Which patients might benefit from postmastectomy radiotherapy in breast cancer patients with t1-2 tumor and 1-3 axillary lymph nodes metastasis?[J]. Cancer Res Treat, 2013, 45(2): 103-111. DOI:10.4143/crt.2013.45.2.103 |
| [10] |
吴涛, 王淑莲, 金晶, 等. 放疗显著改善T1~2N1M0期三阴乳腺癌改良根治术后的局部区域控制[J]. 中华放射肿瘤学杂志, 2014, 23(2): 87-91. Wu T, Wang SL, Jin J, et al. Improved locoregional control with conventional radiotherapy following modified radical mastectomy for patients with T1~2N1M0 triple-negative breast cancer[J]. Chin J Radiat Oncol, 2014, 23(2): 87-91. DOI:10.3760/cma.j.issn.1004-4221.2014.02.001 |
| [11] |
Wang W. Radiotherapy in the management of early breast cancer[J]. J Med Radiat Sci, 2013, 60(1): 40-46. DOI:10.1002/jmrs.1 |
| [12] |
Dragun AE, Pan J, Rai SN, et al. Locoregional recurrence in patients with triple-negative breast cancer:preliminary results of a single institution study[J]. Am J Clin Oncol, 2011, 34(3): 231-237. DOI:10.1097/COC.0b013e3181dea993 |
| [13] |
Singletary SE, Connolly JL. Breast cancer staging:working with the sixth edition of the AJCC Cancer Staging Manual[J]. CA Cancer J Clin, 2006, 56(1): 37-47. DOI:10.3322/canjclin.56.1.37 |
| [14] |
Qiao XY, Song YZ, Geng CZ, et al. The value of radiotherapy in patients with T1 and T2 breast cancer with one to three positive nodes after modified radical mastectomy[J]. Chin J Cancer, 2010, 29(4): 436-440. DOI:10.5732/cjc.009.10557 |
| [15] |
Liu D, Chen Y, Deng M, et al. Lymph node ratio and breast cancer prognosis:a meta-analysis[J]. Breast Cancer, 2014, 21(1): 1-9. DOI:10.1007/s12282-013-0497-8 |
| [16] |
邢鹏, 李继光, 金锋. 淋巴结转移率与乳腺癌预后关系的研究[J]. 中国医科大学学报, 2015, 44(4): 357-361. Xing P, Li JG, Jin F. The prognostic significance of lymph node metastasis ratein breast cancer[J]. J Chin Med Univ, 2015, 44(4): 357-361. DOI:10.12007/j.issn.0258-4646.2015.04.015 |
| [17] |
Webber-Foster R, Kvizhinadze G, Rivalland G, et al. Cost-effectiveness analysis of docetaxel versus weekly paclitaxel in adjuvant treatment of regional breast cancer in New Zealand[J]. Pharmacoeconomics, 2014, 32(7): 707-724. DOI:10.1007/s40273-014-0154-x |
| [18] |
Han JS, Cao D, Molberg KH, et al. Hormone receptor status rather than HER2 status is significantly associated with increased Ki-67 and p53 expression in triple-negative breast carcinomas, and high expression of Ki-67 but not p53 is significantly associated with axillary nodal metastasis in triple-negative and high-grade non-triple-negative breast carcinomas[J]. Am J Clin Pathol, 2011, 135(2): 230-237. DOI:10.1309/AJCP9DV3EVZUATFV |
| [19] |
Sabiani L, Houvenaeghel G, Heinemann M, et al. Breast cancer in young women:Pathologic features and molecular phenotype[J]. Breast, 2016, 29: 109-116. DOI:10.1016/j.breast.2016.07.007 |
| [20] |
Loibl S, Jackisch C, Lederer B, et al. Outcome after neoadjuvant chemotherapy in young breast cancer patients:a pooled analysis of individual patient data from eight prospectively randomized controlled trials[J]. Breast Cancer Res Treat, 2015, 152(2): 377-387. DOI:10.1007/s10549-015-3479-z |
| [21] |
Iwase H, Kurebayashi J, Tsuda H, et al. Clinicopathological analyses of triple negative breast cancer using surveillance data from the Registration Committee of the Japanese Breast Cancer Society[J]. Breast Cancer, 2010, 17(2): 118-124. DOI:10.1007/s12282-009-0113-0 |
| [22] |
Moo TA, McMillan R, Lee M, et al. Impact of molecular subtype on locoregional recurrence in mastectomy patients with T1-T2 breast cancer and 1-3 positive lymph nodes[J]. Ann Surg Oncol, 2014, 21(5): 1569-1574. DOI:10.1245/s10434-014-3488-x |
| [23] |
Huang CJ, Hou MF, Chuang HY, et al. Comparison of clinical outcome of breast cancer patients with T1-2 tumor and one to three positive nodes with or without postmastectomy radiation therapy[J]. Jpn J Clin Oncol, 2012, 42(8): 711-720. DOI:10.1093/jjco/hys080 |
 2018, Vol. 38
2018, Vol. 38


