据报道2014年全球约有78.2万例新发肝细胞癌(hepatocellular carcinoma,HCC)病例和74.5万死亡病例[1],其中我国新发病例和死亡病例占了约50%[2-3]。由于其高转移和抵抗治疗特性,患者手术切除、化疗、放疗后复发率仍居高不下,因此需要寻找新的预后因子和治疗靶标。GRAMD1A是一个新发现的基因,其首先在人胚胎干细胞中被发现,且在外胚层、中胚层、内胚层组织及许多肿瘤细胞中均表达[4],但其在各种疾病发生发展中的功能尚未被完全阐明。最近研究报道,GRAMD1A在HCC组织中表达上调,其表达与HCC病理分化程度和生存状态呈显著正相关,高表达GRAMD1A的患者预后差,可作为HCC患者的独立预后因素;且过表达GRAMD1A可促进HCC干细胞自我更新、抵抗药物治疗和促进肿瘤生长[1]。然而,沉默GRAMD1A是否会通过STAT5通路增加肝癌细胞放射敏感性仍然未知。本研究通过慢病毒感染方法构建稳定沉默GRAMD1A的Huh7细胞株,研究沉默GRAMD1A后Huh7细胞对放射敏感性的影响,进一步揭示GRAMD1A在HCC发展和治疗中的作用,为临床靶向与联合治疗HCC提供新靶点。
材料与方法1.细胞培养和稳转株构建:肝癌Huh7细胞和293T细胞购自中科院上海细胞所,两株细胞均在含有1%的10 000 U/ml青霉素链霉素混合溶液,10%胎牛血清的DMEM(美国GIBCO公司)培养基中,于37℃,5% CO2饱和湿度培养箱中培养。GRAMD1A shRNA(GCGGCATTGAAGACTATTTCC)和阴性对照shRNA由上海生工生物有限公司合成并克隆至慢病毒载体pLKO.1-puro载体中,用293T细胞进行慢病毒包装,分别记为沉默GRAMD1A慢病毒和阴性对照慢病毒。利用上述慢病毒分别感染Huh7细胞,并用0.5 mg/ml嘌呤霉素筛选获得稳定沉默GRAMD1A的Huh7细胞株,分别记为沉默GRAMD1A组和阴性对照组,以不作任何处理的细胞为空白对照组。
2. Western blot检测:处理细胞用RIPA裂解获得总蛋白,12% SDS-PAGE电泳分离蛋白并转至PVDF膜,GRAMD1A抗体(美国Sigma公司)、GAPDH(上海碧云天生物技术有限公司)一抗稀释液孵育条带,用化学发光液ECL于Western blot仪(美国Bio-Rad公司)上显影,后用Image J软件进行蛋白相对定量。
3. qPCR检测:用TRIzol提取总RNA,Script Ⅱ反转录试剂盒(美国Invitrogen公司)进行反转录,2xSYBR green master mix(美国Applied Biosystems公司)于ABI Prism 7500 qPCR仪(美国Applied Biosystems公司)上进行基因相对表达检测,以GAPDH为内参,用2-ΔΔCt法来计算基因相对表达量。基因引物见表 1。
|
|
表 1 qPCR引物序列 Table 1 The sequence of qPCR primer |
4.克隆形成检测:取处理后细胞以3 000个/2 ml接种于6孔板中,过夜贴壁后,接受不同剂量(0、2、4、6、8 Gy)X射线照射,然后置于37℃、5% CO2饱和湿度细胞培养箱中继续培养,14 d后取出,弃去旧培养液,磷酸盐缓冲液(PBS)洗3次,甲醇固定10 min,晾干后0.1%结晶紫染色,于显微镜下观察并拍照,计数各孔克隆数,只计单个多于50个细胞的克隆。照射条件为6 MV光子线,源靶距(SSD) 100 cm,照射野10 cm×10 cm,照射剂量2 Gy,剂量率5 Gy/min,射野覆盖全细胞培养板。以感染阴性对照慢病毒的Huh7细胞为阴性对照组,以感染阴性对照慢病毒并照射的Huh7细胞为阴性对照联合照射组,以感染沉默GRAMD1A慢病毒的Huh7细胞为沉默GRAMD1A组,以感染沉默GRAMD1A慢病毒并照射的Huh7细胞记为沉默GRAMD1A联合照射组。
另取对数生长期Huh7细胞,以3 000/2 ml接种于6孔板中,过夜贴壁后分为4组,SH-4-54抑制剂组加入10 μmol/L的二甲基亚砜溶解的SH-4-54抑制剂处理;二甲基亚砜组单纯加入10 μmol/L的二甲亚砜;二甲基亚砜联合照射组为10 μmol/L二甲亚砜+2 Gy照射处理;SH-4-54抑制剂联合照射组为加10 μmol/L的二甲基亚砜溶解的SH-4-45抑制剂+2 Gy照射处理。4组置于37℃、5% CO2的细胞培养箱中继续培养,14 d后取出于显微镜下观察并拍照,计数各孔克隆数。
5.细胞凋亡检测:用不含EDTA的胰蛋白酶消化收集细胞,冷的PBS洗涤2次,取1×105个细胞加入100 μl的结合缓冲液(Binding Buffer)重悬细胞,然后加入5 μl Annexin V-PE和5 μl 7-AAD(美国BD公司)混匀,室温避光孵育15 min,于流式细胞仪检测。
6.荧光素酶报告分析:用PCR法从293T细胞基因组DNA中扩增STAT5启动子序列,并将其克隆到psi-CHECK2载体(美国Promega公司)中,用lipofectamine 2000(美国Invitrogen公司)将GRAMD1A的siRNA(广州锐博公司)与报告载体共转染至细胞中,48 h后用Dual Luciferase Assay(美国Promega公司)试剂盒测量细胞中萤光素酶活性。
7.统计学处理:采用SPSS22.0进行统计学分析,实验数据用均数标准差(x±s)表示,两组数据呈正态分布采用独立样本t检验,不呈正态分布采用非参数秩和检验,多组差异比较采用单因素方差分析,组间比较采用LSD-t检验。以P < 0.05为差异有统计学意义。
结果1.构建稳定敲减GRAMD1A的Huh7细胞株:采用慢病毒感染进行稳定沉默GRAMD1A的Huh7细胞株构建。经嘌呤霉素筛选后,qPCR和Western blot检测发现,空白对照组、阴性对照组和沉默GRAMD1A组的GRAMD1A mRNA相对表达量分别为0.98±0.12、1.04±0.07、0.15±0.05,蛋白表达量分别为0.90±0.06、0.89±0.09、0.29±0.05,沉默GRAMD1A组GRAMD1A的mRNA和蛋白水平显著低于其他各组,差异均有统计学意义(F=102.151、77.345,P < 0.05)。稳定沉默GRAMD1A的Huh7稳转株构建成功。
2.沉默GRAMD1A对Huh7细胞放射敏感性的影响:放疗后存活分数分析得知,阴性对照组联合照射后SF2、D0、Dq分别为82.50、2.030、2.672;沉默GRAMD1A组联合照射后SF2、D0、Dq则分别为52.04、1.332、1.425,沉默GRAMD1A组联合照射后SER为1.524,且沉默GRAMD1A组联合照射后较阴性对照组联合照射后的肩区缩小,各剂量点Huh7的存活分数均显著降低(图 1)。经2 Gy照射后,克隆形成实验发现沉默GRAMD1A联合照射组细胞克隆形成能力较阴性对照联合照射组显著降低,差异有统计学意义(t=8.494,P < 0.05);流式细胞仪检测发现沉默GRAMD1A联合照射组细胞凋亡较阴性对照联合照射组显著增加,差异有统计学意义(t=3.560,P < 0.05),见表 2。由上述结果可知,沉默GRAMD1A可增加Huh7细胞的放射敏感性。
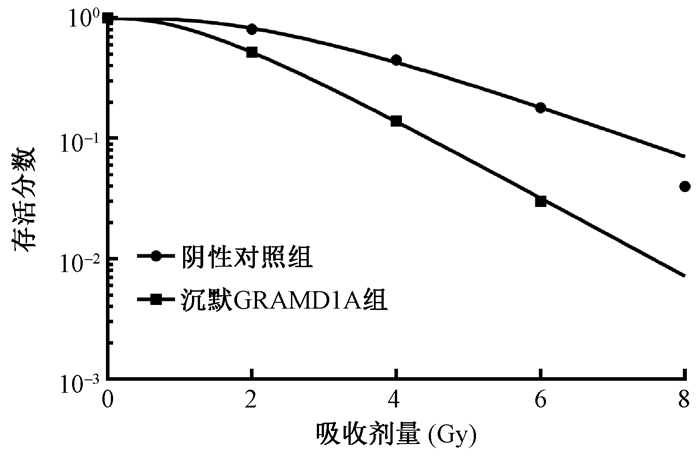
|
图 1 不同剂量照射处理后Huh7细胞的存活曲线 Figure 1 Survival curves of Huh7 cells at different doses |
|
|
表 2 沉默GRAMD1A联合2 Gy照射对Huh7细胞克隆形成能力和凋亡的影响(%,x±s) Table 2 Effect of silencing GRAMD1A combined with 2Gy irradiation on the colony formation and apoptosis of Huh7 cells(%, x±s) |
3.沉默GRAMD1A对Huh7细胞STAT5及其下游基因表达影响:利用qPCR检测沉默GRAMD1A后,STAT5及其下游Cyclin D1、Bcl2、c-Jun、c-Myc的表达。结果发现,STAT5及其下游Cyclin D1、Bcl2、c-Jun、c-Myc的表达均显著下调(t=5.260、21.087、12.399、26.045、12.433,P < 0.05)。将STAT5的启动子克隆到psi-CHECK2报告载体中,检测发现沉默GRAMD1A可显著降低其萤光素酶活性(t=24.942,P < 0.05),见表 3。上述结果表明,GRAMD1A通过影响STAT5及其下游基因表达来发挥作用。
|
|
表 3 沉默GRAMD1A对Huh7细胞STAT5及其下游基因表达影响(%,x±s) Table 3 Effect of silencing GRAMD1A on the expression of STAT5 and its downstream genes in Huh7 cells(%, x±s) |
4.抑制STAT5对Huh7细胞放敏感性的影响:使用STAT5抑制剂SH-4-54来抑制STAT5通路活性,研究其对Huh7细胞放化疗敏感性的影响。结果发现,SH-4-54抑制剂联合照射组较二甲基亚砜联合照射组细胞克隆存活能力显著降低,差异有统计学意义(t=8.660,P < 0.05,表 4),与沉默GRAMD1A一致结果,表明GRAMD1A可通过STAT5通路来增加肝癌细胞对放射的抵抗作用。
|
|
表 4 STAT5抑制剂SH-4-54联合2 Gy照射对Huh7细胞克隆形成的影响(%,x±s) Table 4 Effect of STAT5 inhibitor SH-4-54 combined with 2 Gy irradiation on the colony formation of Huh7 cells(%, x±s) |
讨论
肝细胞癌(HCC)是一种常见的恶性肿瘤,是导致癌症相关死亡的第二大主要原因[5]。目前,手术是治疗HCC最有效的治疗方法,但只有大约10%~15%的病例可进行手术治疗,并且手术后肿瘤常常复发并转移到其他器官,其5年生存率仅为5%~10%[6-8]。对局部晚期肝癌来说,放疗是一种有效的治疗方法,但由于肝脏及其周围组织对放射耐受性较差,其临床应用常常受到限制[9]。随着新的放射治疗技术的应用,如调强放疗(IMRT),影像引导放射治疗(IGRT)和三维适形放疗(3D-CRT),放射性肝损伤已适度减少,但技术改进对于疗效比较有限[5]。因此,开发一种有效的放射增敏剂来增强肝癌细胞的放射敏感性对于放射治疗HCC具有重要作用。
最近研究报道,GRAMD1A在HCC组织中表达上调,其表达与HCC病理分化程度和生存状态呈显著正相关,高表达GRAMD1A的患者预后差,其可作为HCC患者的独立预后因素。在肝癌细胞HepG2和Huh7中,过表达GRAMD1A可通过激活STAT5信号促进HCC干细胞自我更新、抵抗药物治疗和促进肿瘤生长[1]。然而,沉默GRAMD1A是否会增加肝癌细胞的放射敏感性尚不清楚。本研究发现沉默GRAMD1A联合2 Gy照射后与单独2 Gy照射相比,Huh7细胞存活率显著降低,凋亡率显著增加,沉默GRAMD1A确实会增加肝癌细胞的放射敏感性。
先前研究表明,STAT5具有两种亚型,分别为STAT5A和STAT5B,其在正常和恶性细胞中均起重要作用,其中Jak2可将其磷酸化,进而导致其转位至细胞核来调节其靶基因转录[10-11]。据报道,STAT5增加雄激素受体的稳定性,促进去势抵抗性前列腺癌生长、肿瘤转移以及前列腺癌干细胞的自我更新[12]。然而,几个关于STAT5在HCC进展中作用的实验研究结果是矛盾的。Hosui等[13]发现,在敲除STAT5的小鼠中,CCl4通过增加TGF-β稳定性和STAT3活性诱导肝癌发生,同时,他们还发现STAT5对于生长激素诱导的NOX4表达是必不可少的,反过来又会诱导ROS产生和促凋亡蛋白PUMA、BIM的表达[14]。其他研究发现,在生长激素信号超活化的小鼠中,STAT5缺失促进了肝癌发生[15]。上述研究均表明STAT5在HCC中作为肿瘤抑制因子发挥功能。然而,有研究发现,在HCC细胞SMMC7721中,敲减STAT5可抑制细胞增殖并诱导凋亡[16]。
本研究发现,沉默GRAMD1A后STAT5及其下游基因Cyclin D1、Bcl-2、c-Jun和c-Myc显著下调,同时其启动子活性也显著降低。此外,用STAT抑制剂SH-4-54抑制STAT5活性可显著增加肝癌细胞Huh7的放射敏感性,得到与沉默GRAMD1A一致结果,表明STAT5是一个癌基因,其在HCC中的作用可能与特定微环境有关。综上所述,沉默GRAMD1A能够通过抑制STAT5信号通路转导增强肝癌细胞Huh7的放射敏感性,提示GRAMD1A在肝癌发生发展中起重要作用,其可成为肝癌靶向治疗及联合治疗的新靶标。
利益冲突 所有作者均于投稿前阅读并认可本研究内容,不存在任何潜在的利益冲突,承诺无一稿多投作者贡献声明 王伟负责课题的设计、实施和论文撰写;柯善保和刘明博负责实验数据收集及统计学分析;李白羽和王朝杰负责部分实验实施和论文审校
| [1] |
Fu B, Meng W, Zhao H, et al. GRAM domain-containing protein 1A (GRAMD1A) promotes the expansion of hepatocellular carcinoma stem cell and hepatocellular carcinoma growth through STAT5[J]. Sci Rep, 2016, 6: 31963. DOI:10.1038/srep31963 |
| [2] |
Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [3] |
高志强, 汪俊峰, 陈德华, 等. Girdin基因在肝癌细胞表达及抑制其表达的生物学特性[J]. 中华实验外科杂志, 2017, 34(12): 2109-2112. Gao ZQ, Wang JF, Chen DH, et al. Expression of Girdin gene in hepatocellular carcinoma cells and inhibition of its expression on biological characteristics[J]. Chin J Exp Surg, 2017, 34(12): 2109-2112. DOI:10.3760/cma.j.issn.1001-9030.2017.12.029 |
| [4] |
Song X, Wang S, Gu B, et al. Production and characterization of a monoclonal antibody against GRAM domain-containing protein 1A[J]. Monoclon Antib Immunodiagn Immunother, 2014, 33(4): 246-253. DOI:10.1089/mab.2014.0001 |
| [5] |
Xu G, Zhu L, Wang Y, et al. Stattic enhances radiosensitivity and reduces radio-induced migration and invasion in HCC cell lines through an apoptosis pathway[J]. Biomed Res Int, 2017, 2017: 1832494. DOI:10.1155/2017/1832494 |
| [6] |
Kalyan A, Nimeiri H, Kulik L. Systemic therapy of hepatocellular carcinoma:current and promising[J]. Clin Liver Dis, 2015, 19(2): 421-432. DOI:10.1016/j.cld.2015.01.009 |
| [7] |
Wang C, Wang H, Yang W, et al. Multicenter randomized controlled trial of percutaneous cryoablation versus radiofrequency ablation in hepatocellular carcinoma[J]. Hepatology, 2015, 61(5): 1579-1590. DOI:10.1002/hep.27548 |
| [8] |
Xiao Q, Qu K, Wang C, et al. HDGF-related protein-3 is required for anchorage-independent survival and chemoresistance in hepatocellular carcinomas[J]. Gut, 2013, 62(3): 440-451. DOI:10.1136/gutjnl-2011-300781 |
| [9] |
Sharma H. Role of external beam radiation therapy in management of hepatocellular carcinoma[J]. J Clin Exp Hepatol, 2014, 4(Suppl 3): S122-125. DOI:10.1016/j.jceh.2014.05.002 |
| [10] |
Heltemes-Harris LM, Farrar MA. The role of STAT5 in lymphocyte development and transformation[J]. Curr Opin Immunol, 2012, 24(2): 146-152. DOI:10.1016/j.coi.2012.01.015 |
| [11] |
Kanai T, Seki S, Jenks JA, et al. Identification of STAT5A and STAT5B target genes in human T cells[J]. PLoS One, 2014, 9(1): E86790. DOI:10.1371/journal.pone.0086790 |
| [12] |
Talati PG, Gu L, Ellsworth EM, et al. Jak2-Stat5a/b signaling induces epithelial-to-mesenchymal transition and stem-like cell properties in prostate cancer[J]. Am J Pathol, 2015, 185(9): 2505-2522. DOI:10.1016/j.ajpath.2015.04.026 |
| [13] |
Hosui A, Kimura A, Yamaji D, et al. Loss of STAT5 causes liver fibrosis and cancer development through increased TGF-β and STAT3 activation[J]. J Exp Med, 2009, 206(4): 819-831. DOI:10.1084/jem.20080003 |
| [14] |
Yu JH, Zhu BM, Riedlinger G, et al. The liver-specific tumor suppressor STAT5 controls expression of the reactive oxygen species-generating enzyme NOX4 and the proapoptotic proteins PUMA and BIM in mice[J]. Hepatology, 2012, 56(6): 2375-2386. DOI:10.1002/hep.25900 |
| [15] |
Friedbichler K, Themanns M, Mueller KM, et al. Growth-hormone-induced signal transducer and activator of transcription 5 signaling causes gigantism, inflammation, and premature death but protects mice from aggressive liver cancer[J]. Hepatology, 2012, 55(3): 941-952. DOI:10.1002/hep.24765 |
| [16] |
Zhang L, Zhao Z, Feng Z, et al. RNA interference-mediated silencing of Stat5 induces apoptosis and growth suppression of hepatocellular carcinoma cells[J]. Neoplasma, 2012, 59(3): 302-309. DOI:10.4149/neo_2012_039 |
 2018, Vol. 38
2018, Vol. 38
