2. 730000 兰州, 中国科学院近代物理研究所空间辐射生物研究室
2. Department of Space Radiobiology, Institute of Modern Physics, Chinese Academy of Sciences, Lanzhou 730000, China
1993年Marples和Joiner[1]在对X射线照射后的仓鼠V79-379 A细胞存活的研究中发现,辐射剂量 < 1 Gy时细胞辐射敏感性增强的现象,并将其命名为低剂量辐射超敏感性(low dose hyper-radiosensitivity,HRS),同时把HRS之后出现较低的辐射敏感性命名为辐射抗性增强(increased radioresistance,IRR)。迄今40余种细胞被证实存在HRS现象[1-2]。HRS的发现在放化疗结合、放疗的低剂量分割以及分次超低剂量分割等方面意义重大[3-6]。目前关于HRS的机制并不是非常清楚,已有的研究表明其与细胞凋亡、自噬、细胞周期调控以及细胞DNA损伤等密切相关。DNA-PK作为DNA损伤修复和细胞周期调控过程中的关键激酶之一[7-9],其在HRS中的作用机制尚不明确。本研究以DNA-PKcs基因型不同的两株细胞M059J(DNA-PKcs突变型)和M059K(DNA-PKcs野生型)为研究对象,探究DNA-PKcs在辐射诱导神经胶质瘤细胞HRS中可能的机制。
材料与方法1.材料:人神经胶质瘤细胞系M059J和M059K为本实验室保存。胎牛血清、青霉素-链霉素混合液、DMEM高糖培养基均购于美国GIBCO公司。Trypsin-EDTA混合液、二喹啉甲醛(BCA)蛋白定量试剂盒均购于上海碧云天生物技术公司。结晶紫(crystal violet)购于安徽BioSHARP生物科技公司。γ-H2AX、Chk1、Chk2、p-Chk1、p-Chk2抗体购于美国CST公司。b-肌动蛋白抗体、HRP标记的山羊抗鼠IgG、HRP标记的山羊抗兔IgG、Alex Fluor 555二抗和一抗稀释液均购于上海碧云天生物技术公司。
2.细胞培养与照射:M059K和M059J细胞用含10%胎牛血清的DMEM高糖全培养基于5% CO2、37℃恒温饱和湿度培养箱中培养。X射线照射采用美国RAD SOURCE RS-2000 X射线辐照仪,剂量率为1.2 Gy/min,细胞均培养于直径60 mm的平皿进行照射。
3.细胞克隆形成实验以及存活曲线的绘制:取对数生长期的两种细胞分别按照不同的照射剂量组接种,待接种完成后用X射线照射后置于37℃恒温饱和湿度培养箱中培养14 d,取出细胞固定染色后计数细胞克隆的数目,克隆形成率(PE)=照射后克隆数/接种细胞数×100%,存活分数=照射组PE/对照组PE。重复3次实验后,按照线性平方模型存活分数(SF)=exp(-m1×M0-m2×M02)拟合存活曲线。式中,M0为细胞的受照剂量,Gy;m1、m2分别为单击、双击所致细胞死亡的常数,按文献[10]方法计算得出。
4.蛋白质免疫印迹技术:提取总蛋白并定量,进行聚丙烯酰胺凝胶电泳(SDS-PAGE)。将蛋白转至聚偏二氟乙烯膜(PVDF膜)上,用5%脱脂牛奶室温封闭2 h,4℃孵育一抗过夜,磷酸盐吐温缓冲液(PBS-T)清洗后室温孵育二抗1 h,再次洗膜后加入显影液显影,用化学发光成像系统显影成像、拍照。实验后采用Image J软件进行灰度定量分析。实验重复3次。
5. γ-H2AX焦点形成实验:取受照后1 h的细胞用4%多聚甲醛固定后冰乙醇-20℃过夜保存,第2天取出,以0.1% Triton X-100进行打孔,20 min后以5%脱脂奶粉封闭1 h,一抗室温2 h,荧光Alex Fluor 555二抗室温避光孵育1.5 h,封片后用扫描型激光共聚焦显微镜拍照,统计γ-H2AX焦点的数量。实验重复3次,取其均值。
6.微核形成实验:取对数生长期的细胞接种于直径为35 mm的平皿中,每个平皿内接种104个细胞,根据不同的处理方式处理细胞,制片并用新鲜配置的姬姆萨染色液进行染色,将玻片标本放在倒置荧光显微镜下观察,并计数微核数目。实验重复3次,取其均值。
7.统计学处理:用SPSS16.0进行数据录入和统计分析,结果用x±s表示。不同组间比较方差齐性检验后采用方差分析,同一指标两组间比较,经正态性检验后符合正态分布,两组间比较采用t检验,P < 0.05为差异有统计学意义。
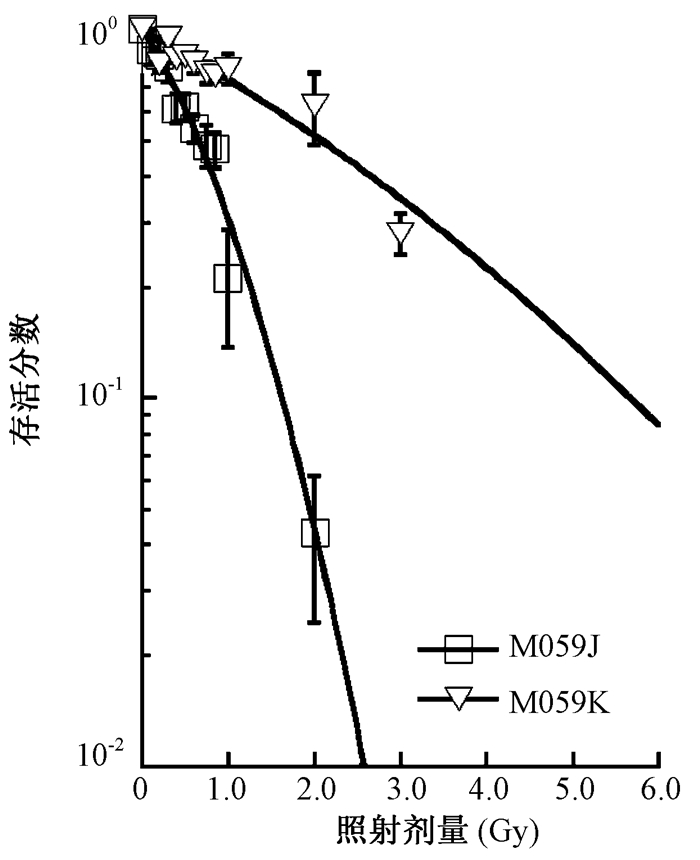
结果1.细胞存活曲线:如图 1所示,M059K细胞在0.2和0.4 Gy的实际存活率低于存活曲线上的拟合值,提示M059K细胞在0~0.5 Gy的剂量区间内存在HRS/IRR,而M059J细胞在相同剂量区间内未见HRS/IRR。
|
图 1 M059K和M059J细胞的存活曲线 Figure 1 Survival curves of M059K and M059J cells |
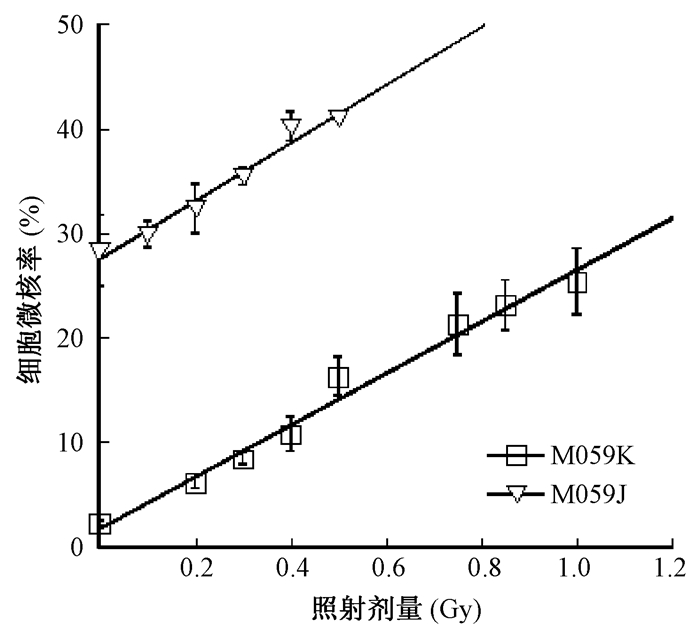
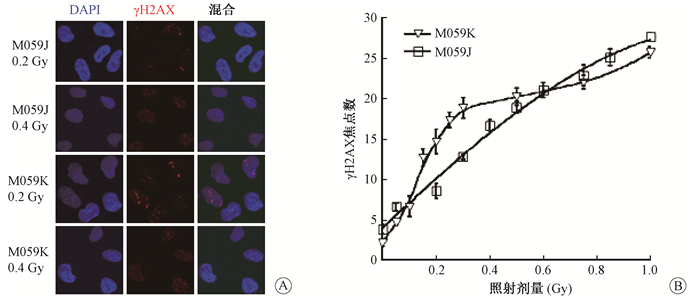
2.细胞实验微核实验和gH2AX焦点形成实验:微核实验的结果示于图 2。由图 2可见,两种细胞在0~1 Gy受照后微核率与拟合值一致。γ-H2AX焦点形成实验的结果用单位细胞中的γ-H2AX焦点数量随照射剂量的变化表示并进行拟合两种细胞在0~1 Gy的剂量区间内γ-H2AX焦点数量均符合拟合值,见图 3。上述结果提示DNA损伤水平不能用于表征低剂量区的HRS/IRR。
|
图 2 两种细胞受照后1h细胞微核实验 Figure 2 Dose response of micronucleus induction in two cell lines at 1 h post-irradiation |
|
图 3 两种细胞受照后1 hγ-H2AX焦点形成 A.免疫荧光染色;B.定量分析 Figure 3 Dose response of γ-H2AX foci formation in two cell lines at 1 h post-irradiation A. Immunofluorescence staining; B. Quantitative analysis |
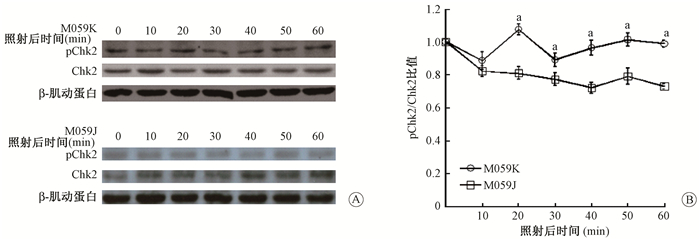
3.Chk1和Chk2的表达检测:经0.2 Gy的X射线照射后20~60 min内,Western blot结果见图 4,5。由图 4可见,受照后20、30、40、50、60 min,M059K细胞与M059J细胞中pChk1/Chk1均显著增加(t=14.157、13.661、14.177、11.317、14.512,P<0.05)。提示经0.2 Gy X照射后M059K细胞中Chk1激酶的活化增强。
|
图 4 Chk1蛋白表达的检测 A.照射后不同时间pChk1和Chk1蛋白的表达变化;B.灰度定量分析pChk1/ Chk1比值 注:a与0 min组相比,t=14.157、13.661、14.177、11.317、14.512,P<0.05 Figure 4 Expressions of Chk1 protein in two cell lines after irradiation A. Expressions of pChk1 and total Chk1 detected by Western blot; B. Quantitative analysis of pChk1/Chk1 by gray scale values |
|
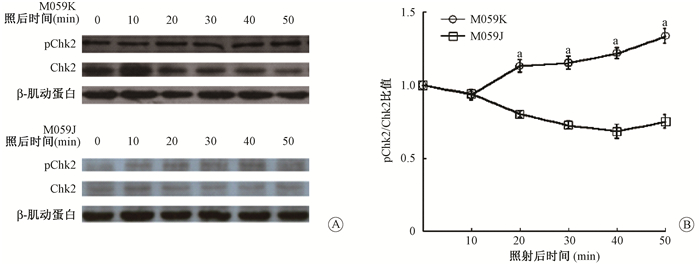
图 5 Chk2蛋白表达的检测 A.照射后不同时间检测pChk2和Chk2蛋白的表达变化;B.灰度定量分析pChk2/ Chk2比值 注:a与0 min相比,t=13.182、13.868、14.155、14.477,P < 0.05 Figure 5 Expressions of Chk2 protein in two cell lines after irradiation A. Expressions of pChk2 and total Chk2 detected by Western blot; B. Quantitative analysis of pChk2/Chk2 by gray scale values |
由图 5可见,经0.2 Gy的X射线照射后20~50 min内,Western blot结果显示M059K细胞中Chk2激酶的磷酸化水平呈升高趋势,而在相同时间内M059J细胞中Chk2激酶的磷酸化水平则呈降低趋势;经0.2 Gy的X射线照后20、30、40、50 min,M059K细胞与M059J细胞中pChk2/Chk2均显著增加(t=13.182、13.868、14.155、14.477,P<0.05)。提示经0.2 Gy X射线照射后M059K细胞中Chk2激酶的活化增强。
讨论在辐射生物学效应研究中,HRS/IRR一直备受关注,无论是体外细胞实验还是在体研究均发现了HRS/IRR现象的存在[11-12]。Krueger等[13]发现在淋巴细胞中HRS与p53依赖的细胞凋亡有关;Wang等[14]发现在肺癌细胞中自噬可以通过调控MLH1来影响HRS;Xue等[15]发现在肝癌细胞中HRS和G2/M期检验点相关。Marples等[16]发现DNA依赖性蛋白激酶(DNA-dependent protein kinase,DNA-PK)参与HRS的形成。其对于低剂量辐射生物学效应的确定及低剂量辐射风险评估有着不言而喻的意义。同时,HRS/IRR在临床肿瘤放疗中具有良好的应用前景及重要的指导意义。为了实现最大化肿瘤组织的损伤以及最小化正常组织的损伤并兼顾肿瘤的早、晚期反应性,临床中常将放疗的时间和总剂量进行分割,基本分为两种分割方式:其一是常规分割(conventional fractionation,CF);其二是非常规分割,又可以细分为加速放疗(accelerated radiotherapy,AR)、大分割、超分割(hyper-fraction,HF)、加速超分割(accelerated hyper-fraction,AHF),后两种分割方式单次照射的剂量均较小,故低剂量HRS/IRR有望应用于优化临床肿瘤放疗剂量分割。然而,如何解决“靶区组织的特异性”以及分次的次数和间隔时间的问题,需对低剂量HRS/IRR的机制进行更深入的研究。
关于HRS/IRR机制的探讨主要集中在细胞周期以及DNA损伤这两个方面。本研究证实了在DNA-PKcs野生型的M059K细胞中存在着低剂量HRS/IRR的现象,而在DNA-PKcs突变的M059J细胞中则没有这种现象,这与本组前期研究结果一致[17]。由于γ-H2AX被认为是DNA损伤的标志[18-19],微核实验与γ-H2AX焦点形成实验的结果提示DNA损伤不可以用于表征HRS/IRR。考虑到细胞周期也很有可能是影响DNA-PKcs介导HRS/IRR的原因之一,本研究利用Western blot技术检测了细胞周期检验点相关蛋白的表达水平,发现经0.2 Gy的X射线照射后M059K细胞比DNA-PKcs突变的M059J细胞中pChk1/Chk1、pChk2/Chk2的比值显著增高。这一结果表明经0.2 Gy的X射线照射后M059K细胞激活了G2/M期检验点相关蛋白Chk1与Chk2。这有可能是DNA-PKcs介导产生低剂量HRS/IRR的原因之一,详细机制还有待进一步研究。如前所述,DNA-PKcs是影响细胞周期的重要蛋白之一,Chk1与Chk2在G2/M期检验点的通路中发挥重要作用。随着DNA-PKcs在细胞G2/M期检验点研究的不断深入,DNA-PKcs与Chk1、Chk2相关的更多研究被相继的报道出来,比如Shang等[20]发现在有丝分裂中DNA-Pkcs是导致Chk2活化的必要原因之一,Tu等[21]证实了DNA-PKcs失活的细胞中Chk2的磷酸化水平也将显著降低。上述实验均可以说明DNA-PKcs是导致Chk2活化的原因之一。结合本实验的结果,不难得出Chk1和Chk2的活化是神经胶质瘤M059K细胞中DNA-PKcs介导产生低剂量HRS/IRR的机制之一。
利益冲突 本文研究者及家属,未因进行该研究而接受任何不正当的职务或经费利益,在此对研究的独立性和科学性予以保证作者贡献声明 马季负责蛋白免疫印迹实验和撰写论文; 叶才勇负责克隆存活实验; 丁楠和朱佳赟负责DNA损伤检测,胡文涛负责实验设计及论文修改
| [1] |
Marples B, Joiner MC. The response of Chinese hamster V79 cells to low radiation doses:evidence of enhanced sensitivity of the whole cell population[J]. Radiat Res, 1993, 133(1): 41-51. DOI:10.2307/3578255 |
| [2] |
Short SC, Woodcock M, Marples B, et al. Effects of cell cycle phase on low-dose hyper-radiosensitivity[J]. Int J Radiat Biol, 2003, 79(2): 99-105. DOI:10.1080/0955300021000045646 |
| [3] |
Dey S, Spring PM, Arnold S, et al. Low-dose fractionated radiation potentiates the effects of Paclitaxel in wild-type and mutant p53 head and neck tumor cell lines[J]. Clin Cancer Res, 2003, 9(4): 1557-1565. |
| [4] |
Spring PM, Arnold SM, Shajahan S, et al. Low dose fractionated radiation potentiates the effects of taxotere in nude mice xenografts of squamous cell carcinoma of head and neck[J]. Cell Cycle, 2004, 3(4): 479-485. |
| [5] |
Adkison JB, Tomé W, Seo S, et al. Reirradiation of large-volume recurrent glioma with pulsed reduced-dose-rate radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2011, 79(3): 835-841. DOI:10.1016/j.ijrobp.2009.11.058 |
| [6] |
Cannon GM, Tomé WA, Robins HI, et al. Pulsed reduced dose-rate radiotherapy:case report:a novel re-treatment strategy in the management of recurrent glioblastoma multiforme[J]. J Neurooncol, 2007, 83(3): 307-311. DOI:10.1007/s11060-007-9329-z |
| [7] |
Davis AJ, Chen BP, Chen DJ. DNA-PK:a dynamic enzyme in a versatile DSB repair pathway[J]. DNA Repair (Amst), 2014, 17: 21-29. DOI:10.1016/j.dnarep.2014.02.020 |
| [8] |
Finzel A, Grybowski A, Strasen J, et al. Hyperactivation of ATM upon DNA-PKcs inhibition modulates p53 dynamics and cell fate in response to DNA damage[J]. Mol Biol Cell, 2016, 27(15): 2360-2367. DOI:10.1091/mbc.E16-01-0032 |
| [9] |
Nagasawa H, Lin YF, Kato TA, et al. Coordination of the Ser2056 and Thr2609 Clusters of DNA-PKcs in regulating gamma rays and extremely low fluencies of alpha-particle irradiation to G0/G1phase cells[J]. Radiat Res, 2017, 187(2): 259-267. DOI:10.1667/RR14679.1 |
| [10] |
Zhu J, Hu W, Ding Nan, et al. An optimized colony forming assay for low-dose-radiation cell survival measurement[J]. Int Res J Biotechn, 2011, 2(8): 164-172. |
| [11] |
Gordon JJ, Snyder K, Zhong H, et al. Extracting the normal lung dose-response curve from clinical DVH data:a possible role for low dose hyper-radiosensitivity, increased radioresistance[J]. Phys Med Biol, 2015, 60(17): 6719-6732. DOI:10.1088/0031-9155/60/17/6719 |
| [12] |
Nguyen DM, Parekh PR, Chang ET, et al. Contribution of dual oxidase 2(DUOX2) to hyper-radiosensitivity in human gastric cancer cells[J]. Radiat Res, 2015, 184(2): 151-160. DOI:10.1667/RR13661.1 |
| [13] |
Krueger SA, Joiner MC, Weinfeld M, et al. Role of apoptosis in low-dose hyper-radiosensitivity[J]. Radiat Res, 2007, 167(3): 260-267. DOI:10.1667/RR0776.1 |
| [14] |
Wang Q, Xiao Z, Lin Z, et al. Autophagy influences the low-dose hyper-radiosensitivity of human lung adenocarcinoma cells by regulating MLH1[J]. Int J Radiat Biol, 2017, 93(6): 600-606. DOI:10.1080/09553002.2017.1286052 |
| [15] |
Xue J, Zong Y, Li PD, et al. Low-dose hyper-radiosensitivity in human hepatocellular HepG2 cells is associated with Cdc25C-mediated G2/M cell cycle checkpoint control[J]. Int J Radiat Biol, 2016, 92(10): 543-547. DOI:10.1080/09553002.2016.1206235 |
| [16] |
Marples B, Cann NE, Mitchell CR, et al. Evidence for the involvement of DNA-dependent protein kinase in the phenomena of low dose hyper-radiosensitivity and increased radioresistance[J]. Int J Radiat Biol, 2002, 78(12): 1139-1147. DOI:10.1080/09553000210166606 |
| [17] |
杨康, 朱佳赟, 李君红, 等. DNA-PKcs基因组不稳定性和辐射超敏感性[J]. 辐射研究与辐射工艺学报, 2010(2): 114-118. Yang K, Zhu JY, Li JH, et al. Study on the relationship between DNA-PKcs and genomic instability & hyper-radiosensitivity[J]. J Radia Res Radiat Proc, 2010(2): 114-118. DOI:10.3969/j.issn.1000-3436.2010.02.011 |
| [18] |
Sánchez-Flores M, Pásaro E, Bonassi S, et al. γH2AX assay as DNA damage biomarker for human population studies:defining experimental conditions[J]. Toxicol Sci, 2015, 144(2): 406-413. DOI:10.1093/toxsci/kfv011 |
| [19] |
Cervena T, Rossnerova A, Sikorova J, et al. DNA damage potential of engine emissions measured in vitro by micronucleus test in human bronchial epithelial cells[J]. Basic Clin Pharmacol Toxicol, 2017, 121(Suppl 3): 103-108. DOI:10.1111/bcpt.12693 |
| [20] |
Shang Z, Yu L, Lin YF, et al. DNA-PKcs activates the Chk2-Brca1 pathway during mitosis to ensure chromosomal stability[J]. Oncogenesis, 2014, 3: e85. DOI:10.1038/oncsis.2013.49 |
| [21] |
Tu WZ, Li B, Huang B, et al. γH2AX foci formation in the absence of DNA damage:mitotic H2AX phosphorylation is mediated by the DNA-PKcs/CHK2 pathway[J]. FEBS Lett, 2013, 587(21): 3437-3443. DOI:10.1016/j.febslet.2013.08.028 |
 2018, Vol. 38
2018, Vol. 38


