软组织肉瘤是一种少见的恶性肿瘤,发病率约占1%[1]。经过手术、放疗、化疗等初始治疗后,仍有6%~42.5%的患者出现复发[2-5]。复发后部分患者可以再次治疗(手术/放疗等)可取得较好的效果,部分患者疗效较差,出现较高的严重并发症[6-7]。放射性粒子具有创伤小、不良反应小等特点,应用于多种复发性肿瘤的治疗,取得较好的疗效。本课题组前期已报道了放射性粒子植入治疗复发性软组织肉瘤的安全性和初步疗效[8-9]。本回顾性研究通过观察应用放射性125I粒子植入治疗复发性软组织肉瘤患者的疗效和不良反应,分析临床因素与预后之间关系。
资料与方法1.入选标准:病理证实复发性软组织肉瘤,肿瘤表面无破溃,KPS≥60分,患者拒绝或不能耐受再次手术,拒绝或不能耐受放疗,预计总生存时间>3个月,治疗方式为CT或超声引导下经皮穿刺植入放射性125I粒子。
2.一般临床资料:2002年9月—2015年12月在北京大学第三医院行图像(超声或CT)引导下放射性125I粒子植入治疗的局部复发软组织肉瘤患者60例,其中男33例,女27例,中位年龄51.5岁(范围16~85岁)。所有入组患者KPS评分均≥60。其中:放疗+化疗后复发1例,术后复发11例,术后化疗后复发8例,术后放疗后复发22例,术后放疗+化疗后复发18例。16例患者因多次复发行多次手术治疗(2~8次)。末次手术切缘有34例阳性,26例阴性。粒子植入前,41例曾行外放疗,中位剂量60 Gy(32.5~120 Gy)(1例患者行2次放疗,累计剂量120 Gy)。粒子植入时有27例患者伴有全身多发转移。其他临床情况见表 1。
|
|
表 1 60例复发性软组织肉瘤患者一般资料 Table 1 Characteristics of 60 patients with recurrent soft tissue sarcoma |
3.治疗方法:根据患者术前CT图像或超声检查采用Prowess 3D v3.02 TPS(北京飞天兆业科技公司有限)、B-TPS(北京天航科霖科技发展有限公司)设计穿刺路径及最佳的放射性粒子排布,模拟计算DVH,要求CT层厚5 mm,根据术前计划预定相应活度和数量的放射性粒子。患者根据不同位置采取合适体位(仰卧、俯卧、侧卧),局部麻醉或椎管内麻醉成功后,在CT或超声引导下依照术前计划后选定的最佳穿刺层面和进针角度经皮穿刺到位(CT引导患者在术中可根据CT实时图像进行实时调整),使用Mick植入枪将放射性粒子植入肿瘤组织,粒子间距5~10 mm。图像引导方式:超声28例,CT 32例。中位粒子活度25.9×106 Bq(11.1×106~29.6×106 Bq),中位植入粒子数58颗(3~133颗),中位GTV大小44.35 cm3(0.5 ~395.9 cm3)。粒子植入术后即刻行CT扫描,图像上传至Prowess 3D v3.02 TPS系统,进行剂量验证,计算肿瘤剂量D90。本组患者中位D90为120 Gy(36.50~460.97 Gy)。植入后行胸片检查粒子是否发生移位。粒子植入治疗后定期随访(肿瘤部位CT、胸片、一般情况)。
4.疗效评价:评估患者总生存(OS)时间和局部无进展生存(LPFS)时间。OS时间为放射性粒子植入至因任何原因死亡的时间或最后一次随访时间。LPFS时间为放射性粒子植入至植入局部肿瘤进展的时间。根据实体肿瘤疗效评价标准(RECIST) 1.0标准评价肿瘤治疗反应。同时记录患者治疗的相关不良反应,按照放射治疗肿瘤协作组/欧洲癌症治疗研究组织(RTOG/EROTC)放射损伤分级标准评价。疼痛评分根据数字评分法(NAS)。
5.统计学处理:采用SPSS 21.0软件进行分析。Kaplan-Meier法计算OS率和LPFS率,生存时间与临床因素关系分析采用Log-rank法单因素分析,Cox回归模型多因素分析。P<0.05为差异有统计学意义。
结果1.随访:60例患者在粒子植入术后2年内每3个月随访1次,5年内每半年随访1次,以后每年随访1次,无失访患者。中位随访时间18.75个月(1~146个月)。截止至2017年10月23日,45例患者死亡,15例生存。死亡原因:全身转移30例,局部进展12例,感染2例,1例原因不详。
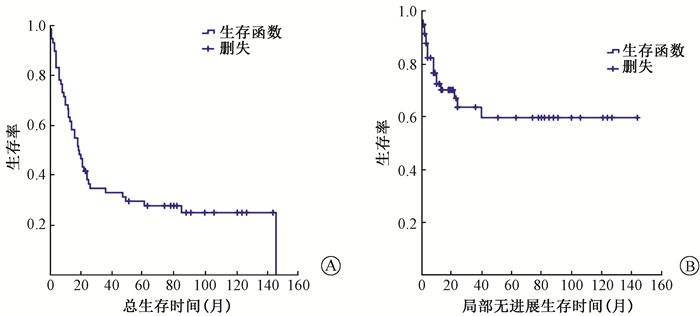
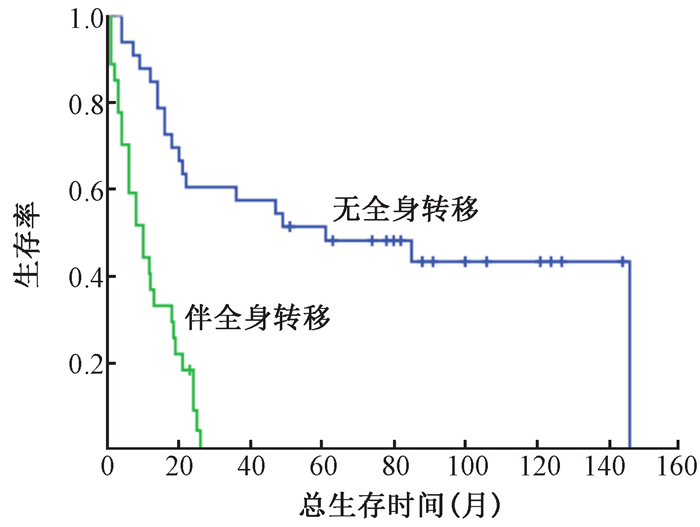
2.疗效和生存:14例患者疗效达完全缓解,22例达部分缓解,19例稳定,5例肿瘤未控。6例患者在粒子植入前伴有疼痛,粒子植入后疼痛症状缓解,疼痛缓解率100%。1年LPFS率为72.5%,3年63.7%,5年59.7%(图 1)。中位OS时间18.5个月(95%CI 13.1~23.9),1年OS率为63.3%,3年33.0%,5年29.5%(图 1)。根据粒子植入时是否伴有全身转移将患者分为2组分析显示:无全身转移组中位OS时间为61个月(95%CI 1.57~120.43),1、3、5年OS率为84.8%、57.6%、48.3%;而伴全身转移组中位OS时间为10个月(95%CI 4.94~15.06),1、2、3年OS率为37.0%、9.3%、0(图 2)。
|
图 1 复发性软组织肉瘤患者总生存(A)和局部无进展生存(B)曲线 Figure 1 Overall survival (A) and local progression-free survival (B) for RSTS |
|
图 2 复发性软组织肉瘤患者全身转移对总生存的影响 Figure 2 Overall survival for the patients with or without matastases |
3.影响预后的因素:单因素分析年龄、肿瘤最大径、肿瘤体积、肿瘤位置、病理类型、病理分级、图像引导方式、既往放疗、既往化疗、KPS评分、初始治疗后至首次复发时间间隔、手术次数、末次手术切缘、粒子植入时有无全身转移、D90。结果显示,影响总生存率的临床预后因素有肿瘤最大径<7 cm(P=0.038)、既往化疗(P=0.008)、KPS评分(P=0.023)、粒子植入时伴有全身转移(P=0.000)、肿瘤体积<45 cm3(P=0.030)、D90≥110 Gy(P=0.027);影响LPFS率的预后因素有:肿瘤最大径<5 cm(P=0.005)、肿瘤体积<40 cm3(P=0.019)、KPS评分(P=0.023)、D90≥95 Gy(P=0.014)。多因素回归分析显示既往化疗、粒子植入时伴有全身转移是影响总生存的独立预后因素,见表 2。
|
|
表 2 影响复发性软组织肉瘤患者总生存的Cox多因素回归分析结果 Table 2 Multivariate analysis of overall survival for recurrent soft tissue sarcoma |
4.不良反应:有18.3%(11/60例)患者出现1~2级皮肤反应,8.3%(5/60例)患者出现3~4级皮肤反应(皮肤溃疡)。其中1例考虑为粒子放疗反应,后行皮肤移植,肿瘤控制;其他4例考虑为肿瘤进展导致。2例(3.3%)患者粒子植入后出现疼痛,1例(1.7%)患者出现一过性发热。
讨论软组织肉瘤目前治疗往往采取手术、放疗、化疗等综合治疗,对比早期截肢、广泛切除等根治性手术,放疗的应用使人们更加倾向于保留肢体功能的保守手术。局部复发后的治疗根据患者不同情况可采取再手术、放疗等。由于病变往往紧邻重要危及器官或多次复发,部分患者不能行根治性手术;而可手术的患者能够取得更好的疗效。MacNeill等[10]分析了219例腹膜后软组织肉瘤复发后治疗疗效,将患者分为能够手术切除和不能手术两组,其中位OS时间分别为49和20个月,2年OS为73%和43%,5年OS为43%和11%。再次手术联合放疗比单纯手术可以提高局部控制率(53%~100%)和生存率(66%~73%),但再放疗往往伴有较严重的并发症(26%~60%)[6, 11-14]。既往治疗未放疗的患者再次治疗可取得与原发肿瘤类似的疗效,5年局部控制率可达81%,而既往曾放疗的患者再次治疗疗效较差(5年局部控制率26%)[11]。
在既往的报道中,复发性软组织肉瘤患者再治疗的放疗技术包括外放疗、近距离治疗(BCT)、术中放疗(IORT/IOERT)。在早期的一些报道中,外放疗特别是再次外放疗因为正常组织限量不能给予更高的放疗剂量,往往伴有更高的治疗相关并发症(50%~60%)[12, 15]。术中放疗可取得与外放疗相似的疗效但更少的严重并发症(15%~26%)[11, 16-18]。近距离治疗包括组织间高剂量率、低剂量率治疗、术中高剂量率治疗,联合手术可取得较好的局部控制,以及可接受的相对低的并发症(16.1%~26%)[11, 19]。质子具有其物理学优势,文献[20]报道了质子再放疗在复发性软组织肉瘤中的应用,23例不能手术的患者,其3年局部控制率为59%,3年OS率为64%,不良反应低(3级急性并发症4%,3级晚期并发症8.7%)。
放射性125I粒子有效辐射半径小,对周围正常组织损伤低,在体内持续释放射线达到杀伤肿瘤的目的。粒子治疗需要时间短,对患者体力状态要求低,本组的早期报道验证了放射性125I粒子植入治疗在复发性软组织肉瘤治疗中的安全性[8-9]。本研究显示全组5年LPFS率为59.7%,与上述其他治疗方式效果相似,而5年OS率为29.5%,较上述报道低。考虑原因:入组患者本身为不能手术或拒绝手术,45%患者伴有全身转移,这部分患者降低了总生存率。将患者进行分层分析显示:无全身转移患者中位OS时间为61个月(95%CI 1.57~120.43),5年OS率为48.3%,与其他治疗类似。且本研究患者有16例患者为多次复发后行放射性粒子植入治疗,粒子治疗后生存时间基线少于其他报道的首次复发后治疗生存时间。本研究显示严重并发症发生率,远远低于其他治疗方式。
既往研究仅报道了放射性粒子植入治疗软组织肉瘤的疗效,少见报道125I粒子治疗疗效与临床因素的关系。本研究中,单因素分析显示肿瘤大小(体积、最大径)、KPS评分、D90是影响OS以及LPFS的预后因素,而多因素分析显示既往化疗史、伴有全身转移是影响OS的预后因素。这不同于其他报道中再次手术联合其他治疗的分析结果[7],复发后生存往往与手术切缘、病理分级、肿瘤位置等因素相关。本研究结果显示,D90≥110 Gy患者的OS时间明显优于未达到此剂量者,这对以后的患者治疗剂量提供了一定的指导依据。伴有全身转移患者的OS时间显著低于无全身转移患者,提示此类患者在选择放射性粒子植入治疗需要慎重并个体化。
综上所述,图像引导下125I粒子植入治疗复发性软组织肉瘤,局部控制好,是一种安全、有效的治疗手段。肿瘤大小、D90是影响OS和LPFS的主要因素。伴有全身转移的患者需要慎重选择治疗。
利益冲突 全体作者未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 姜伟娟负责整理临床数据并起草论文;王俊杰负责审核患者粒子植入计划并指导论文写作;林蕾负责整理临床资料并采集数据结果;姜玉良、田素青、江萍负责粒子植入计划的实施及完善数据;孙海涛负责粒子植入计划的设计
| [1] |
Jemal A, Siegel R, Xu J, et al. Cancer statistics, 2010[J]. CA Cancer J Clin, 2010, 60(5): 277-300. DOI:10.3322/caac.20073 |
| [2] |
Fourquet J, Sunyach MP, Vilotte F, et al. Time interval between surgery and start of adjuvant radiotherapy in patients with soft tissue sarcoma:a retrospective analysis of 1131 cases from the French Sarcoma Group[J]. Radiother Oncol, 2016, 120(1): 156-162. DOI:10.1016/j.radonc.2016.04.037 |
| [3] |
Abatzoglou S, Turcotte RE, Adoubali A, et al. Local recurrence after initial multidisciplinary management of soft tissue sarcoma:is there a way out?[J]. Clin Orthop Relat Res, 2010, 468(11): 3012-3018. DOI:10.1007/s11999-010-1481-7 |
| [4] |
Zagars GK, Ballo MT, Pisters PW, et al. Prognostic factors for patients with localized soft-tissue sarcoma treated with conservation surgery and radiation therapy:an analysis of 1225 patients[J]. Cancer, 2003, 97(10): 2530-2543. DOI:10.1002/(ISSN)1097-0142 |
| [5] |
Italiano A, Le CA, Mendiboure J, et al. Prognostic factors and impact of adjuvant treatments on local and metastatic relapse of soft-tissue sarcoma patients in the competing risks setting[J]. Cancer, 2014, 120(21): 3361-3369. DOI:10.1002/cncr.28885 |
| [6] |
Moureau-Zabottoa L, Thomase L, Buif BNG, et al. Management of soft tissue sarcomas (STS) in first isolated local recurrence:a retrospective study of 83 case[J]. Radiother Oncol, 2004, 73(3): 313-319. DOI:10.1016/j.radonc.2004.05.008 |
| [7] |
Daigeler A, Zmarsly I, Hirsch T, et al. Long-term outcome after local recurrence of soft tissue sarcoma:a retrospective analysis of factors predictive of survival in 135 patients with locally recurrent soft tissue sarcoma[J]. Br J Cancer, 2014, 110(6): 1456-1464. DOI:10.1038/bjc.2014.21 |
| [8] |
朱丽红, 王俊杰, 袁惠书, 等. 放射性125I粒子组织间植入治疗软组织肿瘤[J]. 中国微创外科杂志, 2008, 8(3): 246-248. DOI:10.3969/j.issn.1009-6604.2008.03.021 |
| [9] |
Li J, Wang JJ, Meng N, et al. Image-guided percutaneous 125I seed implantation as a salvage treatment for recurrent soft tissue sarcomas after surgery and radiotherapy[J]. Cancer Biother Radiopharm, 2011, 26(1): 113-120. DOI:10.1089/cbr.2010.0847 |
| [10] |
MacNeill AJ, Miceli R, Strauss DC, et al. Post-relapse outcomes after primary extended resection of retroperitoneal sarcoma:a report from the trans-atlantic RPS working group[J]. Cancer, 2017, 123(11): 1971-1978. DOI:10.1002/cncr.30572 |
| [11] |
Cambeiro M, Aristu JJ, Moreno JM, et al. Salvage wide resection with intraoperative electron beam therapy or HDR brachytherapy in the management of isolated local recurrences of soft tissue sarcomas of the extremities and the superficial trunk[J]. Brachytherapy, 2015, 14(1): 62-70. DOI:10.1016/j.brachy.2014.09.003 |
| [12] |
Catton C, Davis A, Bell R, et al. Soft tissue sarcoma of the extremity. Limb salvage after failure of combined conservative therapy[J]. Radiother Oncol, 1996, 41(3): 209-214. DOI:10.1016/S0167-8140(96)01856-7 |
| [13] |
Modesto A, Filleron T, Chevreau C, et al. Role of radiation therapy in the conservative management of sarcoma within an irradiated field[J]. Eur J Surg Oncol, 2014, 40(2): 187-192. DOI:10.1016/j.ejso.2013.07.088 |
| [14] |
Torres MA, Ballo MT, Butler CE, et al. Management of locally recurrent soft-tissue sarcoma after prior surgery and radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2007, 67(4): 1124-1129. DOI:10.1016/j.ijrobp.2006.10.036 |
| [15] |
Indelicato DJ, Meadows K, Gibbs CP, et al. Effectiveness and morbidity associated with reirradiation in conservative salvage management of recurrent soft-tissue sarcoma[J]. Int J Radiat Oncol Biol Phys, 2009, 73(1): 267-272. DOI:10.1016/j.ijrobp.2008.04.032 |
| [16] |
Calvo FA, Sole CV, Cambeiro M, et al. Prognostic value of external beam radiation therapy in patients treated with surgical resection and intraoperative electron beam radiation therapy for locally recurrent soft tissue sarcoma:a multicentric long-term outcome analysis[J]. Int J Radiat Oncol Biol Phys, 2014, 88(1): 143-150. DOI:10.1016/j.ijrobp.2013.10.021 |
| [17] |
Tran PT, Hara W, Su Z, et al. Intraoperative radiation therapy for locally advanced and recurrent soft-tissue sarcomas in adults[J]. Int J Radiat Oncol Biol Phys, 2008, 72(4): 1146-1153. DOI:10.1016/j.ijrobp.2008.02.012 |
| [18] |
Tinkle CL, Weinberg V, Braunstein SE, et al. Intraoperative radiotherapy in the management of locally recurrent extremity soft tissue sarcoma[J]. Sarcoma, 2015, 2015: 913565. DOI:10.1155/2015/913565 |
| [19] |
Fontanesi J, Mott MP, Lucas DR, et al. The role of irradiation in the management of locally recurrent non-metastatic soft tissue sarcoma of extremity/trunkal locations[J]. Sarcoma, 2004, 8(2-3): 57-61. DOI:10.1080/13577140412331332785 |
| [20] |
Guttmann DM, Frick MA, Carmona R, et al. A prospective study of proton reirradiation for recurrent and secondary soft tissue sarcoma[J]. Radiother Oncol, 2017, 124(2): 271-276. DOI:10.1016/j.radonc.2017.06.024 |
 2018, Vol. 38
2018, Vol. 38


