2. 528000 佛山市第一人民医院物理室
2. Physical Room, First People's Hospital of Foshan, Foshan 528000, China
早期宫颈癌(ⅠA~ⅡA期)术后有高危因素的患者(切缘阳性、盆腔淋巴结阳性及宫旁受侵)需行含铂类的同期放化疗[1]。血液学不良反应(hematologic toxicity, HT)是放化疗常见的不良反应,3级以上HT发生率约为13%~38%[2]。多项研究表明,采用盆骨骨髓剂量保护的调强放疗(bone marrow sparing intensity modulated radiotherapy,BMS-IMRT)可减少骨髓照射剂量体积,进而减少骨髓抑制的发生[3-4]。人体骨骼中的骨髓分为红骨髓和黄骨髓两部分。红骨髓含有大量造血细胞,具有活跃的造血功能,即活性骨髓;而黄骨髓由不具有造血功能的脂肪细胞组成。目前,临床上定义盆骨骨髓体积的方法多根据骨皮质外轮廓或骨髓腔进行。由于此定义方法将骨皮质和/或黄骨髓也包括在内,获得的体积较大。实际上,活性骨髓只占骨盆的一部分。随着影像学发展,功能影像检查开始被用于评价骨髓功能,如核素99Tcm标记硫胶体单光子发射计算机断层扫描(single photon emission computed tomography,SPECT)骨髓显像技术可以在CT断层扫图像上清晰地显示活性骨髓的分布。本研究探讨了SPECT活性骨髓显像结合宫颈癌骨髓保护调强放疗计划的可行性和剂量学特点,以期为今后该技术的临床应用提供参考。
资料与方法1.研究对象:选择2016年10月至2017年5月20例在广东省佛山市第一人民医院治疗的宫颈癌根治术后患者,平均年龄(52.8±5.9)岁。按国际妇产科学联盟(FIGO)分期ⅠB1期9例,ⅠB2期7例,ⅡA期4例。手术方式均为广泛子宫、双附件切除+盆腔淋巴结清扫术。对每个患者根据SPECT和盆骨外轮廓定义的骨髓体积分别制定SPECT-IMRT和BMS-IMRT计划,比较两种计划的靶区和危及器官(骨髓、小肠、直肠和膀胱)剂量分布。本研究已获得医院伦理委员会的审批,并且患者均签署了知情同意书。
2. SPECT骨髓显像:放疗前1周内行SPECT骨髓显像。检查前1 h静脉注射12.2 mCi(1 Ci=3.7×1010 Bq)核素99Tcm标记的硫胶体,仰卧,双手互握肘关节置头顶,双腿自然平放,真空袋固定体位,用激光烧灼皮肤标记3个对位点作为扫描起始参考平面,行SPECT扫描和CT断层扫描(Siemens Symbia T16,德国西门子),范围为上界于第2腰椎下缘至坐骨结节下缘3 cm,像素为128×128,层厚3 mm。应用SPECT自带图像融合软件(MI application)将骨髓显像和断层CT图像融合,获得SPECT骨髓显像。
3. CT模拟定位:定位前1 h排空膀胱,饮水800~1 000 ml(含泛影葡胺10~20 ml)充盈膀胱。采用与SPECT扫描相同体位,阴道内放置阴道标记物。根据皮肤定位点将扫描中心移至起始参考平面,用85 cm大孔径CT模拟机(Brilliance CT Big Bore,荷兰飞利浦)进行定位CT扫描,静脉注射碘普罗胺100 ml获取增强影像,层厚5 mm,扫描范围从第2腰椎上沿至坐骨结节下缘3 cm。
4. SPECT骨髓显像与CT模拟定位图像配准:将同一患者的SPECT骨髓显像和定位CT图像传输到Eclipse 13.5放疗计划系统,计算机根据两组图像的骨性结构进行自动刚性配准,人工逐层核对两组图像的骨性结构重合度,偏差较大时可手工移动或旋转进行校准。
5.靶区和危及器官勾画:临床靶区体积(clinical target volume,CTV)包括阴道上段1/2及残端、阴道旁软组织和盆腔淋巴引流区域(髂总、髂外、髂内、骶前、闭孔淋巴结);上界为第5腰椎上缘,下界为耻骨联合上1/3。CTV外放1.0 cm为计划靶区体积(planning target volume,PTV)。参考美国肿瘤放射治疗协作组织(RTOG)勾画指南[5]勾画危及器官,包括小肠、直肠、膀胱。采用两种计划方法分别定义骨髓体积。①常规BMS-IMRT:按骨盆骨性结构外轮廓逐层勾画。②SPECT-IMRT:按SPECT显示活性骨髓范围逐层勾画;上下界范围从L4上缘至坐骨结节下缘1.0 cm。
6.治疗计划设计:在美国瓦里安Eclipse 13.5治疗计划系统完成计划设计,优化算法O(photon optimizer)13.5,计算算法AAA(anisotropic analytical algorithm)13.5,计算网格2.5 mm。每个患者根据骨髓不同定义方法分别设计2种治疗计划:常规BMS-IMRT计划和SPET-IMRT计划。计划均采用6 MV X射线7野等中心IMRT,计划角度分别为0°、51°、103°、155°、206°、258°、309°,固定剂量率400 MU/cGy;处方剂量45 Gy/25次,95%PTV接受100%处方剂量,98%PTV接受95%处方剂量。危及器官剂量体积限值见表 1,根据文献报道,对骨髓的低剂量辐射区(V10和V20)和高剂量辐射区(V40)分别给予剂量体积限值[6-7]。
|
|
表 1 危及器官剂量体积限值 Table 1 The dosage volume limits in organs at risk |
|
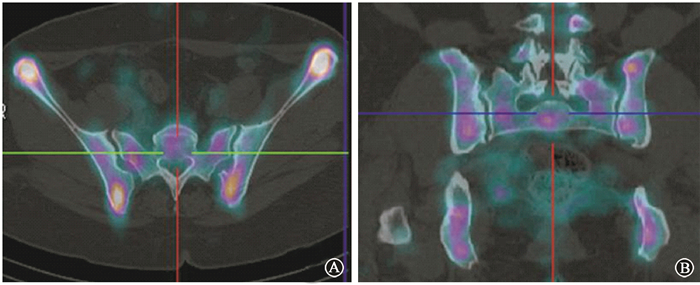
图 1 宫颈癌根治术后患者盆骨SPECT检测活性骨髓范围图像 A.横断位;B.冠状位 Figure 1 The active bone marrow range in pelvic detected by SPECT in patient with cervical cancer after hysterectomy A. transverse axial scan; B. coronal axial scan |
7.计划评估:①比较两种计划方法(SPECT-IMRT和BMS-IMRT)定义的骨髓体积。②PTV靶区剂量指标D98(PTV靶区98%体积所接受的剂量)、D95、D50、均匀性指数(homogeneity index,HI)和适形度指数(conformity index,CI);HI值越小(接近1),表示靶区剂量均匀性越好;CI值范围是0~1,值越大,表示适形度越好。③危及器官(小肠、膀胱、直肠)受照剂量和体积。
8.统计学处理:采用SPSS 20.0软件进行数据分析。计量资料经正态性检验均呈正态分布,采用x ±s表示,行配对样本t检验。P < 0.05为差异有统计学意义。
结果1. SPECT显示的不同CT断层活性骨髓(红骨髓)范围:活性骨髓主要集中腰椎和骶椎的中部、髂骨的外侧和内侧部,少量位于近耻骨联合两侧和坐骨、股骨头的中部(图 1)。
2.两种计划方法定义的骨髓体积比较:SPECT-IMRT计划的骨髓体积为(238.15±36.82) cm3,BMS-SPECT计划为(1 100.61±109.92) cm3,两种计划的骨髓体积比较差异有统计学意义(t=33.273,P < 0.05)。
3.两种IMRT计划的PTV参数比较:在反映PTV覆盖率的各项指标方面,SPET-IMRT计划的D50、D95、D98、HI和CI分别为(4 634.44±6.01)、(4 521.31±5.09)、(4 483.98±7.27)cGy和0.94±0.11和1.04±0.02,与BMS-IMRT计划的(4 635.40±6.92)、(4 520.11±5.59)、(4 483.01±7.00) cGy和0.93±0.01及1.05±0.01相比,差异均无统计学意义(P>0.05)。
4.两种IMRT计划的危及器官参数比较:SPET-IMRT计划的骨髓高剂量辐射区V30、V40和V45分别为(43.51±3.68)%、(21.00±2.64)%和(8.90±2.93)%,BMS-IMRT计划分别为(50.44±7.95)%、(26.68±6.92)%和(11.49±1.62)%。与BMS-IMRT计划比较,SPET-IMRT的V30、V40和V45分别降低6.9%、5.7%和2.6%,差异均有统计学意义(t=3.540、3.426、3.448, P < 0.05);骨髓低剂量辐射区(V10、V20)两种计划差异无统计学意义(P>0.05);两种计划的其他危及器官(膀胱、小肠和直肠)的受照剂量差异均无统计学意义(P>0.05)。
讨论作为宫颈癌同期放化疗常见的不良反应,HT严重时需要延迟甚至中断放疗,从而影响患者的治疗效果。人体内近1/2的活性骨髓分布在骨盆[8],从放射生物效应的分类来说,骨髓属于“并联器官”,因而减少骨髓受照剂量和体积对于降低HT具有一定的积极作用。多项剂量学研究显示,在保证肿瘤靶区适形度和均匀度的同时,骨髓限值的IMRT能有效地降低骨髓照射剂量和体积,减少严重HT的发生率[6, 9]。Mell等[10]报道,对IB~IVA期宫颈癌同期放化疗患者采用骨髓限制IMRT,3级以上中性粒细减少明显低于非限制组(8.6% vs. 27.1%,P=0.035)。张芹和王晗[3]对70例宫颈癌术后同期放化疗患者进行前瞻性随机分组研究,结果显示骨髓限定组的HT较非限制组轻(P < 0.05)。然而,在盆腔骨髓保护方面,仍有一些问题亟待解决,例如,骨髓体积的定义及骨髓剂量体积限值目前均无统一标准。
首先,对于骨髓体积的定义,大多数研究以全部盆骨外轮廓定义骨髓体积,Mahantshetty等[11]则认为勾画骨髓腔比全部盆骨更能代表造血骨髓。然而,全部骨盆包括了大量无造血功能的骨皮质;分布着红骨髓(活性骨髓)与黄骨髓的骨髓腔内仅前者具有造血功能,导致上述两种方法都无法准确地界定红骨髓的体积。2007年,Roeske等[12]首次将SPECT/CT与IMRT技术结合,并在一例子宫内膜癌患者术后进行了剂量学分析,结果显示盆骨内活性骨髓主要分布在腰椎、骶椎和髂骨中分,IMRT能将V30降至50%以下,同时PTV覆盖率和其他正常组织受量均不受影响。活性骨髓中大量的单核巨噬细胞具有吞噬和清除放射性胶体的功能,核素99Tcm标记的硫胶体在进行SPECT扫描时可将红骨髓的范围清晰地显示在CT断层图像上[13]。在本研究中,20例宫颈癌术后患者在治疗前均接受了SPECT骨髓显像检查。在所获取的图像中,99Tcm标记的硫胶体浓聚范围与Roeske等[12]描述的范围基本一致;SPECT定义的骨髓体积明显小于常规方法。除此之外,近年来利用18FFLT-PET[14]或18FFDG-PET[15]定义活性骨髓的研究也相继报道,但考虑到这些检查的高昂费用和可及性,SPECT/CT不失为一种可在临床上推广且实用、价廉的检测手段。
其次,对于骨髓的剂量体积限值,Albuquerque等[16]的研究发现V20>80%是骨髓抑制的独立预测因子;Rose等[17]根据正常组织并发症概率(normal tissue complication probability, NTCP)模型提出骨髓照射体积V10≥95%、V20≥76%的宫颈癌放化疗患者易发生3级以上血液学不良反应。郑良建等[18]提出急性血液学不良反应的发生与骨髓的照射体积密切相关,尤其是V10、V20等低剂量辐射剂量体积指标。但RTOG0418研究结果提示,当骨髓受照射体积V40>37%或骨髓平均受照射剂量>34.2 Gy时,2级以上血液不良反应发生率增加[7]。造成剂量体积的差异可能与人体盆骨的形状、体积和活性骨髓含量的个体化差异有关。张道明等[19]研究发现,骨盆的平均剂量、V20、V30、V40、V50与骨盆冠状轴长呈负相关(P=0.008~0.038)。常规骨髓定义方法(BMS-IMRT)所定义的骨髓体积较大,如果过分强调骨髓的权重,可能会降低PTV的覆盖或/和增加其他正常组织的受照剂量。
本研究中,由于根据SPECT缩小了需要保护的骨髓体积,相应地降低了治疗计划系统优化的难度。在剂量学研究结果中,SPECT-IMRT计划的低剂量辐射区(V10、V20)满足目前常用的骨髓限值标准[6-7],即V10≤90%,V20≤76%;与BMS-IMRT比较,两组指标差异无统计学意义。高剂量辐射区V30、V40和V45的平均体积SPECT-IMRT计划较BMS-IMRT计划分别降低6.9%、5.7%和2.6%,差异有统计学意义;而且SPECT-IMRT没有降低PTV的覆盖率和增加膀胱、小肠和直肠的受照剂量。以上结果提示,SPECT-IMRT在保证PTV的覆盖率、不增加其他正常组织受照剂量的同时,可以进一步降低高剂量辐射区的剂量体积。袁佳等[20]的研究结果显示,髂骨骨髓V30、V40及化疗周期数为影响血液学不良反应发生率的独立因素,V40>22.5%血液学不良反应阳性发生率为78.6%,而V40≤22.5%时则仅为39.3%(P=0.003)。本研究的SPECT-IMRT计划中V40平均为21%,提示该技术有进一步降低HT发生率的可能性。
总之,SPECT骨髓显像能较清晰地在CT断层图像上显示活性骨髓的范围。相较于传统骨髓定义方法,SPECT定义的骨髓的体积明显缩小,临床上有利于医生根据器官的功能区实施精准治疗;在剂量学方面,SPECT-IMRT能进一步降低高剂量辐射的剂量体积(V30、V40和V45),但这种优势的临床意义还需要大样本临床研究检验。
利益冲突 无作者贡献声明 黄荣负责研究设计、论文撰写和修改;滕建建负责放疗治疗计划设计、数据统计和分析;曾晓红和陈默进行病例收集和治疗计划的实施
| [1] |
Peters WA, Liu PY, Barrett RJ, et al. Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix[J]. J Clin Oncol, 2000, 18(8): 1606-1613. DOI:10.1200/JCO.2000.18.8.1606 |
| [2] |
Kirwan JM, Symonds P, Green JA, et al. A systematic review of acute and late toxicity of concomitant chemoradiation for cervical cancer[J]. Radiother Oncol, 2003, 68(3): 217-226. DOI:10.1016/S0167-8140(03)00197-X |
| [3] |
张芹, 王晗. 宫颈癌术后限定骨髓剂量盆腔调强放疗的临床研究[J]. 中华放射医学与防护杂志, 2015, 35(6): 441-444. Zhang Q, Wang H. Clinical study of bone marrow-sparing intensity-modulated radiation therapy for postoperative cervical cancer[J]. Chin J Radiol Med Prot, 2015, 35(6): 441-444. DOI:10.3760/cma.j.issn.0254-5098.2015.06.009 |
| [4] |
冉晶晶, 张红雁, 薛旭东, 等. 宫颈癌术后容积调强放疗中限定骨盆剂量的临床研究[J]. 中华全科医学, 2017, 15(12): 2021-2023. Ran JJ, Zhang HY, Xue XD, et al. Clinical study of bone marrow-sparing volumetric modulated arc-radiation therapy for postoperative cervical cancer[J]. Chin J Gen Pract, 2017, 15(12): 2021-2023. DOI:10.16766/j.cnki.issn.1674-4152.2017.12.005 |
| [5] |
Small W, Mell LK, Anderson P, et al. Consensus guidelines for delineation of clinical target volume for intensity modulated pelvic radiotherapy in postoperative treatment of endometrial and cervical cancer[J]. Int J Radiat Oncol Biol Phys, 2008, 71(2): 428-434. DOI:10.1016/j.ijrobp.2007.09.042 |
| [6] |
Murakami N, Okamoto H, Kasamatsu T, et al. A dosimetric analysis of intensity-modulated radiation therapy with bone marrow sparing for cervical cancer[J]. Anticancer Res, 2014, 34(9): 5091-5098. |
| [7] |
Klopp AH, Moughan J, Portelance L, et al. Hematologic toxicity in RTOG 0418:a phase 2 study of postoperative IMRT for gynecologic cancer[J]. Int J Radiat Oncol Biol Phys, 2013, 86(1): 83-90. DOI:10.1016/j.ijrobp.2013.01.017 |
| [8] |
Russell WJ, Yoshinaga H, Antoku S, et al. Active bone marrow distribution in the adult[J]. Br J Radiol, 1966, 39(466): 735-739. DOI:10.1259/0007-1285-39-466-735 |
| [9] |
肖锋, 李云海, 王洪林, 等. 宫颈癌术后保护骨髓的调强放疗剂量学研究[J]. 中国癌症杂志, 2013, 23(3): 200-206. Xiao F, Li YH, Wang HL, et al. Dosimetric study of protecting bone marrow by intensity-modulated radiotherapy for patients with cervical cancer after hysterectomy[J]. China Oncol, 2013, 23(3): 200-206. DOI:10.3969/j.issn.1007-3969.2013.03.008 |
| [10] |
Mell LK, Sirák I, Wei L, et al. Bone marrow-sparing intensity modulated radiation therapy with concurrent cisplatin for stage ⅠB-ⅣA cervical cancer:an international multicenter phase Ⅱ clinical trial (INTERTECC-2)[J]. Int J Radiat Oncol Biol Phys, 2017, 97(3): 536-545. DOI:10.1016/j.ijrobp.2016.11.027 |
| [11] |
Mahantshetty U, Krishnatry R, Chaudhari S, et al. Comparison of 2 contouring methods of bone marrow on CT and correlation with hematological toxicities in non-bone marrow-sparing pelvic intensity-modulated radiotherapy with concurrent cisplatin for cervical cancer[J]. Int J Gynecol Cancer, 2012, 22(8): 1427-1434. DOI:10.1097/IGC.0b013e3182664b46 |
| [12] |
Roeske JC, Lujan A, Reba RC, et al. Incorporation of SPECT bone marrow imaging into intensity modulated whole-pelvic radiation therapy treatment planning for gynecologic malignancies[J]. Radiother Oncol, 2005, 77(1): 11-17. DOI:10.1016/j.radonc.2005.06.017 |
| [13] |
Datz FL, Taylor A. The clinical use of radionuclide bone marrow imaging[J]. Semin Nucl Med, 1985, 15(3): 239-259. DOI:10.1016/S0001-2998(85)80003-9 |
| [14] |
McGuire SM, Bhatia SK, Sun W, et al. Using[J]. Int J Radiat Oncol Biol Phys, 2016, 96(1): 228-239. DOI:10.1016/j.ijrobp.2016.04.009 |
| [15] |
Franco P, Fiandra C, Arcadipane F, et al. Incorporating 18FDG-PET defined pelvic active bone marrow in the automatic treatment planning process of anal cancer patients undergoing chemo-radiation[J]. BMC Cancer, 2017, 17(1): 710-715. DOI:10.1186/s12885-017-3708-4 |
| [16] |
Albuquerque K, Giangreco D, Morrison C, et al. Radiation related predictors of hematologic toxicity after concurrent chemoradiation for cervical cancer and implications for bone marrow sparing pelvic IMRT[J]. Int J Radiat Oncol Biol Phys, 2011, 79(4): 1043-1047. DOI:10.1016/j.ijrobp.2009.12.025 |
| [17] |
Rose BS, Liang Y, Lau SK, et al. Correlation between radiation dose to 18F-FDG-PET defined active bone marrow subregions and acute hematologic toxicity in cervical cancer patients treated with chemoradiotherapy[J]. Int J Radiat Oncol Biol Phys, 2012, 83(4): 1185-1191. DOI:10.1016/j.ijrobp.2011.09.048 |
| [18] |
郑良建, 马慧, 冯梅, 等. 盆腔骨髓保护在放射治疗中的应用研究进展[J]. 肿瘤预防与治疗, 2015, 28(3): 165-169. Zheng LJ, Ma H, Feng M, et al. Research progress of pelvic bone marrow protection in radiotherapy[J]. J Cancer Control Treat, 2015, 28(3): 165-169. DOI:10.3969/j.issn.1674-0904.2015.03.013 |
| [19] |
张道明, 国慧, 张奇, 等. 宫颈癌术后放疗行限定骨盆IMRT计划剂量学分析[J]. 中华放射肿瘤学杂志, 2017, 26(11): 1303-1307. Zhang DM, Guo H, Zhang Q, et al. Dosimetric analysis of bone marrow-sparing pelvic intensity-modulated radiotherapy after surgery for cervical cancer[J]. Chin J Radiat Oncol, 2017, 26(11): 1303-1307. DOI:10.3760/cma.j.issn.1004-4221.2017.11.013 |
| [20] |
袁佳, 常建英, 李凤虎, 等. 宫颈癌术后调强放疗髂骨骨髓受量与血液学毒性相关性研究[J]. 中华肿瘤防治杂志, 2015, 22(21): 1708-1712. Yuan J, Chang JY, Li FH, et al. Relationship between the receiving dose of iliac bone marrow and hematoxicity of postoperative in intensity modulating radiotherapy of cervical cancer[J]. Chin J Cancer Prevent Treat, 2015, 22(21): 1708-1712. DOI:10.16073/j.cnki.cjcpt.2015.21.013 |
 2018, Vol. 38
2018, Vol. 38
