2. 266071 青岛市市立医院综合内科
2. Department of General Medicine, Qingdao Municipal Hospital, Qingdao 266071, China
肺癌已经成为最常见的恶性肿瘤之一[1]。目前治疗肺癌的方法有手术治疗、化疗、放疗、分子靶向治疗、介入治疗和其他治疗。由于大多数患者就诊时往往已经是疾病晚期,丧失了手术的机会,且传统放疗患者接受困难,所以,放射性粒子植入治疗越来越多地被人们所认可。目前临床上使用较多的是125I粒子,其具有创伤小、定位精确、并发症少等优点,粒子中心附近的射线最强,可摧毁病变组织,并最大限度地降低对正常组织的损伤[2]。本研究利用A549人肺腺癌细胞株建立肺癌裸鼠模型,在移植瘤内植入不同活度的125I粒子,观察125I粒子在组织间内照射对瘤体细胞中凋亡蛋白P21、Caspase-9、Survivin、和Livin的蛋白表达情况,来探讨放射性125I粒子对肺腺癌细胞株A549裸鼠移植瘤细胞凋亡机制。
材料与方法1.实验动物及材料:SPF级雌性40只BALA/c裸鼠,4~6周龄,体重16~18 g,购于北京华阜康生物科技股份有限公司[合格证号:SCXK(京)2014-0004],于青岛大学医学院动物实验中心饲养。A549人肺腺癌细胞株购自美国菌种保藏中心;放射性125I粒子及空源粒子购自北京智博高科生物技术有限公司,放射性活度分别为空源粒子(0 mCi)、0.6和0.8 mCi(1 Ci=3.7×1010 Bq)3种粒子。
2.裸鼠皮下移植瘤模型的建立及处理:取对数生长期A549细胞,经过消化脱壁后,用磷酸盐缓冲液(PBS)洗涤2次,离心半径7 cm,1 000 r/min,离心5 min,去上清,加入培养液,将细胞数调整为1×107/ml。取0.2 ml细胞悬液接种于裸鼠右背部近头侧皮下。待肿瘤长到(300±50)mm3时,按随机数字表法,将40只荷瘤裸鼠分为空源粒子组(0 mCi组)、0.6 mCi组、0.8 mCi组和空白对照组,每组10只。用18G植入针将不同放射强度粒子分别植入各组裸鼠移植瘤内,每个移植瘤植入1枚粒子,空白对照组不做任何处理。植入前及植入后,每4天测量裸鼠体重。放射性粒子植入第32天处死裸鼠,完整取出瘤组织并称重,绘制裸鼠体重增长曲线,计算抑瘤率。抑瘤率=(空白对照组平均瘤重-粒子植入组平均瘤重)/空白对照组平均瘤重× 100%。
3.瘤体组织苏木素-伊红(HE)染色:将瘤体组织用4%多聚甲醛固定,24 h后石蜡包埋,4 μm切片。经过脱蜡、染色、脱水、透明、封固等步骤后制作成HE染色切片。
4.瘤体组织细胞凋亡检测:脱蜡冲水后的肿瘤组织切片,每片滴加100 μl蛋白酶K,37℃孵育30 min,用PBS浸洗2次,加100 μl平衡液,湿盒平衡10 min。加50 μl末端脱氧核苷酰基转移酶介导性dUTP切口末端标记(TUNEL)反应混合液于切片上,使切片在暗湿盒中37℃孵育60 min,PBS冲洗,加入50 μl转化剂-POD,在湿盒中37℃孵育30 min,PBS冲洗。滴入二氨基联苯胺(DAB)染色液显色,复染细胞核,封片,镜下观察。TUENL判定方法,阳性细胞占肿瘤细胞总数的百分比即为凋亡指数(apoptosis index, AI)。
5.免疫组织化学法分别检测瘤体组织中P21、Caspase-9、Survivin、Livin蛋白的表达:每个裸鼠移植瘤标本取3张切片,以扩大样本量,防止误差。采用免疫组织化学染色:石蜡包埋组织切片常规脱蜡脱水后, 微波修复抗原, 经内源性过氧化酶阻断剂孵育15 min, PBS液冲洗。分别加鼠抗人P21单克隆抗体(北京中杉金桥公司)、兔抗人Caspase-9单克隆抗体(稀释度1: 50,北京博奥森公司)、兔抗人Survivin单克隆抗体(北京中杉金桥公司)、兔抗人Livin单克隆抗体(稀释度1: 50,北京博奥森公司), 室温2 h孵育。PBS冲洗后加入即用型二抗PV-9000, 室温孵育15 min, PBS冲洗, 常规DAB显色, 苏木素复染、透明, 封片镜检。用PBS缓冲液代替一抗作为阴性对照, 用已知阳性片作阳性对照。所有切片均在相同条件下进行。
6.免疫组织化学结果判定:所有切片采用双盲法,由两位有经验的病理科医师阅片,参照Kawasaki等[3]的半定量积分法判断结果。光镜下, P21在细胞核上有棕黄色颗粒为阳性,Caspase-9、Survivin和Livin在细胞核和细胞质内有棕黄色颗粒为阳性。随机观察5个高倍镜(×400)视野, 按每高倍镜视野阳性细胞数百分比记分,无阳性细胞,0分;阳性细胞百分比1%~25%,1分;阳性细胞占比25%~50%,2分;阳性细胞占比50%~75%,3分;阳性细胞>75%,4分。根据细胞着色强度计分:细胞无显色,0分;浅黄色,1分;棕黄色,2分;棕褐色,3分。根据这两项指标两分相加分为4级,即阴性为0~1分,弱阳性2~3分,阳性4~5分,强阳性6~7分。
7.统计学处理:采用SPSS 19.0软件进行数据分析。计量资料经正态性检验,符合正态分布,采用 x±s表示。各组数据分别进行方差齐性检验,组间均数比较采用单因素方差分析,均数间的两两比较采用Student-Newman-Keuls检验,各组率的比较采用χ2检验,相关性采用Spearman直线相关分析。P < 0.05为差异有统计学意义。
结果1.裸鼠肺腺癌移植瘤大体及主要脏器病理学改变:共计接种40只裸鼠,接种5~7 d后,裸鼠接种部位皮下可见绿豆样小结节,随后全部顺利成瘤。第3周后,肿瘤体积全部达到(300±50)mm3,且肿瘤表面未见缺血坏死引起的溃破和糜烂,可用于实验。裸鼠自荷瘤开始至取瘤,均存活,一般情况良好,未见恶病质及明显放射诱导损伤。0、0.6、0.8 mCi组裸鼠的心、肝、脾、肺及肾等组织无明显出血坏死,未见明显纤维化表现。所有粒子位于移植瘤中央,未见移位、遗失,全部成功回收。
2.粒子植入后裸鼠体重变化:粒子植入后各组间裸鼠体重前12 d基本保持平稳,到第12天后体重开始出现差别,但4组比较差异无统计学意义(P>0.05)。第12天后0.6和0.8 mCi组裸鼠体重下降明显,粒子植入第28、32天,0.6和0.8 mCi组裸鼠体重与空白对照组比较,差异有统计学意义(q=4.26、9.19、4.11、11.59,P<0.05),而0.6与0.8 mCi组比较, 0 mCi组与空白对照组比较差异无统计学意义(P>0.05,图 1)。
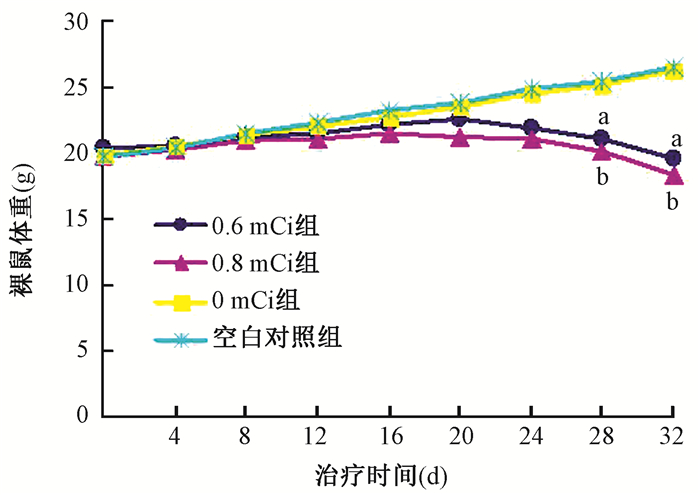
|
图 1 粒子植入后各组裸鼠体重变化曲线 注:a与空白对照组比较,q=4.26、9.19,P<0.05;b与空白对照组比较,q=4.11、11.59,P<0.05 Figure 1 Changes of body weight of nude mice after 125I seed implantation |
3.各组瘤体质量比较结果:粒子植入后0.6和0.8 mCi组(1.20±0.44)、(0.99±0.404)g瘤重均小于空白对照组的(2.35±0.64)g,差异有统计学意义(q=5.021、5.692,P<0.05);0.6和0.8 mCi组、空源粒子组和空白对照组瘤重比较,差异无统计学意义(P>0.05)。0.6和0.8 mCi组抑瘤率分别为49%和62%。
4.裸鼠瘤体组织病理学改变:经苏木素-伊红(HE)染色,肿瘤细胞呈现蓝色,血管及间质呈红色。空白对照组及0 mCi组可见肿瘤细胞及间质丰富,肿瘤细胞排列紧密,细胞间界限不清,生长旺盛,核大深染,可见较多核分裂像,血管丰富,无或少量液化坏死。0.6和0.8 mCi组可见大片坏死的肿瘤细胞,呈均质、红染表现,正常细胞结构基本不可见,邻近坏死区残存的肿瘤细胞排列疏松,核溶解,胞质染色不明显,呈嗜伊红状,邻近血管数量减少,新生血管少见,见图 2。
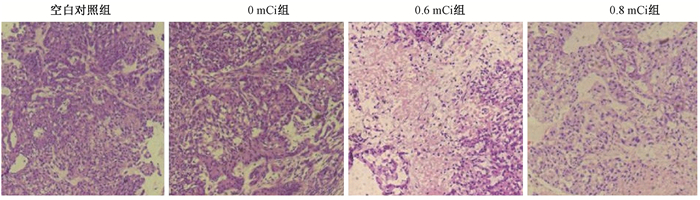
|
图 2 各组裸鼠移植瘤病理学改变 HE染色×100 Figure 2 Pathological changes of xenografts in nude mice HE ×100 |
5.裸鼠瘤体组织细胞凋亡改变:光镜观察可见凋亡细胞的细胞核染色明显,为棕黄色,0.6和0.8 mCi组凋亡细胞明显增加,0 mCi组、空白对照组凋亡细胞稀少,见图 3。计算细胞凋亡指数,各组之间差异有统计学意义(F=45.34,P<0.05),0.6和0.8 mCi组的凋亡指数与空白对照组相比明显增高,差异有统计学意义(q=14.957、10.918,P<0.05),而0 mCi组与空白对照组比较、0.6与0.8 mCi组比较,差异均无统计学意义(P>0.05),表明125I粒子植入照射可明显加速肿瘤细胞的凋亡,见表 1。
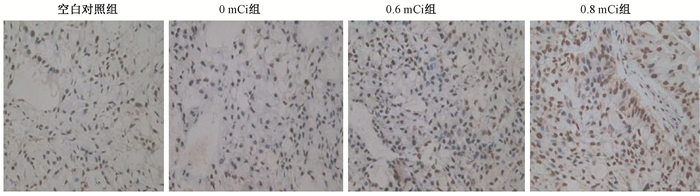
|
图 3 各组裸鼠移植瘤细胞凋亡结果 TUNEL染色×400 Figure 3 Apoptosis of transplanted tumor cells in each group of nude mice TUNEL ×400 |
|
|
表 1 各组肿瘤细胞增殖指数和凋亡指数的表达(%,x ±s) Table 1 Indexes of tumor cell proliferation and apoptosis in each group (%,x ±s) |
6.裸鼠瘤体组织中P21、Caspase-9、Survivin、Livin的蛋白表达改变:P21蛋白阳性表达率在空白对照组、0、0.6和0.8 mCi分别为23.3%、16.7%、66.7%、86.7%。与空白对照组相比,0.6和0.8 mCi组差异均有统计学意义(χ2=11.380、24.310,P < 0.05),但二组向差异无统计学意义(P>0.05)。Caspase-9蛋白阳性表达率在空白对照组、0、0.6和0.8 mCi组分别为33.3%、40%、76.7%、90%。0.6和0.8 mCi与空白对照组差异均有统计学意义(χ2=11.380、20.376,P < 0.05),但二组向差异无统计学意义(P>0.05)。Survivin蛋白阳性表达率在空白对照组、0、0.6和0.8 mCi组分别为66.7%、76.7%、26.7%和13.3%,0.6和0.8 mCi组与空白对照组差异均有统计学意义(χ2=9.643、23.254,P < 0.05),但二组间差异无统计学意义(P>0.05)。Livin蛋白阳性表达率在空白对照组、0、0.6和0.8 mCi组分别为83.3%、76.7%、33.3%和16.7%。0.6和0.8 mCi组与空白对照组差异均有统计学意义(χ2=15.429、26.667, P < 0.05),但二组间差异无统计学意义(P>0.05),见图 4。
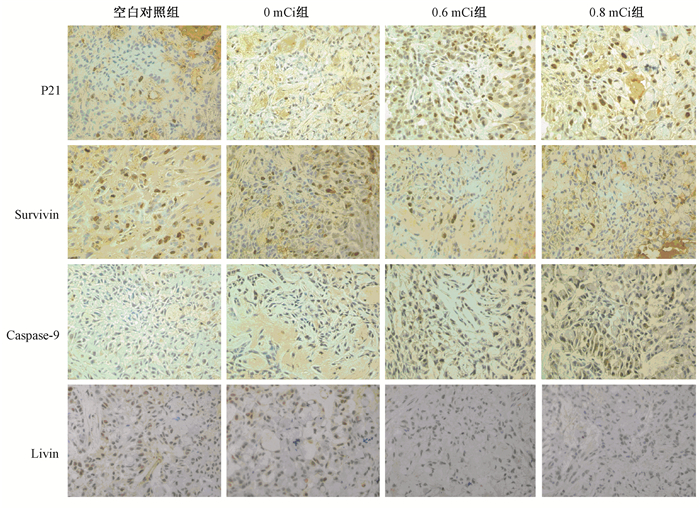
|
图 4 各组裸鼠移植瘤免疫组织化学染色结果 SP法染色×400 Figure 4 Immunohistochemical staining of xenografts in nude mice SP ×400 |
7.裸鼠瘤组织中不同蛋白表达间的相关性:裸鼠瘤组织中Survivin和Caspase-9表达呈负相关(r=-0.984,P=0.037),Survivin和P21表达呈负相关(r=-0.996,P=0.004),Survivin与Livin蛋白表达呈正相关(r=0.975,P=0.025)。
讨论放射性125I粒子治疗肿瘤属于近距离范畴,它具有局部剂量高和周围组织损伤小的特点[4],在连续近距离照射肿瘤过程中, 对肿瘤细胞产生持续性损伤, 处于增殖期的细胞被杀死, 而处于抗拒细胞周期或者静止期的肿瘤细胞将会进入对放射性敏感的G2/M期。此外,125I粒子的射线会使肿瘤细胞自我修复能力丧失,从而使肿瘤细胞损伤加重而导致死亡。另外,125I放射性粒子还能够持续性释放出低剂量γ射线,这种射线能够使肿瘤细胞的DNA双链发生断裂,并且能够使机体内的水分子发生电离从而产生自由基,加快肿瘤细胞的凋亡,从而抑制肿瘤细胞繁殖,延缓肿瘤的生长,从而达到治疗目的[5-6]。125I粒子的物理学特性为随距离平方反比梯度衰减,这种特性可使肿瘤靶区细胞达到超高剂量,而靶区周围组织的剂量迅速下降,最大幅度减少对周围正常组织的危害[7]。
由于125I粒子植入这种突出的生物学优势,已越来越广泛地应用于前列腺癌、肺癌、胰腺癌、宫颈癌和头颈部恶性肿瘤等的治疗,并取得良好的治疗效果[8-9]。而早在1940年,放射性粒子植入就用于治疗无法手术切除的非小细胞肺癌(NSCLC)[10]。临床上应用的125I粒子放射性活度一般为22.2~29.6 MBq,初始剂量率为7~8 cGy/h,生物等效剂量约160 Gy[11]。本研究采用不同活度的125I粒子分别种植入人肺腺癌裸鼠移植瘤。结果发现,0.6和0.8 mCi(22.2、29.6 MBq)组125I粒子植入均能减缓肿瘤增长。0 mCi和空白对照组不能抑制肿瘤生长。本次实验表明,125I粒子能够有效地减慢肿瘤细胞增殖,抑制肿瘤细胞生长。国内外很多研究也都证实了这一点,但都仅仅停留在临床层面上的分析,对于分子层面上的研究并不多。本实验更进一步地研究了分子机制,认为125I粒子植入治疗能够促进肿瘤细胞的凋亡。
细胞凋亡存在于多细胞生物的整个生命过程当中,可及时清除机体内多余和受损伤的细胞,维持组织和器官的稳定。根据细胞内调节凋亡的大分子种类,可以分为4类,即凋亡抑制蛋白、Caspases家族、衔接蛋白、B淋巴细胞瘤-2家族。本实验采用TUNEL染色法来检测125I粒子对肿瘤细胞凋亡的影响。本实验表明,125I粒子能显著增加肿瘤细胞凋亡,且通过上调P21和Caspase-9表达、下调Survivin和Livin蛋白表达,来促进肿瘤细胞凋亡。
P21是细胞周期中最重要的负调节因子之一, 在细胞凋亡的过程中起着重要作用。主要通过肿瘤抑制基因p53的调控而产生,同时也可以通过p53非依赖性方式被其他因子所诱导产生。Caspase-9蛋白是Caspase家族的一员,Caspase家族作为凋亡机制中重要的效应成分,参与多种与凋亡有关的生理和病理过程。Survivin蛋白主要通过直接抑制Caspase-3和Caspase-7的活性而阻断细胞凋亡过程[12]。Livin是新发现的一种细胞凋亡抑制蛋白,主要通过阻断凋亡受体及以线粒体为基础的外源性和内源性凋亡途径发挥抑制细胞凋亡的作用[13]。
Survivin蛋白能削弱P21蛋白对细胞周期阻断作用。其主要机制在于Survivin蛋白、γ微管蛋白和P21蛋白能够结合成复合物, 定位于中心粒上,从而导致P21蛋白无法阻断细胞周期, 加快细胞的复制速度。本实验也印证了Survivin和P21的这种负相关关系。Survivin蛋白与Caspase-9蛋白也互为拮抗关系。Caspase-9属于凋亡反应启动蛋白,凋亡刺激来临时,Survivin可以与Caspase-9结合,使凋亡信号无法向下游其他Caspase家族成员传达,间接阻断细胞凋亡。本实验也印证了Survivin和P21的这种负相关关系。Survivin和Livin都是IAPs家族的成员,阻碍凋亡的机制大部分相同,都是抑制Caspase蛋白家族的活性来阻断凋亡。本实验也印证了Survivin和Livin的这种正相关关系。但Survivn和Livin在凋亡信号的诱导、传导通路等方面也有许多不同,需要进一步的深入研究。
本研究发现,放射性125I粒子能显著抑制裸鼠移植瘤的生长速度,有明显的抑瘤作用;同时也发现125I粒子治疗后,移植瘤细胞发生凋亡的数量明显增多。说明放射性粒子125I粒子能够通过上调P21、Caspase-9蛋白的表达,下调Survivin、Livin蛋白表达来促进移植瘤细胞的凋亡,从而控制了移植瘤的生长速度。但对于具体信号通路,还需要进一步研究,为125I粒子植入治疗肺癌指引方向。
利益冲突 本研究受青岛市黄岛国家级开发区科技局(2014-1-77)资助,所有作者无任何利益冲突作者贡献声明 孟茜负责实验操作、论文撰写和修改;朱新红负责实验指导;修麓璐、崔世超、曹艺巍协助数据的统计和分析;林存智指导实验设计和论文修改
| [1] |
姚晓军, 刘伦旭. 肺癌的流行病学及治疗现状[J]. 现代肿瘤医学, 2014, 22(8): 1982-1986. Yao XJ, Liu LX. Epidemiology and treatment of lung cancer[J]. Modern Oncol, 2014, 22(8): 1982-1986. DOI:10.3969/j.issn.1672-4992.2014.08.74 |
| [2] |
林涌. CT导向下经皮植入125I放射性粒子治疗肺癌患者的临床观察[J]. 中外医学研究, 2016, 14(32): 39-41. Lin Y. Clinical observation of CT-guided percutaneous implantation of 125I radioactive particles in the treatment of lung cancer[J]. Chin Foreign Med Res, 2016, 14(32): 39-41. DOI:10.14033/j.cnki.cfmr.2016.32.021 |
| [3] |
Kawasaki H, Altieri DC, Lu CD, et al. Inhibition of apoptosis by survivin predicts shorter survival rates in colorectal cancer[J]. Cancer Res, 1998, 58(22): 5071-5074. |
| [4] |
王俊杰, 柴树德, 郑广钧, 等. 3D打印模板辅助CT引导放射性125I粒子植入治疗肿瘤专家共识[J]. 中华放射医学与防护杂志, 2017, 37(3): 161-170. Wang JJ, Chai SD, Zheng GJ, et al. 3D Printing template-assisted ct-guided radioactive 125I seed implantation for tumor experts consensus[J]. Chin J Radiol Med Prot, 2017, 37(3): 161-170. DOI:10.3760/cma.j.issn.0254-5098.2017.03.001 |
| [5] |
杨景魁, 吕金爽, 郑广钧, 等. 非小细胞肺癌患者放射性125I粒子植入治疗后近期血清肿瘤标志物变化[J]. 中国肿瘤临床, 2014, 41(1): 64-67. Yang JK, Lyu JS, Zheng GJ, et al. Changes of serum tumor markers in patients with non-small cell lung cancer after radioactive 125I seeds implantation[J]. Chin Cancer Clin, 2014, 41(1): 64-67. DOI:10.3969/j.issn.1000-8179.20130822 |
| [6] |
宋晶晶, 纪建松, 赵中伟, 等. 支气管动脉化疗栓塞联合125I粒子植入治疗老年性非小细胞肺癌疗效分析[J]. 介入放射学杂志, 2014, 23(2): 159-163. Song JJ, Ji JS, Zhao ZW, et al. Therapeutic effect of bronchial arterial chemoembolization combined with 125I seed implantation in elderly patients with non-small cell lung cancer[J]. J Intervent Radiol, 2014, 23(2): 159-163. DOI:10.3969/j.issn.1008-794X.2014.02.018 |
| [7] |
霍彬, 霍小东, 王磊, 等. CT联合模板引导放射性粒子植入治疗不可手术的早期非小细胞肺癌[J]. 中华放射医学与防护杂志, 2017, 37(7): 500-504. Huo B, Huo XD, Wang L, et al. CT-guided guided radioactive seed implantation for the treatment of inoperable early non-small cell lung cancer[J]. Chin J Radiol Med Prot, 2017, 37(7): 500-504. DOI:10.3760/cma.j.issn.0254-5098.2017.07.005 |
| [8] |
Wang Z, Zhao Z, Lu J, et al. A comparison of the biological effects of 125I seeds continuous low-dose-rate radiation and 60Co high-dose-rate gamma radiation on non-small cell lung cancer cells[J]. PLoS One, 2015, 10(8): e0133728. DOI:10.1371/journal.pone.0133728 |
| [9] |
Li HX, Zhao J, Shen K, et al. Comparison of 125I seeds implantation and afterloading radiotherapy in murine models of human cervical cancer[J]. Arch Gynecol Obstet, 2014, 289(5): 1101-1106. DOI:10.1007/s00404-013-3107-2 |
| [10] |
Peretz T, Nori D, Hilaris B, et al. Treatment of primary unresectable carcinoma of the pancreas with I-125 implantation[J]. Int J Radiat Oncol Biol Phys, 1989, 17(5): 931-935. DOI:10.1016/0360-3016(89)90138-7 |
| [11] |
向桂玲, 朱新红, 林存智, 等. 放射性125I粒子植入对人肺腺癌裸鼠移植瘤微血管生成的影响[J]. 中华放射医学与防护杂志, 2017, 37(2): 96-101. Xiang GL, Zhu XH, Lin CZ, et al. Effects of radioactive 125I seeds implantation on microvessel formation in human lung adenocarcinoma xenografts in nude mice[J]. Chin J Radiol Med Prot, 2017, 37(2): 96-101. DOI:10.3760/cma.j.issn.0254-5098.2017.02.003 |
| [12] |
张晶, 王宇娟, 霍俊玲, 等. 宫颈癌组织中Survivin的表达及临床意义的系统评价[J]. 中国循证医学杂志, 2014, 14(2): 216-224. Zhang J, Wang YJ, Huo JL, et al. The expression and clinical significance of survivin in cervical cancer[J]. Chin J EBM, 2014, 14(2): 216-224. DOI:10.7507/1672-2531.20140038 |
| [13] |
杨彬, 赵瑛, 王丽华, 等. Livin、Caspase-3蛋白在不同胃病变组织中的表达及其临床意义[J]. 肿瘤药学, 2015, 5(1): 27-32. Yang B, Zhao Y, Wang LH, et al. Expression of Livin and Caspase-3 proteins in different gastric lesions and their clinical significance[J]. Anti-Tumor Pharm, 2015, 5(1): 27-32. DOI:10.3969/j.issn.2095-1264.2015.004 |
 2018, Vol. 38
2018, Vol. 38


