2. 421001 衡阳, 南华大学医学院应用解剖与生殖医学研究所;
3. 421001 衡阳, 南华大学医学院生理教研室;
4. 421001 衡阳, 南华大学医学院病理教研室;
5. 421001 衡阳, 南华大学公共卫生学院
2. Clinical Anatomy & Reproductive Medicine Application Institute, Medical College, University of South China, Hengyang 421001, China;
3. Department of Physiology, Medical College, University of South China, Hengyang 421001, China;
4. Department of Pathology, Medical College, University of South China, Hengyang 421001, China;
5. School of Public Health, University of South China, Hengyang 421001, China
放射性认知功能障碍是人体意外受到电离辐射或临床放射治疗后常见的放射性损伤,其临床表现主要为空间记忆、言语记忆、注意力及解决新问题的能力降低,部分患者最终发展成为痴呆[1-2],目前临床上尚无有效治疗方法。丰富环境被定义为复杂的无生命物与社会刺激的复合体[3],研究表明,丰富环境可以改善脑外伤所诱导的认知功能障碍[4],但目前鲜有关于丰富环境改善放射性认知功能障碍的报道。故本研究通过建立小鼠放射性认知功能障碍模型,给予丰富环境干预,初步探讨丰富环境对放射性认知功能障碍的保护作用及其可能机制,为临床治疗提供理论依据。
材料与方法1.实验动物及材料:清洁健康雌性2月龄昆明小鼠45只,体重(34±4)g,购买于湖南斯莱克景达实验动物有限公司[合格证号:SYXK(湘)2015-0001],在室温恒定在(22±2)℃,12 h光照、12 h黑暗的实验室中饲养,自由摄食与饮水,适应性饲养1周后进行实验;旷场(上海永州实验设备有限公司);一抗:山羊抗兔IBA-1(美国Abcam公司)、兔抗CD68、兔抗突触囊泡素(SYP)、鼠抗β-肌动蛋白(武汉三鹰公司);二抗:生物素化兔抗羊IgG(武汉三鹰公司)、辣根过氧化物酶标记的羊抗兔IgG、羊抗鼠IgG(美国Abcam公司);过氧化物酶标记的ABC复合物(美国Vector公司);浓缩型DAB试剂盒(北京中杉金桥公司);BCA蛋白浓度测定试剂盒、ECL发光液(北京康为世纪公司);137Cs HXFS-IA型生物辐照仪(中国核动力研究设计院设备制造厂)。
2.动物模型制备及实验分组:照射剂量参照文献[5-6]。45只小鼠采用随机数表法分成对照组、照射组、照射丰富环境组进行实验,每组15只,照射剂量:4 Gy单次137Cs γ射线全身均匀照射,剂量率1.118 Gy/min。对照组在相同的照射环境下,但给予0 Gy剂量照射。
3.丰富环境:丰富环境刺激参照文献[7]。照射丰富环境组在照射后的第2天开始进行丰富环境刺激,每天6 h(9: 00—15: 00),连续35 d。场地规格为120 cm×100 cm×60 cm,场内提供标准鼠粮及水,放置塑料转轮、S型隧道、迷宫、各种形状及颜色的塑料玩具等,玩具每日更换1次以增加对小鼠的感官刺激,场内垫木屑垫料,每天清理卫生,保持清洁。
4.新旧事物识别:参照文献[8]方法。丰富环境干预35 d后进行新旧事物识别实验检测认知功能。该实验的原理即小鼠对之前从未见过的事物表现出更强的好奇心。预实验时,在旷场(40 cm×40 cm×40 cm)对称部位放置形状及材质相同的两个物体A和B,将小鼠由旷场正中放入,熟悉物体5 min后取出小鼠,间隔1 h后进行实验期检测,将物体A更换为形状及材质不同的物体C,再次将小鼠放入场内自由探索,相机记录小鼠5 min内对新奇物体C的探索时间(time exploring novel obeject, TN)和熟悉物体A的探索时间(time exploring familiar obeject, TF)。旷场及其内物体用70%的乙醇去除小鼠残留气味。小鼠对新事物的分辨率用以下公式进行计算:(TN-TF)/(TN+TF)×100%,该指标越高说明小鼠记忆越好。
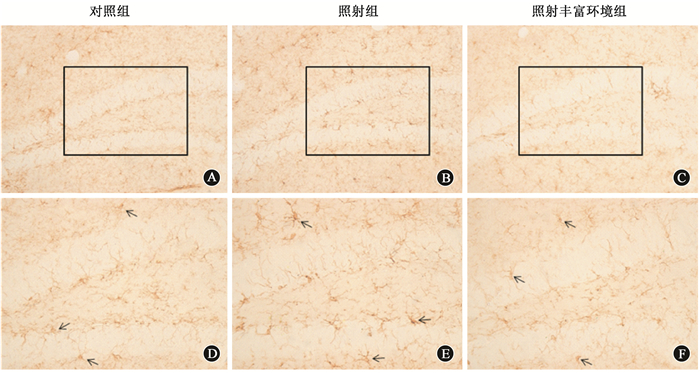
5.免疫组织化学染色:行为学检测结束后解剖小鼠取脑组织,置于4%多聚甲醛溶液中4℃固定过夜,经15%、30%蔗糖溶液梯度脱水后冰冻切片。切片经3%双氧水室温孵育28 min,磷酸盐缓冲溶液(PBS)漂洗10 min×3次,羊血清室温封闭2 h,滴加IBA-1一抗工作液(1: 1 000)室温孵育2 h后,4℃冰箱过夜。次日复温30 min后PBS 10 min×3次,滴加生物素化羊抗兔IgG(1: 200)室温孵育2 h,PBS 10 min×3次;滴加过氧化物酶标记的ABC复合物(1: 200)室温孵育2 h,PBS 10 min×3次。DAB溶液显色,适时终止反应,贴片晾干并常规脱水和封片。光学显微镜20倍镜下选取海马齿状回区同一视野进行拍照,计数切片左右两侧视野中IBA-1阳性细胞数总和,所有图像均在同等条件下拍摄获得。
6.蛋白质印迹(Western blot)分析:提取海马组织样本总蛋白,BCA法测定蛋白浓度,取15 μg蛋白,采用10%的SDS-PAGE进行蛋白电泳分离,转膜后经10%脱脂奶粉(PBST溶液溶解)室温封闭2 h。加入相应一抗于4℃孵育过夜,PBST溶液(2 000 ml PBS溶液+1 ml 0.2%Tween 20)洗膜10 min×3次,加入相应二抗室温孵育2 h,PBST 10 min×3次后采用ECL法进行显色,然后于凝胶图像分析系统拍照,并使用Image J软件分析目的及内参条带的灰度值,并用目的蛋白的灰度值比内参蛋白的灰度值,最终得出目的蛋白的相对表达量。一抗分别为兔抗CD68(1: 500)、兔抗SYP(1: 5 000)、鼠抗β-肌动蛋白(1: 3 000);二抗分别为辣根过氧化物酶标记的羊抗兔IgG(1: 1 000)、羊抗鼠IgG(1: 1 000)。
7.统计学处理:采用GraphPad Prism 6.0软件对数据进行统计分析并绘图。数据经正态性检验符合正态分布,以x±s表示。新事物分辨率、免疫组织化学和蛋白表达指标比较均采用单因素方差分析(One-way ANOVA),方差分析后采用Tukey法进行组间两两比较。P < 0.05为差异有统计学意义。
结果1.小鼠新旧事物识别实验结果:结果显示,丰富环境可改善辐射所诱导的认知功能障碍(F=4.28,P < 0.05)。与对照组小鼠新事物分辨率(26.53%± 4.52%)相比,照射组小鼠新事物分辨率(6.55%±5.41%)明显降低(t=3.66,P < 0.05),提示4 Gy照射可以诱导小鼠出现认知功能障碍;与照射组相比,照射丰富环境组小鼠新事物分辨率(25.97%±6.21%)明显升高,表明丰富环境可以改善辐射所诱导的认知功能障碍,差异有统计学意义(t=3.56,P < 0.05)。
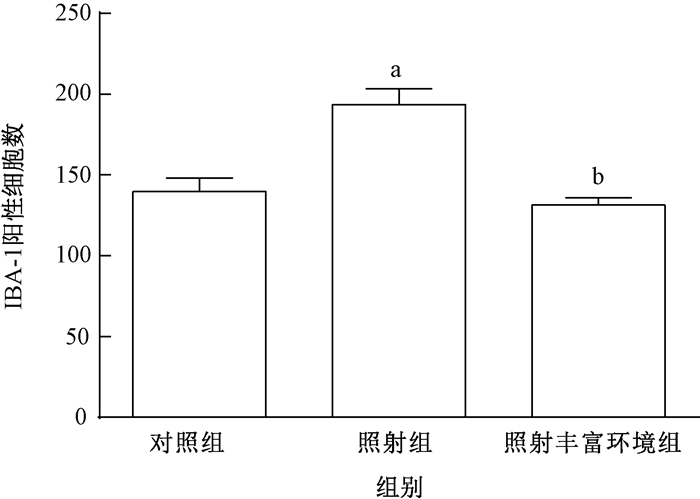
2.各组小鼠海马区IBA-1的免疫组织化学检测结果:免疫组织化学染色海马区IBA-1阳性细胞示于图 1,统计分析示于图 2。丰富环境可抑制辐射诱导的小鼠海马区IBA-1的表达上调(F=17.23,P < 0.05)。与对照组相比,照射组小鼠海马区IBA-1阳性细胞数目明显增多(t=6.83,P < 0.05);而照射丰富环境组海马区IBA-1阳性细胞数目相比较照射组明显减少,差异有统计学意义(t=7.69,P < 0.05)。
|
图 1 各组小鼠海马区IBA-1的表达免疫组织化学染色×20(A-C);×40(D-F) 注:箭头所指为IBA-1阳性细胞 Figure 1 The expression of IBA-1 in the hippocampus of mouse Immunohistochemical staining ×20(A-C); ×40(D-F) |
|
图 2 各组小鼠海马区IBA-1阳性细胞数 注:a与对照组相比,t=6.83,P < 0.05;b与照射组相比,t=7.69,P < 0.05 Figure 2 The number of IBA-1 positive cells in the hippocampus of mouse |
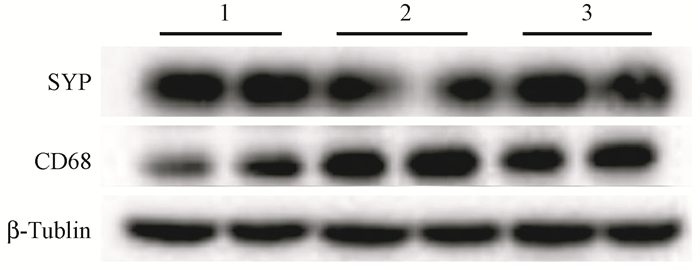
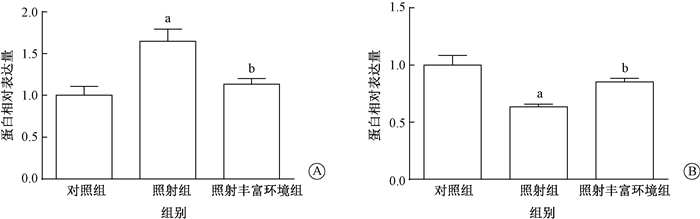
3.Western blot实验结果:丰富环境可抑制辐射诱导的小鼠海马区小胶质细胞活化以及神经元突触丢失(F=9.36、11.83,P < 0.05)。如图 3,4所示,与对照组相比,4 Gy照射后小鼠海马区小胶质细胞激活标记物CD68的表达水平上调,突触囊泡素(SYP)的表达下调(t=5.79、6.84,P < 0.05),表明4 Gy照射后小鼠海马区小胶质细胞活化增加,神经元突触丢失;而丰富环境干预后改善了这一情况,照射丰富环境组CD68的表达下调,SYP的表达上调,差异有统计学意义(t=4.59、4.06,P < 0.05)。
|
图 3 4 Gy照射后各组小鼠海马区CD68和SYP蛋白表达变化 1.对照组;2.照射组;3.照射丰富环境组 Figure 3 The expression of CD68 and SYP proteins in the hippocampus of mouse after 4 Gy irradiation |
|
图 4 4 Gy照射后各组小鼠海马区CD68(A)和SYP(B)蛋白的相对表达量 注:A:a与对照组比较,t=5.79,P < 0.05;b与照射组比较,t=4.59,P < 0.05;B:a与对照组比较,t=6.84,P < 0.05;b与照射组比较,t=4.06,P < 0.05 Figure 4 Protein quantification of CD68(A) and SYP(B) in the hippocampus of mouse after 4 Gy radiation |
讨论
随着核能和辐射应用越来越广泛,由辐射源放射事故、核辐射、宇宙辐射、职业受照等全身辐射所诱发的认知功能障碍履见报道[1, 9-11]。目前尚没有针对放射性认知功能障碍的有效治疗方法[12]。因此,探讨放射性认知功能障碍的机制并提出防治方法,具有重要临床价值。本研究给予4 Gy单次全身137Cs γ射线照射小鼠后,在新旧事物识别实验中,照射组小鼠表现出明显认知功能障碍,表明单次4 Gy全身照射小鼠可以成功建立放射性认知功能障碍模型,这与Allen等[5]的研究结果相一致。
丰富环境的概念于1947年由Van Praag等[3]提出,即增大实验动物的饲养空间,内置丰富新奇的物体以及动物之间进行更多地交往。研究表明,丰富环境具有改善认知、增强记忆的作用[13]。本研究行为学检测结果也表明,丰富环境可以改善电离辐射所诱导的认知功能障碍。虽然将丰富环境这一无创治疗方法运用于临床的随机对照研究仍鲜见开展,但部分学者将丰富环境干预运用于临床脑外伤患者时,发现患者的心理状态及认知功能均可以得到不同程度的改善[4],这进一步证实丰富环境对神经认知功能的保护作用。
小胶质细胞作为中枢神经系统的固有免疫细胞,在放射性认知功能障碍的发病机制中起着重要作用。研究表明,电离辐射可以诱导海马区小胶质细胞活化[14]。Xu等[15]的研究证实,丰富环境可以抑制海马区小胶质细胞活化。本实验通过免疫组织化学方法探讨丰富环境改善放射性认知功能障碍其机制是否与抑制海马区小胶质细胞激活有关。结果表明,辐射可以诱导海马区IBA-1阳性细胞数目增多,而丰富环境干预后,IBA-1阳性细胞数目明显减少。同时,本研究也通过Western blot方法得出辐射后海马区小胶质细胞活化标记物CD68的表达是上调的,丰富环境可以抑制辐射后CD68的表达上调。这进一步验证,电离辐射可以诱导小胶质细胞活化增加,丰富环境可减轻辐射后小胶质细胞的活化。
突触作为神经细胞之间信息传递的关键结构,是学习记忆的生物学基础[16]。SYP是突触囊泡膜上的一种特异性标记蛋白,能够准确的反应突触的分布和密度[17]。研究表明,海马神经突触中SYP表达下降会严重损害学习记忆能力[18]。Saito等[17]研究证明丰富环境可以抑制衰老诱导的神经元突触丢失。本实验中通过Western blot方法检测海马组织中SYP蛋白的表达变化,结果显示,辐射后海马组织中SYP蛋白表达明显下调,提示辐射后神经元突触有所丢失,而丰富环境可以抑制辐射诱导的SYP蛋白下调,这表明丰富环境改善放射性认知功能障碍的机制可能是通过减少神经元突触丢失。然而,有学者发现活化的小胶质细胞中有被吞噬的突触蛋白,表明活化的小胶质细胞可通过吞噬作用介导局部突触修剪过程发挥其固有的免疫功能,导致突触数量及功能下降[19-20]。本研究发现辐射后小胶质细胞活化增加,神经元突触丢失,但辐射诱导活化的小胶质细胞是否可以通过突触修剪方式介导神经元突触丢失,尚待进一步研究。
本研究结果表明,4 Gy全身137Cs γ射线照射可以成功建立放射性认知功能障碍模型,丰富环境可以改善模型小鼠认知功能,其机制可能与抑制海马区小胶质细胞激活以及减少神经元突触丢失有关。
利益冲突 本研究接受湖南省教育厅重点项目(14A125,16A187)、湖南省卫生计生委科研课题计划项目(C2016042)和南华大学博士科研启动基金(2015XQD27,2015XQD28)资助。所有研究者未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 乃爱桃负责研究方案的设计、动物饲养、行为学拍摄及评分、论文撰写;王贞负责免疫组织化学及Western blot操作;曹文宇、徐杨、刘政海负责实验设计指导和论文修改;何洁和陈熙负责数据统计和分析;何淑雅提供辐射仪及技术指导;艾小红、万炜负责总体实验设计、论文撰写指导
| [1] |
陈炜博, 刘玉龙, 卞华慧, 等. 南京"5.7"192Ir源放射事故患者的神经行为及心理健康改变[J]. 中华放射医学与防护杂志, 3016, 36(5): 372-376. Chen WB, Liu YL, Bian HH, et al. Nervous behavior and mental health changes in a case exposed to 192Ir source at "5.7" accident in Nanjing[J]. Chin J Radiol Med Prot, 3016, 36(5): 372-376. DOI:10.3760/cma.j.issn.0254-5098.2016.05.013 |
| [2] |
范兴文, 吴开良. 放射性认知功能障碍的机制研究进展[J]. 中华放射医学与防护杂志, 2014, 34(11): 876-880. Fan XW, Wu KL. Progress in studies on the mechanism of radiation-induced cognitive dysfunction[J]. Chin J Radiol Med Prot, 2014, 34(11): 876-880. DOI:10.3760/cma.j.issn.0254-5098.2014.11.022 |
| [3] |
Van Praag H, Kempermann G, Gage FH. Neural consequences of environmental enrichment[J]. Nat Rev Neurosci, 2000, 1(3): 191-198. DOI:10.1038/35044558 |
| [4] |
方杰, 罗爱华, 潘翠环, 等. 丰富环境对颅脑外伤大鼠学习记忆及海马神经元凋亡的影响[J]. 中国康复医学杂志, 2015, 30(2): 117-121. Fang J, Luo AH, Pan CH, et al. Effects of enriched environment on the function of learning, memory and apoptosis in hippocampus after traumatic brain injury in rats[J]. Chin J Rehabilitat Med, 2015, 30(2): 117-121. DOI:10.3969/j.issn.1001-1242.2015.02.003 |
| [5] |
Allen AR, Eilertson K, Sharma S, et al. Effects of radiation combined injury on hippocampal function are modulated in mice deficient in chemokine receptor 2(CCR2)[J]. Radiat Res, 2013, 180(1): 78-88. DOI:10.1667/RR3344.1 |
| [6] |
Dietrich J, Baryawno N, Nayyar N, et al. Bone marrow drives central nervous system regeneration after radiation injury[J]. J Clin Invest, 2018, 128(1): 281-293. DOI:10.1172/JCI90647 |
| [7] |
Cao WY, Hu ZL, Xu Y, et al. Role of early environmental enrichment on the social dominance tube test at adulthood in the rat[J]. Psychopharmacology (Berl), 2017, 234(22): 3321-3334. DOI:10.1007/s00213-017-4717-3 |
| [8] |
Bevins RA, Besheer J. Object recognition in rats and mice:a one-trial non-matching-to-sample learning task to study 'recognition memory'[J]. Nat Protoc, 2006, 1(3): 1306-1311. DOI:10.1038/NPROT.2006.205 |
| [9] |
Britten RA, Mitchell S, Johnson AM, et al. The identification of serum biomarkers of high-let radiation exposure and biological sequelae[J]. Health Phys, 2010, 98(2): 196-203. DOI:10.1097/HP.0b013e3181acff7c |
| [10] |
Encinas JM, Vazquez ME, Switzer RC, et al. Quiescent adult neural stem cells are exceptionally sensitive to cosmic radiation[J]. Exp Neurol, 2008, 210(1): 274-279. DOI:10.1016/j.expneurol.2007.10.021 |
| [11] |
孔雪源, 刘玉龙, 张冰洁, 等. 某市放射工作人员焦虑抑郁状况及影响因素分析[J]. 中华放射医学与防护杂志, 2014, 34(5): 367-370. Kong XY, Liu YL, Zhang BJ, et al. Logistic analysis on influencing factors of radiation workers anxiety and depression in some city[J]. Chin J Radiol Med Prot, 2014, 34(5): 367-370. DOI:10.3760/cma.j.issn.0254-5098.2014.05.013 |
| [12] |
Attia A, Page BR, Lesser GJ, et al. Treatment of radiation-induced cognitive decline[J]. Curr Treat Options Oncol, 2014, 15(4): 539-550. DOI:10.1007/s11864-014-0307-3 |
| [13] |
Lee EH, Hsu WL, Ma YL, et al. Enrichment enhances the expression of sgk, a glucocorticoid-induced gene, and facilitates spatial learning through glutamate AMPA receptor mediation[J]. Eur J Neurosci, 2003, 18(10): 2842-2852. DOI:10.1046/j.1460-9568.2003.03032.x |
| [14] |
Ramanan S, Kooshki M, Zhao W, et al. PPARα ligands inhibit radiation-induced microglial inflammatory responses by negatively regulating NF-κB and AP-1 pathways[J]. Free Radic Biol Med, 2008, 45(12): 1695-1704. DOI:10.1016/j.freeradbiomed.2008.09.002 |
| [15] |
Xu H, Gelyana E, Rajsombath M, et al. Environmental enrichment potently prevents microglia-mediated neuroinflammation by human amyloid β-protein oligomers[J]. J Neurosci, 2016, 36(35): 9041-9056. DOI:10.1016/j.bbi.2015.06.020 |
| [16] |
Kim JH, Park YK, Kim JH, et al. Transient recovery of synaptic transmission is related to rapid energy depletion during hypoxia[J]. Neurosci Lett, 2006, 400(1-2): 1-6. DOI:10.1016/j.neulet.2006.01.035 |
| [17] |
Saito S, Kobayashi S, Ohashi Y, et al. Decreased synaptic density in aged brains and its prevention by rearing under enriched environment as revealed by synaptophysin contents[J]. J Neurosci Res, 1994, 39(1): 57-62. DOI:10.1002/jnr.490390108 |
| [18] |
Schmitt U, Tanimoto N, Seeliger M, et al. Detection of behavioral alterations and learning deficits in mice lacking synaptophysin[J]. Neuroscience, 2009, 162(2): 234-243. DOI:10.1016/j.neuroscience.2009.04.046 |
| [19] |
Paolicelli RC, Bolasco G, Pagani F, et al. Synaptic pruning by microglia is necessary for normal brain development[J]. Science, 2011, 333(6048): 1456-1458. DOI:10.1126/science.1202529 |
| [20] |
Wake H, Moorhouse AJ, Jinno S, et al. Resting microglia directly monitor the functional state of synapses in vivo and determine the fate of ischemic terminals[J]. J Neurosci, 2009, 29(13): 3974-3980. DOI:10.1523/JNEUROSCI.4363-4308.2009 |
 2018, Vol. 38
2018, Vol. 38


