生活在地球环境中,人类不可避免的会受到辐射的影响,比如来自宇宙射线的照射,或者误食了含有放射性元素的食物,从事医疗照射、核武器试验、核能生产的职业人群和需要接受放射治疗的患者都易受到电离辐射的影响,因此寻找并开发积极有效的辐射防护药物具有重要意义。白藜芦醇(resveratrol, 3, 4, 5-三羟基-1, 2-二苯乙烯)是一种天然的多酚类植物抗毒素[1],广泛存在于葡萄皮、中药虎杖、桑葚、决明子、花生等植物中,研究发现其除了具有抑制肿瘤生长、抗炎、保护心血管及神经系统等多种功能外,还具有明显的放射防护作用。动物实验证实,白藜芦醇是一种安全、低毒、高效的放射防护剂。本文就白藜芦醇对造血系统、免疫系统、神经系统、呼吸系统以及其他器官的放射防护作用及相关机制进行综述。
一、白藜芦醇的放射防护作用1.白藜芦醇对造血系统的保护作用:机体的造血系统对辐射具有高度敏感性,照射可引起骨髓抑制并导致全血细胞的减少,随着照射剂量的增大,造血系统的损伤越严重[2]。Carsten等[3]研究证实了在接受3 Gy剂量γ射线照射的小鼠骨髓细胞中,100 mg/kg白藜芦醇能够明显降低染色体畸变的频率。100和300 mg/kg的白藜芦醇剂量可明显阻止照射后骨髓有核细胞数的降低,对照射后受损的骨髓具有明显的保护作用[4]。Zhang等[5]和Zhang等[6]的研究表明,白藜芦醇通过下调NADPH氧化酶4(NOX4)的表达和上调沉默信息调节因子2相关酶1(silent information regulator 2-related enzymes 1,Sirtuin 1,Sirt1),超氧化物岐化酶2(SOD2)和谷胱甘肽过氧化物酶1(Gpx1)的表达来改善由全身照射诱导的造血细胞损伤和造血干细胞(HSC)衰老,而且白藜芦醇和二苯基碘(diphenyleneiodonium,DPI)联合使用能够更有效地保护受照后骨髓单核细胞(BMMNCs)的功能,减少放射损伤。
2.白藜芦醇对免疫系统的保护作用:照射能够破坏机体免疫系统,引发多种炎症。在临床上白藜芦醇已表现出良好的抗炎效果。对于辐射诱发的急性期炎症,高蛋白饮食和白藜芦醇能够明显降低CD4+CD25+细胞中叉头蛋白3(forkhead box P3,Foxp3+)的表达;改变雌激素受体α(ERα)上共激活剂结合表面的结构,影响其与多种辅助调节因子的结合,抑制白细胞介素6(IL-6)的表达,对炎症反应起到调节作用[7-8]。白藜芦醇在间充质干细胞(MSCs)中抑制照射诱导的白细胞介素1β(IL-1β)表达是浓度依赖性的[9],可能通过激活Sirt1,Sirt1脱乙酰化核转录因子kappa B(NF-κB)使其反式激活电位受到抑制,进而阻止了NLRP-3炎性体活化,对照射诱导的炎症发挥作用。李斌等[10]发现白藜芦醇能够明显降低受照小鼠肠系膜淋巴节淋巴细胞凋亡指数,使其转化为浆细胞的数量增加,肠黏液中免疫球蛋白sIgA分泌增多,细菌移位减少,对小鼠肠黏膜免疫屏障起到很好的保护作用。
3.白藜芦醇对神经系统的保护作用:研究发现神经干细胞在接受8 Gy剂量X射线照射后,15 μmol/L的白藜芦醇具有明显的神经保护作用,即使在16 Gy的高剂量照射2和4 d后,白藜芦醇也能发挥作用,减少照射诱导的细胞死亡[11]。浓度50 mg/kg的白藜芦醇对小鼠坐骨神经的急性粉碎性损伤具有保护作用,但作用机制尚未了解清楚[12]。白藜芦醇通常作为Sirt1的一种激活剂,可通过激活Sirt1调节下游信号,对神经退行性疾病和脑卒中起到神经保护作用[13-14]。另外,Lopez等[15]研究证实了白藜芦醇可以预防中风和急性中枢神经系统(CNS)损伤后继发性损伤。由于白藜芦醇的这些有益作用,使其对神经系统的放射损伤治疗及防护具有广阔的应用前景。
4.白藜芦醇对呼吸系统的保护作用:肺是辐射敏感器官,临床上胸部肿瘤患者在接受放疗的过程中,正常肺组织不可避免地也会受到一定剂量的射线照射,造成放射性肺损伤,影响患者治疗。阎皓等[16]实验结果发现在放射性肺损伤小鼠模型中,白藜芦醇照射给药组与单照射组相比,照射引起的肺泡炎症反应明显降低,肺组织中丙二醛(MDA)的含量减少,SOD和Gpx1的酶活性和基因表达水平都明显升高,说明白藜芦醇能够改善肺组织炎症,对放射性肺损伤具有一定的保护作用。而且,白藜芦醇能有效地减轻X射线对人支气管上皮细胞(HBE)和人胚肺成纤维细胞(MRC5)细胞形态和超微结构的破坏,缓解X射线对细胞活力的影响和DNA的损伤,降低X射线照射后细胞凋亡,以及细胞活性氧(ROS)的水平和MDA的含量,增加细胞总谷胱甘肽(GSH)的含量和总SOD的活性,对HBE和MRC5细胞的放射损伤具有保护作用[17]。
5.其他:放射能够导致唾液分泌减少,唾液淀粉酶和超氧化物歧化酶活性降低。研究发现,在放射性唾液腺功能障碍的小鼠模型中,白藜芦醇能够减少由照射引起的唾液减少并恢复唾液淀粉酶和SOD活性,并抑制由辐射诱导的转化生长因子-β1表达,在临床放疗中可保护唾液腺免受照射的负面影响[18]。在接受紫外线(UVA)照射的视网膜色素上皮细胞(RPE)中,Chan等[19]发现白藜芦醇通过抑制UVA诱导的H2O2产生,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)激活和环氧酶(cyclo-oxygen-ase,COX-2)表达,增强细胞活性,减少UVA照射产生的损伤。同样的,在UVB照射的HaCaT细胞(一种人皮肤角质细胞)中,白藜芦醇能够降低UVB诱导的ROS形成,并促进含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,caspase 8)和DNA修复酶(poly ADP-ribose polymerase,PARP)的裂解,增强细胞凋亡,诱导自噬以消除UVB损伤的细胞,实现保护作用[20]。Aziz等[21]的研究也表明白藜芦醇通过抑制凋亡抑制基因(Survivin)和相关蛋白减少UVB照射对SKH-1无毛小鼠皮肤的损伤,可预防皮肤癌。除此之外,白藜芦醇对其他器官组织的放射防护作用也在进一步的研究中。
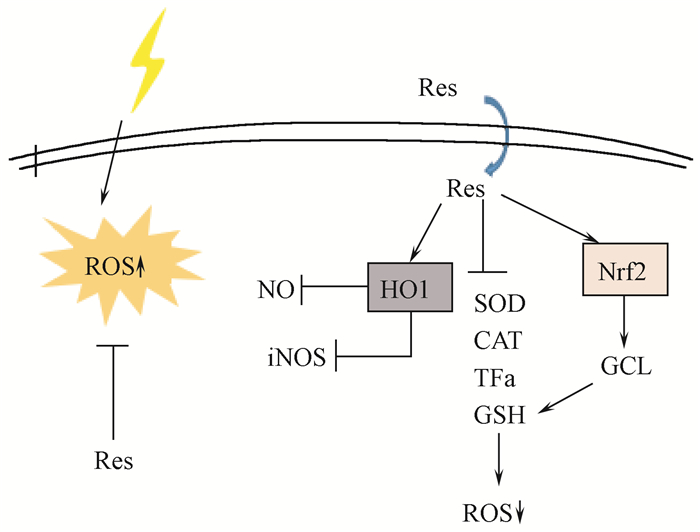
二、白藜芦醇的放射防护作用机制1.抗氧化机制:正常组织受到照射后会产生大量自由基,并作用于生物膜,引起脂质过氧化,造成生物膜功能和代谢的改变,自由基在体内大量蓄积也会导致蛋白质和DNA损伤,使辐射损伤进一步加重。白藜芦醇作为一种有效的抗氧化剂,可通过清除自由基并抑制自由基产生达到放射防护的目的。大量研究表明,白藜芦醇可通过抗氧化机制减少放射损伤。Ye等[22]发现白藜芦醇能够调节γ射线照射后线粒体中SOD的表达,从而阻断氧化应激反应的同时保护线粒体,减轻辐射对线虫的损伤作用。在人角质细胞中,白藜芦醇通过激活AMPK-FOXO3途径,阻止氧化应激引起的细胞衰老和增殖功能紊乱,减少氧化应激损伤[23]。Ryan等[24]观察连续7 d喂食0.05%白藜芦醇含量饮食的C57BL/6小鼠,Nox4蛋白和氧化型谷胱甘肽含量减少,H2O2的水平也明显降低。抗氧化机制的两种信号通路见图 1。
|
图 1 白藜芦醇通过HO1/Nrf2途径减少ROS形成 Figure 1 Resveratrol reduces ROS formation via the HO1/Nrf2 pathway |
(1) 通过HO1信号通路发挥作用:大量研究表明,血红素氧合酶-1(heme oxygenase-1,HO-1)/胆红素/CO共同组成了机体不可缺少的内源性保护系统,广泛参与抗炎与多种急慢性氧化应激损伤,能够防止多种疾病发生。研究发现在神经退行性病变中,白藜芦醇具有抗氧化和抗炎等细胞保护作用[25]。上述提到,照射能够诱导H2O2产生,从而导致氧化应激损伤。白藜芦醇可通过激活HO1信号通路和调节炎症反应,有效的阻止H2O2诱导的细胞毒性[26]。在C6星形胶质细胞系中,白藜芦醇通过促进HO1的表达,降低其下游信号iNOS(诱导型一氧化氮合酶)和NO的水平,阻止H2O2引起的SOD和过氧化氢酶(CAT)活性降低,并且下调肿瘤坏死因子α(TNF-α)水平和增加细胞外基质GSH的含量,减少氧化应激损伤[27]。
(2) 通过Nrf2途径发挥作用:核因子Nrf2是目前发现的抵御外源性刺激抗氧化应答反应的核心转录因子,受胞质接头蛋白(Keap1)的调控,通过与抗氧化反应元件ARE(antioxidant response element)相互作用,调节抗氧化蛋白和Ⅱ相解毒酶的表达。白藜芦醇可通过持续激活磷脂酰肌醇3-激酶(PI3K)/Akt和ERK(extracellular signal-regulated kinase)/MAPK途径诱导Nrf2活化,Nrf2活化后可显著降低细胞内ROS的产生,减少氧化应激后ROS的积累,抑制细胞凋亡,增强细胞活性[28-29]。Kode等[30]也证实了在人肺表皮细胞中,白藜芦醇通过激活Nrf2,上调抗氧化基因谷氨酸半胱氨酸连接酶(GCL)的转录活性,促进GSH的合成,同时猝灭已经释放的活性氧,减少氧化应激损伤,说明白藜芦醇通过激活Nrf2介导的抗氧化防御机制发挥放射防护作用。
(3) 其他:白藜芦醇对高浓度的谷氨酸盐引起的氧化应激损伤也有较强的保护作用,这种保护作用并不是通过它清除自由基的能力,而是通过有选择性的诱导线粒体SOD2的表达,降低氧化应激和损伤[31]。白藜芦醇对SOD2的这种调节作用是通过激活PI3K/Akt和糖原合成酶激酶-3 (GSK-3β)/β-链蛋白(β-catenin)信号通路实现的,β-catenin进入细胞核后和T细胞因子(T cell factor,TCF)家族转录因子或FOXO结合,激活靶基因,上调SOD2的表达。研究发现,白藜芦醇可通过调节GSH的生物合成、循环和消耗来维持GSH在体内的平衡,减少氧化应激引起的DNA损伤、染色体断裂和细胞凋亡[32]。也有学者认为白藜芦醇可通过抑制ROS产生,NADPH氧化酶,Akt磷酸化,p38 MAPK / c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)/ ERK(extracellular regulated protein kinases)磷酸化,以及IκB-α和NF-κB的活性来减少氧化应激[33]。此外,白藜芦醇能够激活AMPK,促进Akt-nNOS信号通路的活性,减少ROS和NAPDH氧化酶的产生,上调SOD2的水平,减少氧化应激损伤[34],保护线粒体的功能,而这种作用依赖于Sirt1[35]。
2.通过激活Sirt1调节下游信号:白藜芦醇通常作为Sirt1的一种激活剂,通过Sirt1激活引起下游相关蛋白的变化,进而发挥生理作用。白藜芦醇通过作用于Sirt1,抑制NF-κB激活以及炎性因子ICAM-1、IL-6、IL-1β和TNF-α的表达,具有抗炎、抗氧化、抑制细胞凋亡和减弱DNA损伤的作用[9, 36-37]。而且,白藜芦醇激活Sirt1后,可调节多种蛋白质的活性,包括过氧化物酶体增殖物激活受体共激活因子-1α(PGC-1α)、FOXO家族、Akt和核因子β等,与Sirt1相互作用发挥其治疗效果[13, 38]。Arunachalam等[39]发现白藜芦醇激活Sirt1后,能够减少eNOS乙酰化,从而有效地降低了氧化应激对内皮细胞的损伤。Sirt1基因沉默后,则减弱了白藜芦醇对辐射诱导的NLRP-3和IL-1β的抑制作用,说明白藜芦醇可能通过激活Sirt1,抑制NLRP-3、IL-1β的表达,从而减轻照射引起的细胞损伤[40]。
3.促使TyrRs入核发挥功能:对白藜芦醇和酪氨酸的结构进行分析,两者都包含有一个苯酚的结构,这说明白藜芦醇很有可能像酪氨酸一样,会和TyrRs(酪氨酸tRNA合成酶)结合,影响其功能。Sajish和Schimmel[41]的实验发现白藜芦醇和TyrRs结合后,会改变其下游的酶促反应,促使TyrRs进入细胞核,使PARP-1发生核糖基化,进而影响相关蛋白的表达。PARP-1会使BRCA1发生核糖基化,并和核糖基化的BRCA1相互作用,形成PARP1-BRCA1-RAP80复合物,在同源重组修复的过程中对维持修复的稳定性和准确性发挥重要作用[42]。TyrRs进入细胞核后,也会激活转录因子E2F1下游的DNA修复基因,防止氧化应激造成的DNA损伤[43]。在UV照射造成DNA双链断裂的动物模型中,TyrRs进入细胞核会和蛋白TRIM28以及HDAC1相互作用,使E2F1乙酰化并激活BRCA1、RAD51等DNA修复基因,减少DNA损伤[44]。
三、展望白藜芦醇的抗氧化能力较强且在植物体内分布广泛。目前,白藜芦醇作为一种安全有效的辐射防护剂有着广泛的应用前景,除了上述提到的对造血、免疫、神经和呼吸系统等有保护作用外,对生殖系统也有一定的放射防护作用[45-46]。在动物试验中,白藜芦醇的使用剂量很广,但并不意味着剂量越高,效果越好,这可能与白藜芦醇的生物利用度较低有关,因此,提高白藜芦醇在体内的生物利用度具有重要意义。有文献报道,白藜芦醇衍生物白皮杉醇(piceatannol)和乙酰化白藜芦醇与白藜芦醇相比,稳定性增强且生物利用度提高[47],具有更好的放射防护作用。开发合成更有效的白藜芦醇衍生物作为辐射防护剂也是科学界研究的热点。另外,虽然白藜芦醇和其衍生物都展现出较好的放射抗性,但如何降低白藜芦醇及其代谢物的毒性甚至完全无毒,更好地应用于临床仍需研究人员的进一步探索。
利益冲突 本研究还接受协和小规模特色办学经费(10023201601602)、中国医学科学院医学与健康科技创新工程项目(2017-I2M-1-021)资助;所有作者对该研究无利益冲突作者贡献声明 高飘阳负责收集文献和撰写初稿;杜利清修改和完善论文;刘强指导论文撰写及定稿
| [1] |
Sanders TH, McMichael RW, Hendrix KW. Occurrence of resveratrol in edible peanuts[J]. J Agric Food Chem, 2000, 48(4): 1243-1246. DOI:10.1021/jf990737b |
| [2] |
王月英, 吴红英, 李德冠, 等. 不同剂量137Cs γ射线照射对小鼠造血系统的影响[J]. 国际放射医学核医学杂志, 2013, 37(1): 1-4. Wang YY, Wu HY, Li DG, et al. Effects of different 137Cs γ radiation dose on mouse hematopoietic system[J]. Int J Radiat Med Nucl Med, 2013, 37(1): 1-4. DOI:10.3760/cma.j.issn.1673-4114.2013.01.001 |
| [3] |
Carsten RE, Bachand AM, Bailey SM, et al. Resveratrol reduces radiation-induced chromosome aberration frequencies in mouse bone marrow cells[J]. Radiat Res, 2008, 169(6): 633-638. DOI:10.1667/RR1190.1 |
| [4] |
马征, 黄凰, 张莹莹, 等. 白藜芦醇对辐射损伤的保护作用[J]. 中南大学学报(医学版), 2013, 38(6): 597-601. Ma Z, Huang H, Zhang YY, et al. Anti-radiation effect of resveratrol[J]. J Central South Univ (Medical Science), 2013, 38(6): 597-601. DOI:10.3969/j.issn.1672-7347.2013.06.008 |
| [5] |
Zhang H, Zhai Z, Wang Y, et al. Resveratrol ameliorates ionizing irradiation-induced long-term hematopoietic stem cell injury in mice[J]. Free Radic Biol Med, 2013, 54: 40-50. DOI:10.1016/j.freeradbiomed.2012.10.530 |
| [6] |
Zhang J, Han X, Huang S, et al. The combined effect of resveratrol and diphenyleneiodonium on irradiation-induced injury to the hematopoietic system[J]. Int Immunopharmacol, 2017, 43: 33-39. DOI:10.1016/j.intimp.2016.12.002 |
| [7] |
Kim KO, Park H, Chun M, et al. Immunomodulatory effects of high-protein diet with resveratrol supplementation on radiation-induced acute-phase inflammation in rats[J]. J Med Food, 2014, 17(9): 963-971. DOI:10.1089/jmf.2013.2976 |
| [8] |
Nwachukwu JC, Srinivasan S, Bruno NE, et al. Resveratrol modulates the inflammatory response via an estrogen receptor-signal integration network[J]. Elife, 2014, 3: e02057. DOI:10.7554/eLife.02057 |
| [9] |
Fu Y, Wang Y, Du L, et al. Resveratrol inhibits ionising irradiation-induced inflammation in MSCs by activating SIRT1 and limiting NLRP-3 inflammasome activation[J]. Int J Mol Sci, 2013, 14(7): 14105-14118. DOI:10.3390/ijms140714105 |
| [10] |
李斌, 潘粉丽, 常崇旺. 白藜芦醇对辐射损伤后小鼠肠粘膜免疫屏障的保护作用[J]. 贵州大学学报(自然科学版), 2008, 25(6): 645-648. Li B, Pan FL, Chang CW. Protective effects of resveratrol on intestinal mucosal immunologic barrier in mice after radiation damage[J]. J Guizhou Univ (Natural Sciences), 2008, 25(6): 645-648. DOI:10.3969/j.issn.1000-5269.2008.06.024 |
| [11] |
Prager I, Patties I, Himmelbach K, et al. Dose-dependent short- and long-term effects of ionizing irradiation on neural stem cells in murine hippocampal tissue cultures: neuroprotective potential of resveratrol[J]. Brain Behav, 2016, 6(10): e00548. DOI:10.1002/brb3.548 |
| [12] |
Hakan AK, I smail GülşEN, Mikail Kara, et al. Effects of resveratrol on acute sciatic nerve injury in a rat model[J]. J Neurol Sci, 2015, 32(2): 303-310. |
| [13] |
Pallàs M, Casadesús G, Smith MA, et al. Resveratrol and neurodegenerative diseases: activation of SIRT1 as the potential pathway towards neuroprotection[J]. Curr Neurovasc Res, 2009, 6(1): 70-81. DOI:10.2174/156720209787466019 |
| [14] |
Singh N, Agrawal M, Doré S. Neuroprotective properties and mechanisms of resveratrol in in vitro and in vivo experimental cerebral stroke models[J]. ACS Chem Neurosci, 2013, 4(8): 1151-1162. DOI:10.1021/cn400094w |
| [15] |
Lopez MS, Dempsey RJ, Vemuganti R. Resveratrol neuroprotection in stroke and traumatic CNS injury[J]. Neurochem Int, 2015, 89: 75-82. DOI:10.1016/j.neuint.2015.08.009 |
| [16] |
阎皓, 张恒, 辛绍斌, 等. 虎杖提取物白藜芦醇对放射性肺损伤防护作用机制研究[J]. 河北中医, 2015(5): 721-724, 727. Yan H, Zhang H, Xin SB, et al. Mechanism research of the protective effects of resveratrol extracted from Polygonum cuspidatum on radiation-induced pulmonary injury[J]. Hebei J Tradit Chin Med, 2015(5): 721-724, 727. DOI:10.3969/j.issn.1002-2619.2015.05.029 |
| [17] |
Fu XY, Xue JX, Zhou L, et al. The protection effects of resveratrol on irradiated human pneumonic cell lines and its mechanism[J]. Sichuan Da Xue Xue Bao Yi Xue Ban, 2012, 43(3): 319-324. |
| [18] |
Xu L, Yang X, Chen J, et al. Simvastatin attenuates radiation-induced salivary gland dysfunction in mice[J]. Drug Des Devel Ther, 2016, 10: 2271-2278. DOI:10.2147/DDDT.S105809 |
| [19] |
Chan CM, Huang CH, Li HJ, et al. Protective effects of resveratrol against UVA-induced damage in ARPE19 cells[J]. Int J Mol Sci, 2015, 16(3): 5789-5802. DOI:10.3390/ijms16035789 |
| [20] |
Vitale N, Kisslinger A, Paladino S, et al. Resveratrol couples apoptosis with autophagy in UVB-irradiated HaCaT cells[J]. PLoS One, 2013, 8(11): e80728. DOI:10.1371/journal.pone.0080728 |
| [21] |
Aziz MH, Afaq F, Ahmad N. Prevention of ultraviolet-B radiation damage by resveratrol in mouse skin is mediated via modulation in survivin[J]. Photochem Photobiol, 2005, 81(1): 25-31. DOI:10.1562/2004-08-13-RA-274 |
| [22] |
Ye K, Ji CB, Lu XW, et al. Resveratrol attenuates radiation damage in caenorhabditis elegans by preventing oxidative stress[J]. J Radiat Res, 2010, 51: 473-479. DOI:10.1269/jrr.10009 |
| [23] |
Ido Y, Duranton A, Lan F, et al. Resveratrol prevents oxidative stress-induced senescence and proliferative dysfunction by activating the AMPK-FOXO3 cascade in cultured primary human keratinocytes[J]. PLoS One, 2015, 10(2): e0115341. DOI:10.1371/joumal.pone.0115341 |
| [24] |
Ryan MJ, Jackson JR, Hao Y, et al. Suppression of oxidative stress by resveratrol after isometric contractions in gastrocnemius muscles of aged mice[J]. J Gerontol A Biol Sci Med Sci, 2010, 65(8): 815-831. DOI:10.1093/gerona/glq080 |
| [25] |
Mishra V, Shuai B, Kodali M, et al. Resveratrol treatment after status epilepticus restrains neurodegeneration and abnormal neurogenesis with suppression of oxidative stress and inflammation[J]. Sci Rep, 2015, 5: 17807. DOI:10.1038/srep17807 |
| [26] |
Sakata Y, Zhuang H, Kwansa H, et al. Resveratrol protects against experimental stroke: putative neuroprotective role of heme oxygenase 1[J]. Exp Neurol, 2010, 224(1): 325-329. DOI:10.1016/j.expneurol.2010.03.032 |
| [27] |
Quincozes-Santos A, Bobermin LD, Latini A, et al. Resveratrol protects C6 astrocyte cell line against hydrogen peroxide-induced oxidative stress through heme oxygenase 1[J]. PLoS One, 2013, 8(5): e64372. DOI:10.1371/journal.pone.0064372 |
| [28] |
Csiszár A, Csiszar A, Pinto JT, et al. Resveratrol encapsulated in novel fusogenic liposomes activates Nrf2 and attenuates oxidative stress in cerebromicrovascular endothelial cells from aged rats[J]. J Gerontol A Biol Sci Med Sci, 2015, 70(3): 303-313. DOI:10.1093/gerona/glu029 |
| [29] |
Jin X, Wang K, Liu H, et al. Protection of bovine mammary epithelial cells from hydrogen peroxide-induced oxidative cell damage by resveratrol[J]. Oxid Med Cell Longev, 2016, 2016: 2572175. DOI:10.1155/2016/2572175 |
| [30] |
Kode A, Rajendrasozhan S, Caito S, et al. Resveratrol induces glutathione synthesis by activation of Nrf2 and protects against cigarette smoke-mediated oxidative stress in human lung epithelial cells[J]. Am J Physiol Lung Cell Mol Physiol, 2008, 294(3): L478-488. DOI:10.1152/ajplung.00361.2007 |
| [31] |
Fukui M, Choi HJ, Zhu BT. Mechanism for the protective effect of resveratrol against oxidative stress-induced neuronal death[J]. Free Radic Biol Med, 2010, 49(5): 800-813. DOI:10.1016/j.freeradbiomed.2010.06.002 |
| [32] |
Chen C, Jiang X, Lai Y, et al. Resveratrol protects against arsenic trioxide-induced oxidative damage through maintenance of glutathione homeostasis and inhibition of apoptotic progression[J]. Environ Mol Mutagen, 2015, 56(3): 333-346. DOI:10.1002/em.21919 |
| [33] |
Guo R, Li W, Liu B, et al. Resveratrol protects vascular smooth muscle cells against high glucose-induced oxidative stress and cell proliferation in vitro[J]. Med Sci Monit Basic Res, 2014, 20: 82-92. DOI:10.12659/MSMBR.890858 |
| [34] |
Cheng PW, Ho WY, Su YT, et al. Resveratrol decreases fructose-induced oxidative stress, mediated by NADPH oxidase via an AMPK-dependent mechanism[J]. Br J Pharmacol, 2014, 171(11): 2739-2750. DOI:10.1111/bph.12648 |
| [35] |
Price NL, Gomes AP, Ling AJ, et al. SIRT1 is required for AMPK activation and the beneficial effects of resveratrol on mitochondrial function[J]. Cell Metab, 2012, 15(5): 675-690. DOI:10.1016/j.cmet.2012.04.003 |
| [36] |
Csiszar A, Labinskyy N, Podlutsky A, et al. Vasoprotective effects of resveratrol and SIRT1: attenuation of cigarette smoke-induced oxidative stress and proinflammatory phenotypic alterations[J]. Am J Physiol Heart Circ Physiol, 2008, 294(6): H2721-2735. DOI:10.1152/ajpheart.00235.2008 |
| [37] |
Li J, Feng L, Xing Y, et al. Radioprotective and antioxidant effect of resveratrol in hippocampus by activating Sirt1[J]. Int J Mol Sci, 2014, 15(4): 5928-5939. DOI:10.3390/ijms15045928 |
| [38] |
Lagouge M, Argmann C, Gerhart-Hines Z, et al. Resveratrol improves mitochondrial function and protects against metabolic disease by activating SIRT1 and PGC-1alpha[J]. Cell, 2006, 127(6): 1109-1122. DOI:10.1016/j.cell.2006.11.013 |
| [39] |
Arunachalam G, Yao H, Sundar IK, et al. SIRT1 regulates oxidant- and cigarette smoke-induced eNOS acetylation in endothelial cells: Role of resveratrol[J]. Biochem Biophys Res Commun, 2010, 393(1): 66-72. DOI:10.1016/j.bbrc.2010.01.080 |
| [40] |
付岳, 王彦, 杜利清, 等. SIRT1基因沉默在辐射诱导的NLRP3和IL-1β表达中的作用研究[J]. 国际放射医学核医学杂志, 2015, 39(5): 367-370. Fu Y, Wang Y, Du LQ, et al. Effects of NLRP3 and IL-1β on radiation-induced expression through SIRT1 gene silencing[J]. Int J Radiat Med Nucl Med, 2015, 39(5): 367-370. DOI:10.3760/cma.j.issn.1673-4114.2015.05.003 |
| [41] |
Sajish M, Schimmel P. A human tRNA synthetase is a potent PARP1-activating effector target for resveratrol[J]. Nature, 2015, 519(7543): 370-373. DOI:10.1038/nature14028 |
| [42] |
Hu Y, Petit SA, Ficarro SB, et al. PARP1-driven poly-ADP-ribosylation regulates BRCA1 function in homologous recombination-mediated DNA repair[J]. Cancer Discov, 2014, 4(12): 1430-1447. DOI:10.1158/2159-8290.CD-13-0891 |
| [43] |
Cao X, Li C, Xiao S, et al. Acetylation promotes TyrRS nuclear translocation to prevent oxidative damage[J]. Proc Natl Acad Sci USA, 2017, 114(4): 687-692. DOI:10.1073/pnas.1608488114 |
| [44] |
Wei N, Shi Y, Truong LN, et al. Oxidative stress diverts tRNA synthetase to nucleus for protection against DNA damage[J]. Mol Cell, 2014, 56(2): 323-332. DOI:10.1016/j.molcel.2014.09.006 |
| [45] |
杨彦磊. 白藜芦醇对模型大鼠睾丸辐射损伤的保护机制研究[D]. 郑州: 郑州大学, 2014. Yang YL. The protective mechanisms research of resveratrol on rat model testicular radiation damage[D]. Zhengzhou: Zhengzhou University, 2014. |
| [46] |
徐冰心, 李伟, 李成林, 等. 白藜芦醇对γ射线致小鼠生殖细胞损伤的防护作用研究[J]. 中华卫生应急电子杂志, 2015, 1(3): 37-39. Xu BX, Li W, Li CL, et al. Protective effects of resveratrol on 60Co-Gamma rays-induced reproductive cell damage in mice[J]. Chin J Hygiene Rescue (Electronic Edition), 2015, 1(3): 37-39. DOI:10.3877/cma.j.issn.2095-9133.2015.03.011 |
| [47] |
王春燕, 郝述霞, 佟鹏, 等. 白藜芦醇衍生物白皮杉醇和乙酰化白藜芦醇辐射防护作用研究[J]. 癌变·畸变·突变, 2012, 24(5): 345-348. Wang CY, Hao SX, Tong P, et al. Radiation-protective effects of piceatannol and acetylated resveratrol[J]. Carcin Teratogen Mut, 2012, 24(5): 345-348. DOI:10.3969/j.issn.1004-616x.2012.05.005 |
 2018, Vol. 38
2018, Vol. 38


