2. 100142 北京, 解放军空军总医院放疗科
2. Department of Radiotherapy, Air Force General Hospital, Beijing 100142, China
胰腺癌发病隐匿、极易转移,是一种预后极差的消化系统恶性肿瘤,5年生存率不超过5%。确诊时约30%的患者属于局部晚期胰腺癌(locally advanced pancreatic cancer,LAPC),30%~50%的患者在诊断LAPC的3个月内出现远处转移[1]。采用精确放射治疗技术治疗胰腺癌不仅有较高的局部控制率,还能改善生存质量[2]。血清CA19-9是最常用且对于胰腺癌诊断敏感性较高的肿瘤标志物,患者血清CA19-9水平的高低与预后有较明确的临床意义[3]。使用螺旋断层调强放射治疗(tomotherapy)技术,在保证危及器官安全剂量下提高总剂量及分次剂量,提高了生物有效剂量(biological effective dose,BED),治疗不同期别胰腺癌获得了局部控制率和生存率的改善[4]。本研究在此基础上进一步观察采用该模式治疗的胰腺癌前后患者的血清CA19-9水平变化,探讨血清CA19-9下降程度对于胰腺癌患者螺旋断层调强放疗(TOMO)高剂量、少分次放疗模式治疗效果的预测作用。
资料与方法1.临床资料:本研究回顾性分析从2012年12月至2017年6月间于空军总医院放疗科收治的170例胰腺癌患者。入组标准:①经组织病理学或细胞病理学确诊为胰腺癌。②年龄≤85岁。③功能状态评分(karnofsky performance scale,KPS)≥60分。④经外科会诊无手术切除可能或拒绝手术治疗。⑤耐受仰卧位平躺≥30 min。⑥已签署治疗同意书。排除标准:①近5年有其他恶性肿瘤史。②对胰腺癌病灶既往行手术切除、放射治疗、化疗、生物免疫治疗等局部或系统治疗。③患有精神疾病、重要器官病变及系统性严重疾病。④怀孕、哺乳期妇女。依据入组及排除标准,共入组75例,一般资料列于表 1。
|
|
表 1 75例胰腺癌患者临床资料 Table 1 Characteristics of 75 pancreatic cancer patients |
2.血清CA19-9水平的测定:包括基线水平测定及放疗后4~6周水平测定,放疗前1周清晨空腹抽取静脉血5 ml,胆道梗阻患者先行减黄治疗,待血清总胆红素(TBIL)回归正常(≤50 U/ml)后留取血液样本,排除胆道梗阻对血清CA19-9水平造成的影响。4℃下转速3 000 r/min,离心半径10 cm,离心10 min,采用电化学发光法(ECI)测定血清CA19-9水平。检测仪器为西门子ADVIA Centaur全自动化学发光免疫分析及配套试剂,正常值范围0~30.9 U/ml;放疗后测定于本院或外院,同样采用电化学发光法。
3.治疗方案
(1) 放疗设备及剂量模式:放疗设备为美国安科锐公司TOMO放射治疗系统,由两位经验丰富的肿瘤放疗科医师勾画肿瘤区(GTV)、临床靶区(CTV)、计划靶区(PTV)及危及器官。GTV为定位CT肿瘤体积,CTV为GTV外扩5 mm,包括高危淋巴结引流区,对于胰头肿瘤,主要淋巴结引流区包括胰-十二指肠、腹腔、肝门及胰上淋巴结。对于胰尾肿瘤,也需要足够的边界包括高危淋巴结。PTV为CTV周边外扩5 mm,上下方向外扩1 cm。综合肿瘤位置、体积、危及器官受量来制定处方剂量,GTV总剂量65~70 Gy,CTV总剂量为55~60 Gy,PTV总剂量为45~50 Gy,共15~17次,1次/d,5次/周。危及器官包括胃和十二指肠。Dmax为组织最大受照剂量,D1、D3、D5、D10分别为1、3、5、10 cm3组织体积受照剂量,胃:Dmax≤60 Gy,D1≤55 Gy,D3≤50 Gy,D5≤45 Gy,D10≤40 Gy;十二指肠:Dmax≤55 Gy,D1≤50 Gy,D3≤45 Gy。所有患者均签署知情同意书并按计划完成放射治疗。
(2) 化疗:放疗同时根据病期和患者耐受状况,29例完成静脉滴注每周1次吉西他滨600 mg/m2化疗,连用3周;16例口服替吉奥40~60 mg,2次/d,连用2周后停1周,3周为1个治疗周期,6例联用吉西他滨与替吉奥。
4.随访及疗效评定:通过门诊复查及电话随访获得患者生存信息、CA19-9水平、局部肿瘤控制情况或远处转移情况,治疗后1、3、6个月及随后每3个月随访1次,复查内容包括:CA19-9水平检测、腹部增强CT或MRI,胸部CT检查,经济条件较好患者治疗后3~6个月后每年行1次PET/CT复查。主要观察患者总生存期(overall survival,OS)、无进展生存期(progression-free survival,PFS)、疾病进展时间(time to progression,TTP)和肿瘤局部控制情况。根据实体瘤疗效评价标准RECIST 1.1评价肿瘤控制情况,评价于患者结束放射治疗开始。
5.统计学处理:采用SPSS 22.0软件对数据统计分析,血清CA19-9水平为偏态分布,将其转换为自然对数再分析,正态分布的计量资料采用x±s表示,用中位数表示非正态分布的计数资料。绘制受试者工作特征曲线(ROC)确定治疗后CA19-9下降程度与肿瘤局部控制、无进展生存期及总生存期的相关性,选取截断值。生存分析采用Kaplan-Meier法,组间生存差异性检验采用Log-rank法,对计数资料进行χ2检验,基线与放疗后血清CA19-9水平比较采用配对t检验,P<0.05为差异有统计学意义。
结果1.生存情况:截至2017年10月,入选75例患者中45例死亡,30例生存。基线CA19-9水平为1 109 U/ml(39.70~70 000 U/ml),全组患者中位生存期(MST) 13.8个月(2.0~58.0个月)。
2.基线CA19-9正常、异常与患者预后的关系:11例血清CA19-9正常者MST为20.0个月(95% CI: 14.69~25.31个月),64例异常者MST为12.5个月(95% CI: 10.02~14.98个月),差异无统计学意义(P>0.05)。正常患者中位PFS为9.0个月(95% CI: 5.56~12.44个月),异常患者中位PFS为5.5个月(95% CI: 4.64~6.36个月),差异无统计学意义(P>0.05)。
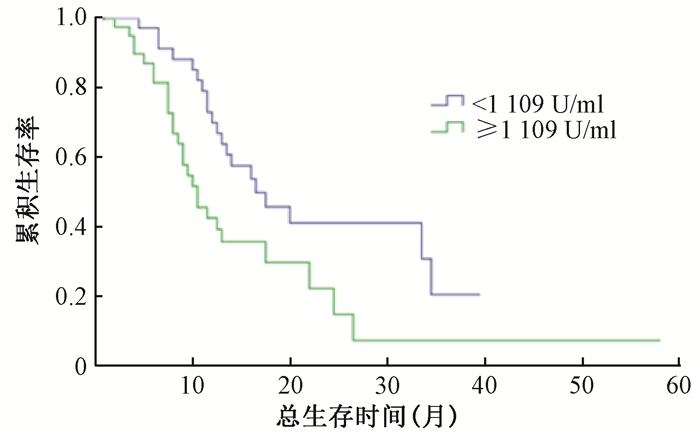
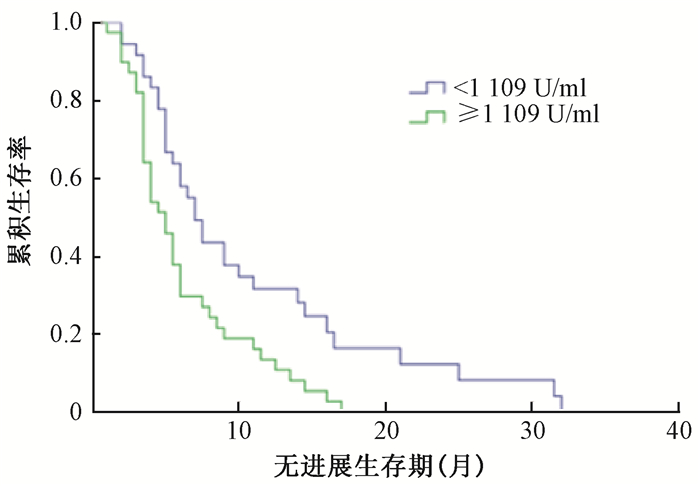
3.基线CA19-9水平高、低与患者预后的关系:根据血清基线CA19-9中位数1 109 U/ml,将患者分成高、低水平两组,生存分析结果提示基线<1 109 U/ml组与≥1 109 U/ml组MST分别为14.0个月(95% CI: 10.04~22.96个月)和9.0个月(95% CI: 7.75~13.25个月),差异有统计学意义(χ2=6.31,P<0.05,图 1)。基线<1 109 U/ml组与≥1 109 U/ml组中位PFS分别为7.0个月(95% CI: 5.58~8.42个月)和5.0个月(95% CI: 3.81~6.20个月),差异有统计学意义(χ2=8.51,P<0.05,图 2)。
|
图 1 基线CA19-9<1 109 U/ml组与≥1 109 U/ml组生存曲线 Figure 1 Comparison of OS curves of the baseline serum CA19-9 levels between < 1 109 and ≥1 109 U/ml |
|
图 2 基线CA19-9<1 109 U/ml组与≥1 109 U/ml组无进展生存曲线 Figure 2 Comparison of PFS curves of baseline serum CA19-9 levels between < 1 109 and ≥1 109 U/ml |
4.放疗后4~6周CA19-9上升或下降与患者预后的关系:因患者依从性及电话随访的准确性差,17例放疗后4~6周血清CA19-9指标无法准确获得,9例为基线CA19-9正常者,正常患者放疗前CA19-9中位数为14.7 U/ml,放疗后4~6周中位数为12.7 U/ml,两组资料行配对t检验,差异无统计学意义(P>0.05)。对于血清CA19-9正常的胰腺癌患者,放疗前与放疗后4~6周血清CA19-9水平差异无统计学意义,不纳入研究。
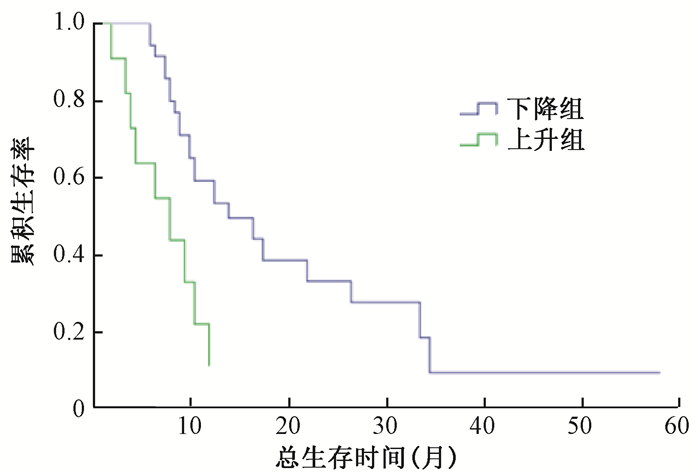
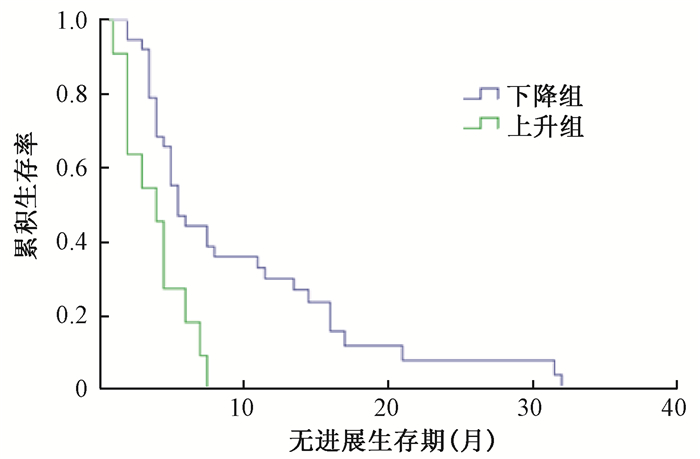
49例基线CA19-9异常患者放疗后4~6周CA19-9水平397.7 U/ml(11.02~43 250 U/ml),38例(38/49,77.6%)与基线水平对比有下降,11例(11/49,22.4%)上升,按照是否下降分为两组。下降组、上升组MST分别为14.0个月(95% CI: 7.24~20.77个月)和8.0个月(95% CI: 2.69~13.31个月),差异有统计学意义(χ2=11.19,P<0.05,图 3)。下降组、上升组中位PFS分别为5.5个月(95% CI: 4.05~6.95个月)和4.0个月(95% CI: 1.98~6.02个月),差异有统计学意义(χ2=9.12,P<0.05,图 4)。
|
图 3 放疗后4~6周CA19-9上升、下降组生存曲线 Figure 3 Comparison of OS curves of serum CA19-9 between increased and decreased 4-6 weeks after tomotherapy |
|
图 4 放疗后4~6周CA19-9上升、下降组无进展生存曲线 Figure 4 Comparison of PFS curves of serum CA19-9 between increased and decreased 4-6 weeks after tomotherapy |
5.血清CA19-9水平下降程度与转移、生存的关系:进一步分析放疗后4~6周血清CA19-9水平与放疗前基线值相比的下降程度,7例血清基线CA19-9异常者放疗后恢复正常,38例放疗后4~6周CA19-9水平较治疗前下降,下降程度51.90%(9.50%~91.8%),分析下降程度与疾病进展及生存之间的关系。分别以6个月内进展、1年生存、2年生存作为检验终点,放疗后4~6周血清CA19-9下降程度(%)为检测变量,绘制ROC曲线,当选取以6个月内进展为检验终点时,曲线下面积0.868(图 5),说明准确度较好,确定下降程度最佳截断值为60.9%。
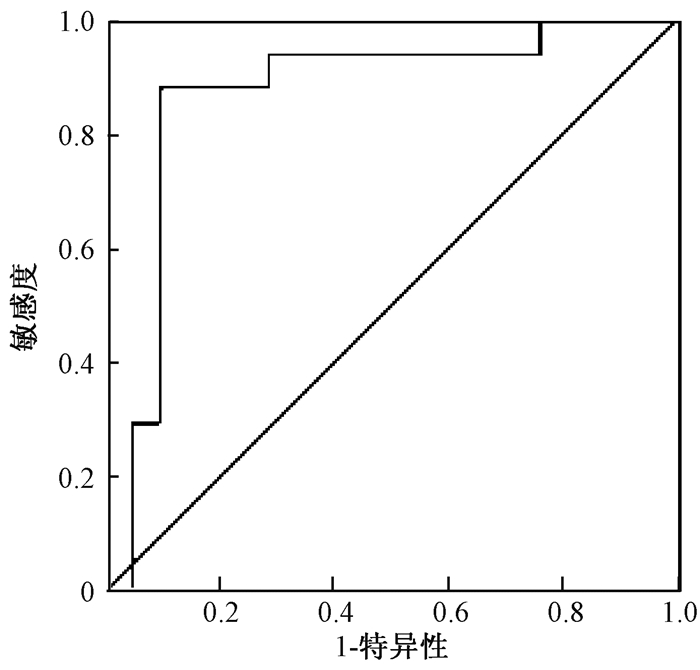
|
图 5 治疗后4~6周CA19-9下降程度与TTP关系的ROC曲线图 Figure 5 The ROC curve for decline of CA19-9 4-6 weeks after tomotherapy with TTP |
进一步分析结果显示:下降≥60.9%与<60.9%组MST分别为33.5个月(95% CI: 0.24~66.76个月)和9.0个月(95% CI: 6.92~11.08个月),差异有统计学意义(χ2=13.80,P<0.05,图 6),下降≥60.9%与<60.9%组中位PFS分别为11.0个月(95% CI: 3.44~18.56个月)和5.0个月(95% CI: 3.91~6.09个月),差异有统计学意义(χ2=8.71,P<0.05,图 7)。
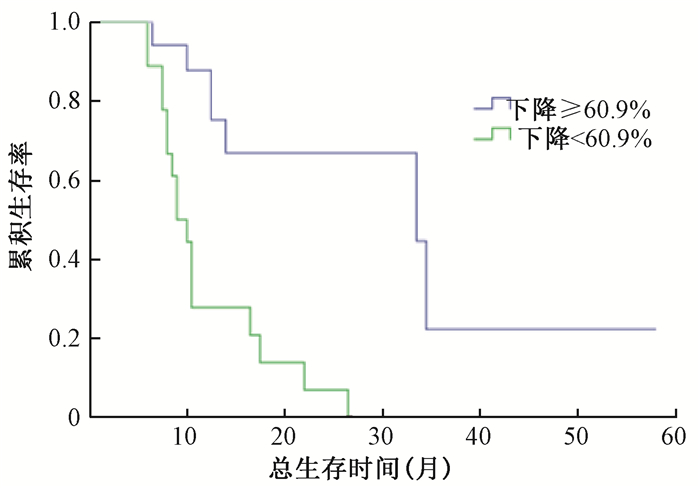
|
图 6 血清CA19-9下降≥60.9%组和<60.9%组生存曲线 Figure 6 Comparison of OS curves of the serum CA19-9 declined by ≥60.9% and < 60.9% 4-6 weeks after tomotherapy |
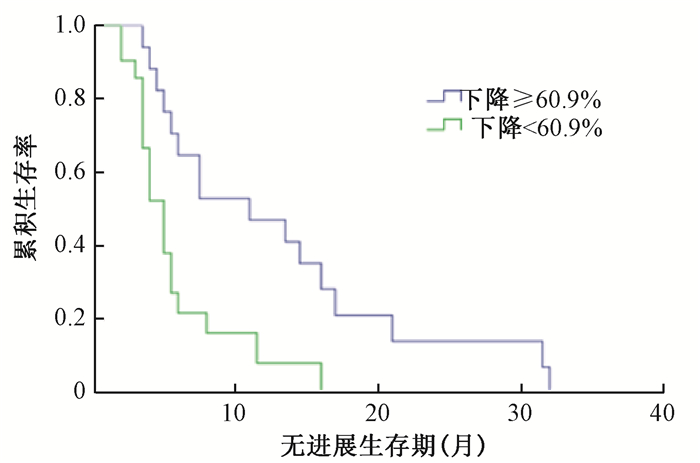
|
图 7 4~6周血清CA19-9下降≥60.9%组和<60.9%组PFS曲线 Figure 7 Comparison of PFS curves of the serum CA19-9 declined by ≥60.9% and < 60.9% 4-6 weeks after tomotherapy |
讨论
胰腺癌是恶性程度最高的消化系统肿瘤,相关研究表明具备手术条件的患者即使行手术切除,MST仅有18.4个月[5]。Moningi等[8]研究发现晚期胰腺癌和交界可切除胰腺癌患者接受放化疗的MST可达18.4和14.4个月,3级以上不良反应仅3.4%。Chang等[7]对39例LAPC患者采用TOMO放疗同步每周1次吉西他滨1 000 mg/m2,中位放疗剂量达58.4 Gy(50.8~59.9 Gy),MST及PFS分别为21.2和14.0个月,本研究入组患者疗效与上述研究相近。
CA19-9是一种酸性糖蛋白,自1979年开始应用于胰腺癌诊断[8]。血清CA19-9水平变化远早于影像学改变及临床症状产生,在胰腺癌确诊前2年、1年血清CA19-9>37 U/ml(正常值:0~37 U/ml)患者的比例达53%和68%,血清CA19-9可较早检测临床潜伏期胰腺癌[9]。胆道梗阻因胆道细胞排列极性改变造成血清CA19-9水平异常[10]。本研究入组75例患者中13例有胆道梗阻症状,均先行减黄治疗,待黄疸消除后再行测定血清CA19-9水平。相关研究表明,血清CA19-9水平是Ⅲ、Ⅳ期胰腺癌患者独立的预后因素(HR=0.68,P<0.001)[11]。Liu等[12]研究发现,血清CA19-9≥1 000 U/ml的患者因术后极易发生早期远处转移,接受手术治疗难以获益。以上研究表明,血清CA19-9水平对胰腺癌检测敏感性高、时效性早,基线水平高低是患者预后重要因素。
一项入组454名Ⅳ期胰腺癌患者行化疗的多中心临床研究发现,化疗后8周血清CA19-9水平下降可评估早期疗效,血清CA19-9下降患者(占80%),较血清CA19-9无下降患者(占20%)MST延长(11.1个月vs. 8.0个月,P<0.01)。在吉西他滨联用纳米紫杉醇化疗组中,血清CA19-9下降患者较无下降患者MST延长(13.2个月vs. 8.3个月,P=0.001)[13]。在本研究中,基线血清CA19-9正常患者放疗前与放疗后4~6周血清CA19-9水平差异无统计学意义,未纳入研究。CA19-9下降患者较无下降患者MST及PFS均有所延长,研究结果表明,对于治疗前CA19-9异常胰腺癌患者,高剂量、少分次放疗后4~6周血清CA19-9水平是预测疾病进展、生存情况的有效生物指标。
Wong等[14]对75例Ⅳ期胰腺癌患者行吉西他滨化疗,研究发现血清CA19-9下降程度是Ⅳ期胰腺癌疾病进展时间TTP及OS有效的评价标准,治疗后血清CA19-9下降>75%的患者、≤75%的患者及无下降的患者MST分别为12.2、7.5及3.5个月。本研究中,血清CA19-9下降程度≥60.9%较和<60.9%组MST分别为33.5和9.0个月,差异有统计学意义(P<0.05),mPFS分别为11.0和5.0个月,组间差异有统计学意义(P<0.05)。研究结果表明,对于血清CA19-9异常患者,接受高剂量、少分次放射治疗后4~6周血清CA19-9较大幅度下降预示有较好的治疗效果,根据TOMO高剂量、少分次放疗后4~6周血清CA19-9下降程度,可早期判定疗效,血清CA19-9下降≥60.9%的胰腺癌患者,半年内发生疾病进展可能性较低,总生存时间长。而放疗后4~6周血清CA19-9下降程度<60.9%的患者,半年内发生新发转移可能性高。Dong等[15]研究发现血清CA19-9水平上升与胰腺癌患者同期肝转移有关(OR 2.72,95% CI:1.85~3.99)。在本研究中,放疗后4~6周血清CA19-9水平无下降或下降程度较小的患者,因为影像检查的滞后性,可能放疗后早期已出现影像学难以发现的小转移灶,这时全身治疗能给患者带来更多获益。
综上所述,TOMO高剂量、少分次放疗联合化疗前血清CA19-9水平对胰腺癌患者预后判断有重要的临床意义,在治疗后4~6周,血清CA19-9水平下降程度能较早预测患者短期内疾病进展及远期生存情况,放疗后4~6周血清CA19-9下降程度<60.9%,可作为患者选择进一步全身治疗的较有意义的参考。
利益冲突 本研究接受空军总医院面上课题(KZ2014037)基金资助。作者与作者家属未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 郭宇负责整理资料、采集数据、起草论文;刘晨、任刚设计研究方案;康晓黎、李平、李晶、秦青、王颖杰提供符合入组病例和随访;夏廷毅负责指导论文写作
| [1] |
Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [2] |
Tkachev SI, Medvedev SV, Znatkova YR, et al. Possibilities of stereotactic radiotherapy in the palliative treatment of patients with pancreatic cancer[J]. Vopr Onkol, 2015, 61(1): 121-124. |
| [3] |
Micke O, Bruns F, Schäfer U, et al. CA 19-9 in the therapy monitoring and follow-up of locally advanced cancer of the exocrine pancreas treated with radiochemotherapy[J]. Anticancer Res, 2003, 23(2A): 835-840. |
| [4] |
Xia T, Chang D, Wang Y, et al. Dose escalation to target volumes of helical tomotherapy for pancreatic cancer in the phase 1-2 clinical trial[J]. Int J Radiat Oncol Biol Phys, 2013, 87(2): S303. DOI:10.1016/j.ijrobp.2013.06.795 |
| [5] |
Ueno H, Kosuge T, Matsuyama Y, et al. A randomised phase Ⅲ trial comparing gemcitabine with surgery-only in patients with resected pancreatic cancer: Japanese Study Group of Adjuvant Therapy for Pancreatic Cancer[J]. Br J Cancer, 2009, 101(6): 908-915. DOI:10.1038/sj.bjc.6605256 |
| [6] |
Moningi S, Dholakia AS, Raman SP, et al. The role of stereotactic body radiation therapy for pancreatic cancer: a single-institution experience[J]. Ann Surg Oncol, 2015, 22(7): 2352-2358. DOI:10.1245/s10434-014-4274-5 |
| [7] |
Chang JS, Wang ML, Koom WS, et al. High-dose helical tomotherapy with concurrent full-dose chemotherapy for locally advanced pancreatic cancer[J]. Int J Radiat Oncol Biol Phys, 2012, 83(5): 1448-1454. DOI:10.1016/j.ijrobp.2011.10.050 |
| [8] |
Holyoke ED, Douglass HO, Goldrosen MH. Tumor markers for pancreatic cancer[J]. Semin Oncol, 1979, 6(3): 347-356. |
| [9] |
O'Brien DP, Sandanayake NS, Jenkinson C, et al. Serum CA19-9 is significantly upregulated up to 2 years before diagnosis with pancreatic cancer: implications for early disease detection[J]. Clin Cancer Res, 2015, 21(3): 622-631. DOI:10.1158/1078-0432.CCR-14-0365 |
| [10] |
Mann DV, Edwards R, Ho S, et al. Elevated tumour marker CA19-9: clinical interpretation and influence of obstructive jaundice[J]. Eur J Surg Oncol, 2000, 26(5): 474-479. DOI:10.1053/ejso.1999.0925 |
| [11] |
Luo G, Jin K, Guo M, et al. Patients with normal-range CA19-9 levels represent a distinct subgroup of pancreatic cancer patients[J]. Oncol Lett, 2017, 13(2): 881-886. DOI:10.3892/ol.2016.5501 |
| [12] |
Liu L, Xu H, Wang W, et al. A preoperative serum signature of CEA+/CA125+/CA19-9≥1000 U/mL indicates poor outcome to pancreatectomy for pancreatic cancer[J]. Int J Cancer, 2015, 136(9): 2216-2227. DOI:10.1002/ijc.29242 |
| [13] |
Chiorean EG, Von Hoff DD, Reni M, et al. CA19-9 decrease at 8 weeks as a predictor of overall survival in a randomized phase Ⅲ trial (MPACT) of weekly nab-paclitaxel plus gemcitabine versus gemcitabine alone in patients with metastatic pancreatic cancer[J]. Ann Oncol, 2016, 27(4): 654-660. DOI:10.1093/annonc/mdw006 |
| [14] |
Wong D, Ko AH, Hwang J, et al. Serum CA19-9 decline compared to radiographic response as a surrogate for clinical outcomes in patients with metastatic pancreatic cancer receiving chemotherapy[J]. Pancreas, 2008, 37(3): 269-274. DOI:10.1097/MPA.0b013e31816d8185 |
| [15] |
Dong S, Wang L, Guo YB, et al. Risk factors of liver metastasis from advanced pancreatic adenocarcinoma: a large multicenter cohort study[J]. World J Surg Oncol, 2017, 15(1): 120. DOI:10.1186/s12957-017-1175-7 |
 2018, Vol. 38
2018, Vol. 38


