二甲双胍作为2型糖尿病的一线治疗药物,在世界范围内被广泛应用。自Evans等[1]在2005年首次提出二甲双胍具有降低糖尿病患者的恶性肿瘤发病率以来,其潜在的抗肿瘤作用也逐渐引起研究者的关注。近年已有研究发现二甲双胍联合化疗、内分泌治疗时能提高肿瘤治疗的疗效,并在某些肿瘤中也发现了其潜在的放射增敏作用[2-4]。但二甲双胍能否作为乳腺癌的放射增敏剂,目前国内外的相关研究很少[5],尤其对不同雌激素受体(ER)状态的乳腺癌细胞的放射增敏作用的报道更少。而在乳腺癌患者中,ER阳性和阴性的群体,本身预后有较大区别,对射线的敏感性也存在一定的差异[6]。因此,本研究选择了MCF-7(ER阳性)和MDA-MB-231(ER阴性)两种乳腺癌细胞,以探讨不同的ER状态与二甲双胍可能引起的放射增敏效果是否有关,并对其机制进行初步探讨。
材料与方法1.细胞株、主要试剂和仪器:乳腺癌细胞株MCF-7和MDA-MB-231购于中国科学院上海细胞库。二甲双胍(美国Sigma公司),胎牛血清(杭州四季青生物工程有限公司),RPMI 1640培养基(美国GIBCO公司),PI周期检测试剂盒(南京凯基生物科技发展有限公司),Hoechst 33342及RIPA裂解液(上海碧云天生物科技有限公司),β-肌动蛋白(上海碧云天生物科技有限公司),p-AMPK (Thr172)、p-mTOR (Ser2448)兔单抗(英国Abcam公司),辣根酶标记羊抗兔IgG二抗、二氨基联苯胺(DAB)(北京中杉金桥公司),二甲基亚砜(DMSO)(美国Sigma公司)。Acumen激光扫描荧光微孔板细胞分析仪(英国TTP LabTech公司),Odyssey双色红外荧光扫描成像系统(美国LI-COR公司),Varian Clinic Ⅸ直线加速器(美国Varian公司)。
2.细胞培养:乳腺癌细胞株MCF-7和MDA-MB-231细胞常规培养于RPMI 1640培养基,用前加10%胎牛血清及100 U/ml的青霉素、100 mg/ml的链霉素;细胞均放置于37℃含5%CO2的恒温孵育箱。
3.实验分组:将对数生长期乳腺癌细胞MCF-7和MDA-MB-231分为4组:对照组、二甲双胍组、单纯照射组和二甲双胍联合照射组。
4.照射方法:采用医用直线加速器照射。6 MV X射线,吸收剂量率为300 cGy/min,源靶距(SSD)100 cm,照射野大小15 cm×15 cm。
5.MTT法测定二甲双胍对MCF-7和MDA-MB-231的细胞毒性:收集对数生长期细胞,接种于96孔板,培养约24 h贴壁后更换成含二甲双胍终浓度为2.5、5、10、20、40、80 mmol/L,对照组含0.5% DMSO的培养液,每一浓度设3个复孔,培养24 h后,每孔加入20 μl MTT(以PBS配成5 mg/ml), 37℃孵育4 h后每孔加DMSO 150 μl,振荡10 min。在酶联免疫检测仪上490 nm波长测定各孔的吸光度(A)值。以上实验重复3次。按公式:细胞生长抑制率(%)=(1-实验组A值/对照组A值)× 100%,应用GraphPad Prism 5.0软件计算药物对乳腺癌细胞(MCF-7和MDA-MB-231)的生长抑制率,并计算出二甲双胍半数抑制浓度IC50,考虑到之后的放射增敏实验,选择5 mmol/L作为后续实验浓度。
6.克隆形成实验:取指数生长期MCF-7和MDA-MB-231细胞,设单纯照射组和二甲双胍联合照射组。细胞贴壁后,分别更换不含/含5 mmol/L二甲双胍培养液继续培养24 h后,再分别给予0、2、4、6、8 Gy X射线照射。照射后根据不同照射剂量(由低到高)分别接种200~50 000细胞于6 cm培养皿中,每个剂量点设3个平行样本。随后细胞在CO2孵箱内培养12~14 d,无水乙醇固定,姬姆萨染色。计数≥50个细胞克隆,换算为细胞存活分数并绘制剂量效应曲线。实验重复3次。克隆形成率(PE)=克隆数/接种细胞数×100%,以PE作为校正系数计算存活分数(SF),SF=受照射细胞的PE/对照组细胞PE。数据分析使用GraphPad Prism 5.0软件,以多靶单击数学模型,SF=1-(1-e-D/D0)N拟合细胞存活曲线,计算出照射组和实验组的准域剂量(Dq)、平均致死剂量(D0)、2 Gy照射的存活分数(SF2)值;放射增敏效应以放射增敏比SERD0表示。
7.碘化丙啶(PI)染色法检测肿瘤细胞周期:将对数生长期MCF-7和MDA-MB-231细胞接种于96孔板,细胞贴壁后,对照组更换含0.5%DMSO培养液,二甲双胍组和二甲双胍联合照射组分别更换含5 mmol/L二甲双胍培养液培养24 h后,分别给予0、6 Gy的X射线照射,继续培养24 h后收集各组细胞。弃上清,每孔加入75%冰乙醇100 μl,4℃下固定过夜,过滤,PBS清洗2次,所有步骤按周期检测试剂盒说明书操作,每孔加入100 μl染色液(RNase 0.2 mg/ml,PI 20 μmol/L),37℃孵育1 h后,在Acumen激光扫描荧光微孔板细胞分析仪上用周期分析模版扫描,检测488 nm激发荧光信号,计算各组细胞周期时相比例。上述实验重复3次。
8. Hoechst 33342染色法检测肿瘤细胞凋亡:取对数生长期MCF-7和MDA-MB-231细胞接种于96孔板,培养24 h后,对照组及单纯照射组更换含0.5%DMSO培养液,二甲双胍组和二甲双胍联合照射组更换含5 mmol/L二甲双胍的培养液培养24 h后,分别给予0、6 Gy的X射线照射,继续培养24 h,收集各组细胞。固定,染色后使用Acumen激光扫描荧光微孔板细胞分析仪检测各组细胞凋亡率。上述实验重复3次。
9. Western blot法检测p-AMPK、p-mTOR蛋白:按上述实验分组,对照组及单纯照射组更换含0.5%DMSO培养液,二甲双胍组和二甲双胍联合照射组更换含5 mmol/L二甲双胍培养液,分别给予0、6 Gy的X射线照射,再继续培养24 h,收集细胞。离心半径8 cm, 12 000 r/min离心5 min,裂解细胞提取总蛋白,BCA法蛋白定量,取40 μg蛋白SDS-PAGE凝胶电泳,将凝胶中的蛋白转移至已用甲醇活化的PVDF膜上,封闭液封闭过夜,分别加入一抗(anti-p-AMPK抗体、anti-p-mTOR抗体、β-肌动蛋白抗体),4℃过夜孵育,洗膜后加入相应二抗,避光孵育约1 h,洗膜后使用DAB显色,最后利用Odyssey双色红外荧光扫描成像系统检测蛋白水平。
10.统计学处理:数据采用SPSS 19.0软件进行分析,计量资料符合正态分布以x±s表示,两组间比较采用独立样本t检验。克隆形成实验采用GraphPad Prism 5.0软件进行细胞生存曲线的拟合,计算生物学参数。P<0.05为差异有统计学意义。
结果1.二甲双胍对乳腺癌细胞增殖抑制的影响:结果发现不同浓度二甲双胍(0、2.5、5、10、20、40、80 mmol/L)预处理后,MCF-7和MDA-MB-231细胞增殖出现不同程度的抑制,且随药物浓度的升高,细胞的增殖率逐渐降低。MCF-7和MDA-MB-231细胞抑制率分别为(7.73±1.49)%~(83.83±3.03)%和(4.91±1.82)%~(78.06±2.72)%,与对照组相比,差异均有统计学意义(t=8.985~92.543,P < 0.05;t=4.672~49.698,P < 0.05)。MCF-7和MDA-MB-231细胞用二甲双胍作用24 h后的IC50分别是22.58和26.79 mmol/L。根据文献[7],为避免或尽量减少药物本身的细胞毒作用,宜采用20%IC50作为放射增敏的实验浓度。因此,本研究选择低浓度二甲双胍(5 mmol/L)进行后续增敏实验。
2.二甲双胍对乳腺癌细胞放射敏感性的影响:单纯照射组和二甲双胍联合照射组克隆形成后,计算细胞存活分数并拟合细胞存活曲线(图 1),二甲双胍联合照射组Dq、D0、SF2明显低于单纯照射组(t=9.305、19.560、14.528、16.893、13.708、36.048,P < 0.05,表 1)。MCF-7细胞在二甲双胍浓度5 mmol/L时的放射增敏比为1.29,MDA-MB-231细胞为1.21。
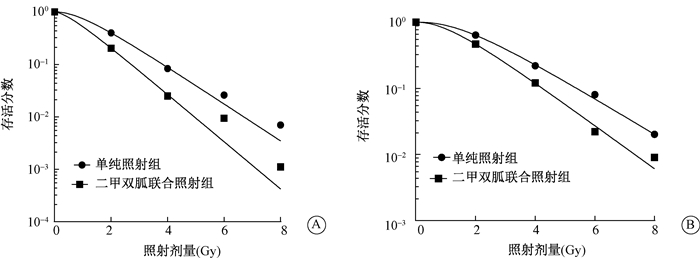
|
图 1 克隆形成实验检测二甲双胍对乳腺癌细胞放射敏感性的影响A. MCF-7;B. MDA-MB-231 Figure 1 The radiosensitizing effect of metformin evaluated by clonogenic survival assay on breast carcinoma cell lines A. MCF-7; B. MDA-MB-231 |
|
|
表 1 多靶单击模型拟合MCF-7和MDA-MB-231细胞存活曲线相关生物学参数(x±s) Table 1 The biological parameters of the survival curves of MCF-7 and MDA-MB-231 cells fitted by the multi-target model(x±s) |
3.二甲双胍联合X射线照射对细胞周期的影响:结果列于表 2。二甲双胍可以诱导MCF-7和MDA-MB-231细胞周期发生改变,G0/G1期细胞比例增多(t=116.047、8.583,P < 0.05),S期比例减少(t=5.105、10.857,P < 0.05),G2/M期变化不明显(P>0.05)。而在单纯照射组及二甲双胍联合照射组中,这两种细胞均出现了明显的G2/M期细胞比例增加(MCF-7:t=24.496、28.964,P < 0.05;MDA-MB-231:t=12.586、17.117,P < 0.05),S期细胞比例减少(MCF-7:t=70.703、34.391,P < 0.05;MDA-MB-231:t=15.429、21.254,P < 0.05),且两者联合作用更为显著,与二甲双胍组或单纯照射组相比,差异均有统计学意义(t=6.103~38.431,P < 0.05)。
|
|
表 2 二甲双胍联合X射线照射对细胞周期分布的影响(%, x±s) Table 2 The effects of metformin combined with X-ray irradiation on the cells cycle distribution(%, x±s) |
4.二甲双胍联合X射线照射对细胞凋亡率的影响:结果列于表 3。与对照组相比,二甲双胍组、单纯照射组与二甲双胍联合照射组都可诱导这两种乳腺癌细胞凋亡(t=4.683~31.248,P < 0.05),二甲双胍联合照射组比二甲双胍组和单纯照射组作用更显著,差异均有统计学意义(MCF-7:t=33.040、9.143,P < 0.05;MDA-MB-231:t=59.322、14.561,P < 0.05)。
|
|
表 3 二甲双胍联合X射线照射对细胞凋亡率的影响(%, x±s) Table 3 The effects of metformin combined with X-ray irradiation on cell apoptosis induction(%, x±s) |
5.免疫印迹法检测二甲双胍联合X射线照射对p-AMPK、p-mTOR蛋白的影响:结果列于表 4,图 2。以β-肌动蛋白表达作为内参,将对照组蛋白表达条带强度与相应β-肌动蛋白表达条带强度的比值作为基准值1。在MCF-7细胞中,二甲双胍组和单纯照射组中均可见到p-AMPK蛋白表达较对照组有增多,且两者的联合作用更显著(t=8.647、10.316,P < 0.05);p-mTOR的表达水平则出现不同程度的降低,且二甲双胍联合照射组中下降更明显(t=31.820、11.308,P < 0.05)。而在MDA-MB-231细胞中,无论是二甲双胍组、单纯照射组还是二甲双胍联合照射组均未观察到p-AMPK的变化,与对照组相比,差异无统计学意义(P>0.05)。但p-mTOR表达水平同样出现了降低的现象,且二甲双胍联合照射组下降更显著(t=15.757、8.402,P < 0.05)。

|
图 2 Western blot检测二甲双胍联合X射线照射MCF-7、MDA-MB-231细胞后p-AMPK、p-mTOR表达A. MCF-7;B. MDA-MB-231 注:1.对照组;2.二甲双胍组;3.单纯照射组;4.二甲双胍联合照射组 Figure 2 Western blot assay of p-AMPK and p-mTOR protein expressions in MCF-7 and MDA-MB-231 cells after metformin combined with X-ray irradiation A. MCF-7;B. MDA-MB-231 |
|
|
表 4 二甲双胍联合X射线照射对MCF-7、MDA-MB-231细胞信号蛋白表达的影响(x±s) Table 4 The effects of metformin combined with X-ray irradiation on the protein expersions in MCF-7 and MDA-MB-231 cells(x±s) |
讨论
放射治疗作为乳腺癌重要的局部和区域治疗手段,其有效性已被公认。但由于肿瘤中存在对射线抗拒的细胞,放疗后仍有一部分患者会出现肿瘤复发、转移。而且乳腺癌中不同的ER状态往往表现出不同的生物学行为,从而对同一治疗产生不同的影响。在一些实验研究中也发现ER阴性较ER阳性的乳腺癌细胞对X射线存在相对抗拒性,如MDB-MA-231细胞中miR-21的表达量明显高于MCF-7细胞,而miR-21的表达量已被证实与乳腺癌细胞的辐射抗性呈正相关[8]。因此,寻找一种高效低毒的放射增敏剂,进一步提高不同类别乳腺癌患者对放疗的敏感性成为亟待解决的难题之一。
近年来,降糖药物二甲双胍在肿瘤治疗方面的前景正被不断挖掘。尽管目前有关二甲双胍放射增敏的实验研究开展的尚少,但二甲双胍具有经济、不良反应小、对正常血糖无影响等优点,因此利用这些特性进一步研究二甲双胍能否成为一种放射增敏剂来提高肿瘤治疗的疗效是值得关注的。
已有研究显示,二甲双胍可以抑制诸如胰腺癌[9]、前列腺癌[10]和结肠癌[11]等多种肿瘤细胞的增殖,并且这些研究均显示二甲双胍与X射线照射联用时会出现明显的抗肿瘤协同效应。同样,本研究MTT检测结果显示二甲双胍对乳腺癌MCF-7和MDA-MB-231两种细胞均有抑制增长的作用,且随着二甲双胍浓度的增加,其对细胞的增殖抑制也逐渐增加。在随后的克隆形成实验中与单纯照射组相比,二甲双胍联合照射组的细胞克隆数目明显减少,MCF-7和MDA-MB-231这两种细胞的放射增敏比SERD0分别为1.29和1.21,这提示二甲双胍对体外培养的乳腺癌细胞(MCF-7和MDA-MB-231)具有一定的放射增敏效应。
克隆形成实验一直被认为是评价细胞放射敏感性的经典方法。本研究结果表明,在乳腺癌细胞(MCF-7和MDA-MB-231)中二甲双胍联合照射组的细胞存活曲线较单纯照射组左移;且联合组的准域剂量(Dq)、平均致死剂量(D0)、2 Gy照射的存活分数(SF2)较单纯照射组在这两种细胞中均出现不同程度的降低。Dq值减少,说明“肩区”缩小变窄,提示二甲双胍削弱了细胞受照射后亚致死损伤的修复能力;D0和SF2降低,说明细胞放射抗拒性降低;由此可见,经二甲双胍预处理后,MCF-7和MDA-MB-231细胞的放射敏感性增加了。
放射生物学研究表明,肿瘤细胞对射线的敏感性与细胞周期密切相关,最敏感的是M期、G2期,G1期相对敏感,S期细胞最抗拒。在本研究中,发现单独使用二甲双胍可以诱导乳腺癌细胞(MCF-7和MDA-MB-231)出现G0/G1期阻滞。而无论是单独照射还是二甲双胍联合照射则均可引起这两种乳腺癌细胞产生G2/M期阻滞,且两者的联合作用更显著。这提示二甲双胍联合X射线照射后,使进入放射最敏感的G2/M期细胞比例增加,而对放射抗拒的S期细胞比例减少,从而进一步增强放疗诱导的毒效应,这也应该是二甲双胍提高乳腺癌细胞放射敏感性的途径之一。与此结果较为一致的,Liu等[12]研究报道指出,二甲双胍联合照射,明显增加了肝癌细胞G2/M期阻滞。
细胞凋亡也是放射增敏的潜在机制之一。Dumont和Bischoff[13]研究发现雷帕霉素联合照射是通过激活凋亡信号通路,从而增强照射诱导某些肿瘤细胞凋亡。Li等[14]研究报道,二甲双胍可通过影响HR修复和NHEJ修复信号通路,降低DNA损伤修复能力,从而促进细胞凋亡,提高对鼻咽癌细胞的放射敏感性。在本研究的两种乳腺癌细胞中,也观察到二甲双胍联合照射组的细胞凋亡率较单纯照射组或单独使用二甲双胍组显著增加,表明二甲双胍可能通过促进细胞凋亡而增强乳腺癌细胞MCF-7和MDA-MB-231的放射敏感性。
腺苷酸活化蛋白激酶(AMPK)是细胞内重要的“能量感受器”,目前较为认可的二甲双胍的降糖机制就是通过激活AMPK通路实现的[15]。因此,某种意义上来说二甲双胍还是一种AMPK激活剂。而照射激活AMPK在肿瘤细胞中也是一个普遍存在的现象,且磷酸化AMPK的水平与照射剂量和照射后的时间呈依赖关系[16]。近年研究还发现射线联合使用药物激活AMPK可增加肿瘤细胞放射毒效应。Storozhuk等[17]发现联合使用二甲双胍,可通过激活ATM-AMPK-p21(waf/cip)信号通路降低肿瘤细胞的克隆形成率,起到放射增敏作用,并在肺癌细胞系体外培养及动物模型中验证了这一结果。相反地,使用Compound C抑制或特异性siRNA沉默AMPK后,发现肿瘤细胞对射线的敏感性明显下降,照射后细胞存活上升,这更加佐证了AMPK在调节细胞放射敏感性方面的重要作用[16]。本研究中,对乳腺癌细胞(MCF-7和MDA-MB-231)进行体外培养后,使用二甲双胍联合X射线照射,结果在MCF-7细胞中见到p-AMPK蛋白表达明显增多,且明显高于单用二甲双胍或单纯照射。但有趣的是这种现象并未在MDA-MB-231细胞中出现。已有文献报道,具有高度侵袭性特征的MDA-MB-231细胞株表现出的不良预后特征往往与肝脏激酶(LKB1)的表达缺失呈显著关联性[18]。LKB1是一种突变的抑癌基因的蛋白产物,作为AMPK的上游激酶,在介导AMPK活化途径中起着重要作用,肿瘤细胞中LKB1的缺失或低表达可使二甲双胍对AMPK的激活难以实现[19-20]。本研究结合以上结果,说明二甲双胍对ER阴性乳腺癌MDA-MB-231细胞的放射增敏可能是通过不依赖于AMPK的其他途径实现的,具体的机制还有待于进一步实验明确。
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是人类肿瘤中最常见的信号通路PI3K/AKT主要的介导因子,在细胞生长、增殖及细胞周期的调控中起着重要作用。研究表明,PI3K/AKT信号通路的表达失调往往与多种肿瘤的放射抗拒相关[21],而阻断AKT/mTOR信号通路可通过改变细胞周期、修复DNA损伤等多种途径提高肿瘤放射敏感性[22]。近年来随着对AMPK信号通路研究的深入,发现AMPK与mTOR通路相关联。AMPK激活后,可直接磷酸化TSC2苏氨酸的1 345位点,使TSC2活化,最后抑制mTORC1活性;AMPK也可通过AKT依赖途径抑制mTOR及其下游靶蛋白,从而引起细胞周期关键蛋白合成不足,最终导致细胞凋亡[23]。因此,AMPK可以说是mTOR通路的负向调控因子。Chen等[24]研究报道PARP-1抑制剂可通过激活AMPK,抑制mTOR信号级联通路,以增强射线对肿瘤细胞的毒性。在本实验的MCF-7乳腺癌细胞株中也看到了相似结果,照射时用二甲双胍预先处理比单独使用它们再激活AMPK,进而抑制mTOR活性的效果也更显著。虽然本研究在乳腺癌MDA-MB-231细胞中,未见到AMPK的激活,但通过免疫印迹法检测结果仍可看到二甲双胍联合照射后p-mTOR蛋白水平的降低,且相比二甲双胍组或单纯照射组,这些蛋白的表达水平也下降更明显,说明二甲双胍通过阻断mTOR信号通路,同样有效地增强了辐射介导的细胞凋亡。可见,二甲双胍这种不依赖于ER表达状态的放射增敏效应可能是源于下调了mTOR的表达,但在ER阴性乳腺癌细胞(MDA-MB-231)中,具体是通过哪种途径抑制mTOR活性的,尚不清楚。另一项研究报道,阻断胰岛素样生长因子-1受体(IGF-1R)路径可增强乳腺癌细胞的放射敏感性[25]。而IGF-1R已被证实在ER阳性和阴性的乳腺癌(MCF-7和MDA-MB-231)细胞中均有表达[26],且IGF-1R可通过与其配基结合激活PI3K,进一步磷酸化AKT而激活mTOR途径。以上结合二甲双胍的抗肿瘤作用也可能与胰岛素/IGF-1信号通路有关的研究[27],也就部分解释了二甲双胍与射线联合后对抑制mTOR活性在两种不同ER状态乳腺癌细胞中均有协同作用,但这还需在进一步的实验中加以研究和验证。
综上所述,以上研究结果表明,二甲双胍具有增强不同ER状态乳腺癌细胞(MCF-7和MDA-MB-231)放射敏感性的作用。其增敏机制可能与以下有关:经二甲双胍干预后,通过调节细胞周期分布,引起放射最敏感的G2/M期的细胞比例增高;在MCF-7细胞中可能通过活化AMPK通路,进一步负反馈mTOR信号通路、促进细胞凋亡,最终增强乳腺癌的放射敏感性;而在MDA-MB-231细胞中,二甲双胍则可能通过非AMPK依赖的途径来抑制mTOR信号蛋白,从而起到放射增敏作用,但其中具体通过哪种途径抑制mTOR的活性,尚不清楚,还有待进一步实验研究。
可见,二甲双胍有希望成为一种安全有效的放射增敏剂应用于临床,为不同类别乳腺癌的治疗策略和方案提供新的思路和指引,但考虑到体外实验结果的局限性,并且二甲双胍在体内可能存在更为复杂的生物学效应和作用机制,因此其进一步的应用前景也有待更多的动物体内实验加以验证和支持。
利益冲突 本研究接受上海市黄浦区科技项目(HKW201507)资助,所有作者无利益冲突,未因进行该项研究而接受任何不正当的职务或经费利益,在此对研究的独立性和科学性予以保证作者贡献声明 孙丽云负责研究设计、实验操作及论文撰写;陈刚负责课题指导;张顺康、王鑫参与数据处理;卢月参与论文修改
| [1] |
Evans JMM, Donnelly LA, Emslie-Smith AM, et al. Metformin and reduced risk of cancer in diabetic patients[J]. BMJ, 2005, 330: 1304-1305. DOI:10.1136/bmj.38415.708634.F7 |
| [2] |
Chang J, Jung HH, Yang JY, et al. Protective effect of metformin against cisplatin-induced ototoxicity in an auditory cell line[J]. J Assoc Res Otolaryngol, 2014, 15(2): 149-158. DOI:10.1007/s10162-013-0431-y |
| [3] |
Ma J, Guo Y, Chen S, et al. Metformin enhances tamoxifen-mediated tumor growth inhibition in ER-positive breast carcinoma[J]. BMC Cancer, 2014, 14: 172. DOI:10.1186/1471-2407-14-172 |
| [4] |
Skinner HD, McCurdy MR, Echeverria AE, et al. Metformin use and improved response to therapy in esophageal adenocarcinoma[J]. Acta Oncol, 2013, 52(5): 1002-1009. DOI:10.3109/0284186X.2012.718096 |
| [5] |
Ferro A, Goyal S, Kim S, et al. Evaluation of diabetic patients with breast cancer treated with metformin during adjuvant radiotherapy[J]. Int J Breast Cancer, 2013, 2013: 659723. DOI:10.1155/2013/659723 |
| [6] |
van Duursen MB, Smeets EE, Rijk JC, et al. Phytoestrogens in menopausal supplements induce ER-dependent cell proliferation and overcome breast cancer treatment in an in vitro breast cancer model[J]. Toxicol Appl Pharmacol, 2013, 269(2): 132-140. DOI:10.1016/j.taap.2013.03.014 |
| [7] |
姚建新, 姚志峰, 刘永彪. 西妥昔单抗对乳腺癌MDA-MB-231细胞放射敏感性影响的研究[J]. 中华肿瘤防治杂志, 2013, 20(12): 898-903. Yao JX, Yao ZF, Liu YB. Radiation enhancement of cetuximab on hunman breast adenoma MDA-MB-231 cells line[J]. Chin J Cancer Prev Treat, 2013, 20(12): 898-903. DOI:10.16073/j.cnki.cjcpt.2013.12.006 |
| [8] |
狄英波, 薛茗方, 刘雅娟, 等. miR-21在辐射敏感性不同的3种乳腺癌细胞株中的表达差异及意义[J]. 中国妇幼保健, 2013, 28(9): 1499-1501. Di YB, Xue MF, Liu YJ, et al. Differences and significances of miR-21 expressions in three kinds of breast cancer cell strains of different radiative sensitivities[J]. Matern Child Health Care China, 2013, 28(9): 1499-1501. DOI:10.7620/zgfybj.j.issn.1001-4411.2013.28.43 |
| [9] |
Wang Z, Lai ST, Ma NY, et al. Radiosensitization of metformin in pancreatic cancer cells via abrogating the G2 checkpoint and inhibiting DNA damage repair[J]. Cancer Lett, 2015, 369(1): 192-201. DOI:10.1016/j.canlet.2015.08.015 |
| [10] |
Zhang T, Zhang L, Zhang T, et al. Metformin sensitizes prostate cancer cells to radiation through EGFR/p-DNA-PKCS in vitro and in vivo[J]. Radiat Res, 2014, 181(6): 641-649. DOI:10.1667/RR13561.1 |
| [11] |
Oh BY, Park YA, Huh JW, et al. Metformin enhances the response to radiotherapy in diabetic patients with rectal cancer[J]. J Cancer Res Clin Oncol, 2016, 142(6): 1377-1385. DOI:10.1007/s00432-016-2148-x |
| [12] |
Liu J, Hou M, Yuan T, et al. Enhanced cytotoxic effect of low doses of metformin combined with ionizing radiation on hepatoma cells via ATP deprivation and inhibition of DNA repair[J]. Oncol Rep, 2012, 28(4): 1406-1412. DOI:10.3892/or.2012.1932 |
| [13] |
Dumont FJ, Bischoff P. Disrupting the mTOR signaling network as a potential strategy for the enhancement of cancer radiotherapy[J]. Curr Cancer Drug Targets, 2012, 12(8): 899-924. DOI:10.2174/156800912803251243 |
| [14] |
Li H, Chen X, Yu Y, et al. Metformin inhibits the growth of nasopharyngeal carcinoma cells and sensitizes the cells to radiation via inhibition of the DNA damage repair pathway[J]. Oncol Rep, 2014, 32(6): 2596-2604. DOI:10.3892/or.2014.3485 |
| [15] |
Towler MC, Hardie DG. AMP-activated protein kinase in metabolic control and insulin signaling[J]. Circ Res, 2007, 100(3): 328-341. DOI:10.1161/01.RES.0000256090.42690.05 |
| [16] |
Sanli T, Storozhuk Y, Linher-Melville K, et al. Ionizing radiation regulates the expression of AMP-activated protein kinase (AMPK) in epithelial cancer cells: modulation of cellular signals regulating cell cycle and survival[J]. Radiother Oncol, 2012, 102(3): 459-465. DOI:10.1016/j.radonc.2011.11.014 |
| [17] |
Storozhuk Y, Sanli T, Hopmans SN, et al. Chronic modulation of AMP-Kinase, Akt and mTOR pathways by ionizing radiation in human lung cancer xenografts[J]. Radiat Oncol, 2012, 7: 71. DOI:10.1186/1748-717X-7-71 |
| [18] |
Rhodes LV, Tate CR, Hoang VT, et al. Regulation of triple-negative breast cancer cell metastasis by the tumor-suppressor liver kinase B1[J]. Oncogenesis, 2015, 4: e168. DOI:10.1038/oncsis.2015.27 |
| [19] |
Memmott RM, Dennis PA. LKB1 and mammalian target of rapamycin as predictive factors for the anticancer efficacy of metformin[J]. J Clin Oncol, 2009, 27(34): e226. DOI:10.1200/JCO.2009.25.3963 |
| [20] |
Dowling RJ, Goodwin PJ, Stambolic V. Understanding the benefit of metformin use in cancer treatment[J]. BMC Med, 2011, 9: 33. DOI:10.1186/1741-7015-9-33 |
| [21] |
Tan DS, Miller RE, Kaye SB. New perspectives on molecular targeted therapy in ovarian clear cell carcinoma[J]. Br J Cancer, 2013, 108(8): 1553-1559. DOI:10.1038/bjc.2013.126 |
| [22] |
Burris HA. Overcoming acquired resistance to anticancer therapy: focus on the PI3K/AKT/mTOR pathway[J]. Cancer Chemother Pharmacol, 2013, 71(4): 829-842. DOI:10.1007/s00280-012-2043-3 |
| [23] |
Lee YK, Park SY, Kim YM, et al. Suppression of mTOR via Akt-dependent and-independent mechanisms in selenium-treated colon cancer cells: involvement of AMPKalpha1[J]. Carcinogenesis, 2010, 31(6): 1092-1099. DOI:10.1093/carcin/bgq040 |
| [24] |
Chen ZT, Zhao W, Qu S, et al. PARP-1 promotes autophagy via the AMPK/mTOR pathway in CNE-2 human nasopharyngeal carcinoma cells following ionizing radiation, while inhibition of autophagy contributes to the radiation sensitization of CNE-2 cells[J]. Mol Med Rep, 2015, 12(2): 1868-1876. DOI:10.3892/mmr.2015.3604 |
| [25] |
李萍, 章青, 李兆斌, 等. 阻断胰岛素样生长因子-1受体信号传导路径对人乳腺癌细胞放射增敏作用机制研究[J]. 中华放射肿瘤学杂志, 2012, 21(1): 11-12. Li P, Zhang Q, Li ZB, et al. Study on the mechanism of radiosensitization of human breast cancer cells by blocking insulin-like growth factor-1 receptor signaling pathway[J]. Chin J Radiat Oncol, 2012, 21(1): 11-12. DOI:10.3760/cma.j.issn.1004-4221.2012.01.004 |
| [26] |
Matà R, Palladino C, Nicolosi ML, et al. IGF-I induces upregulation of DDR1 collagen receptor in breast cancer cells by suppressing MIR-199a-5p through the PI3K/AKT pathway[J]. Oncotarget, 2016, 7(7): 7683-7700. DOI:10.18632/oncotarget.6524 |
| [27] |
Sarfstein R, Friedman Y, Attias-Geva Z, et al. Metformin downregulates the insulin/IGF-I signaling pathway and inhibits different uterine serous carcinoma (USC) cells proliferation and migration in p53-dependent or-independent manners[J]. PLoS One, 2013, 8(4): e61537. DOI:10.1371/journal.pone.0061537 |
 2018, Vol. 38
2018, Vol. 38


