原发性肝细胞癌(hepatocellular carcinoma, HCC)是最常见的恶性肿瘤之一,病死率在恶性肿瘤中居第3位[1],且其死亡率和发病率逐年上升。由于HCC发病隐蔽,导致很多患者就诊时病灶多发、靠近重要器官和血管,从而失去了最佳手术时机[2]。随着放疗技术的进步,放疗已成为不可切除肝癌患者的重要治疗选择之一[3]。HCC患者的放射治疗常采用多次分割照射,单次剂量为1.8~2.0 Gy,累积剂量范围为40~70 Gy,或者局部单次大剂量照射,剂量范围多为6~15 Gy[3]。但是,放疗会导致肝细胞癌局部复发扩散或者向远处器官转移,因此,确定放疗促进肝癌细胞转移的因素对于改善HCC患者的治疗至关重要。长期以来,大多数研究的关注点为放疗后不久的肿瘤细胞迁移和侵袭的变化,很少有研究关注辐射暴露后残留肿瘤细胞变化的长期效应,特别是其机制仍然模糊不清。本研究将通过体内体外实验探讨HepG2细胞在分割照射后残留肝癌细胞长期侵袭迁移能力的变化,并探讨上皮细胞间充质转化(EMT)在残留肝癌细胞长期侵袭迁移能力变化中的作用。
材料与方法1.实验材料: HepG2人源肝癌细胞购自于中国科学院上海细胞库;雄性BALB/c裸鼠(4~5周龄,体重16~18 g)购自上海斯莱克实验动物有限责任公司,合格证号:2015000523979,使用许可证号:SYXK(沪)2014-0029,饲养于复旦大学实验动物科学部SPF级动物房,适应实验室培养环境7 d后开始实验。辐照源采用美国PXi公司的X-RAD 320射线装置,X射线经2 mm铝滤片过滤后的能量为300 kV,吸收剂量率为1.9 Gy/min。
2.细胞培养及分组:HepG2细胞培养于含10%胎牛血清(FBS)、100 U/ml青霉素和100 mg/L链霉素的DMEM培养液,所有细胞均在37℃、5% CO2的饱和湿度下进行培养。利用对数生长期细胞进行实验,并分为辐照组和对照组。辐照组:利用X射线对HepG2细胞进行分割照射,每周一、三、五进行辐照,每两次照射间隔1 d,期间对细胞进行消化并重新接种后再次完全贴壁,每次照射剂量为2 Gy,累积辐照剂量达到20 Gy后继续培养30 d,所获得的细胞为辐射残留细胞;对照组:与辐照组同等条件培养的未照射细胞。
3.CCK-8法检测细胞增殖:取对数生长期的HepG2细胞,消化为浓度为4×104/ml的细胞悬液,接种于96孔板内,每孔100 μl,每个样本设置5个平行,以新鲜培养基作为空白组。细胞培养96 h后终止,每孔加入10 μl CCK-8试剂,十字摇匀,放入培养箱内继续孵育1~2 h,以酶标仪检测450 nm波长下的吸光度(A值)。每组实验均重复3次。细胞增殖率(%)=100%×(实验组A值-空白组A值)/(对照组A值-空白组A值)。
4.体外迁移实验:细胞迁移实验利用含Transwell小室的24孔板(美国康宁公司)进行,Transwell小室底部PET膜含有众多8 μm微孔。取对数生长期HepG2细胞,消化为浓度为1×106/ml的细胞悬液,在上室加入500 μl细胞悬液,下室中加入850 μl含10% FBS的DMEM培养液,将Transwell板置于37℃,5%CO2饱和湿度培养箱中孵育26 h。终止孵育后将小室使用PBS清洗3遍,使用棉签轻轻擦去上层细胞,将800 μl 4%多聚甲醛加入下室中,室温固定细胞10 min,PBS清洗3次,0.1%结晶紫染色10 min,晾干后,在200倍镜下随机选取5个视野拍照,计数取平均值。
5.体外侵袭实验:细胞侵袭实验同样利用Transwell小室进行,但实验前向Transwell小室中加入100 μl稀预冷Matrigel胶,在37℃的培养箱中孵育2 h后加入细胞,之后采用与体外迁移实验相同的步骤使细胞穿膜,拍照,计数。
6.裸鼠尾静脉模型和皮下移植瘤模型的建立及处理
(1) 裸鼠尾静脉模型:取对数生长期的HepG2细胞消化,将细胞浓度调整至5×107/ml,取0.1 ml细胞悬液接种到裸鼠尾静脉中,每组5只,每日观察裸鼠状态,在尾静脉注射后42 d发现组内有裸鼠状态接近自然死亡时对裸鼠进行解剖,观察肿瘤肝转移情况,并对肝脏切片进行HE染色,统计肝转移灶数目。
(2) 皮下移植瘤模型:将HepG2细胞浓度调至1×107/ml,取0.1 ml细胞悬液接种到裸鼠右侧腹股沟皮下。在细胞接种12 d后裸鼠肿瘤体积达100 mm3,达到本次实验照射要求。
(3) 分组及处理:将带有移植瘤的裸鼠按随机数表法分为辐照组和对照组。辐照组:将小鼠固定以使肿瘤区域暴露,而身体的其余部分由铅板屏蔽。模拟临床肿瘤分割照射方式,每周一至周五进行辐照,每次2 Gy,局部照射肿瘤2周,累积剂量20 Gy。对照组:与辐照组同等条件下培养的带有移植瘤裸鼠。每3天测量1次肿瘤长宽高,计算肿瘤体积,肿瘤体积(mm3)=π/6×长×宽×高。在细胞注射后第39天时,发现裸鼠组内最大肿瘤体积达600 mm3,并且组内有裸鼠状态接近自然死亡前状态,判断此时裸鼠达到处死条件,处死裸鼠并收集肿瘤及肝脏用于进一步实验。
7.蛋白质印迹分析:分别提取全细胞蛋白质和肿瘤组织蛋白,测定蛋白浓度。使用等量蛋白经10%聚丙烯酰胺凝胶电泳,转膜,封闭2 h。封闭结束后,一抗4℃孵育过夜:所用的一抗是兔抗人N-cadherin抗体(1:1 000,美国CST公司),兔抗人Snail抗体(1:1 000,美国CST公司)。一抗孵育结束后,用TBST清洗PVDF膜3次,每次10 min。二抗孵育室温孵育1.5 h,结束后,TBST清洗3遍,每次10 min。将Millipore ECL Plus A液和B液按1:1混匀配成发光液,在化学发光成像仪中发光,并利用ChemiDoc XRS型化学发光成像系统进行显影成像,所采集图像使用Quantity One软件来分析目标条带净光密度值,并以各自内参蛋白tubulin为内参对照,计算各目标条带的相对光密度值。
8.组织病理学检测:取所有裸鼠0.5 cm×0.5 cm×0.1 cm大小的肝脏和肿瘤组织,用4%中性多聚甲醛固定,24 h后石蜡包埋,切片。对所有肝脏组织切片并进行HE染色封片。并使用免疫组织化学发光法对肿瘤组织进行免疫组织化学分析。一抗为兔抗人N-cadherin抗体(1:100,美国CST公司),石蜡切片脱蜡至水,抗原修复,山羊血清封闭,加一抗、二抗,DAB显色液显色,苏木素染核后封片,于显微镜下观察并采集图像。
9.统计学处理:实验数据符合正态分布,以x±s表示,采用Origin 8.0软件进行统计和作图,不同处理组数据采用Student′s t检验进行分析。P < 0.05为差异有统计学意义。
结果1.分割照射后残留HepG2细胞增殖及侵袭迁移能力变化:辐照组残留的HepG2细胞相对增殖能力(0.855±0.037)低于对照组细胞(1.000±0.024)(t=5.686, P < 0.05)。然而,残留HepG2细胞的迁移和侵袭能力显著增强(图 1),在体外迁移和侵袭实验中,平均每个视野辐照组发生迁移的细胞数量为(88.4±12.34)/视野,多于对照组的(40.4±6.43)/视野,辐照组发生侵袭的细胞数为(30.6±4.34)/视野,多于对照组(18.8±2.77)/视野(t=7.714、5.126,P < 0.05)。

|
图 1 辐照后残留HepG2细胞侵袭迁移能力的变化结晶紫染色×200 Figure 1 Cell migration and invasion of residual HepG2 cells after fractionated irradiation Crystal violet staining ×200 |
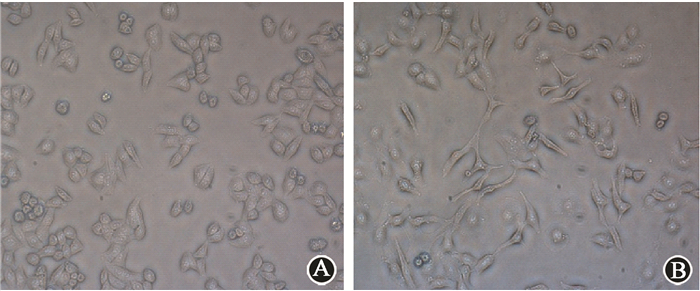
2.照射后残留HepG2细胞表型及其EMT相关蛋白的变化:如图 2所示,对照组HepG2细胞呈堆积生长,且具立方形外观,辐照组残留的HepG2细胞显示出成纤维细胞形态,松散生长,呈长梭形,具有伪足形成,这是EMT的表现,提示分割照射后可能导致残留HepG2细胞产生EMT。为了探索辐照后残留的HepG2细胞是否产生EMT,通过Western blot检测EMT标志蛋白N-cadherin和Snail的表达。图 3显示,辐照后残留的HepG2细胞中N-cadherin蛋白的相对表达量为(1.531±0.113)高于对照组(1.000±0.045)(t=7.509, P < 0.05), 且辐射后残留的HepG2细胞中Snail蛋白的相对表达量为(1.551±0.100)高于对照组(1.000±0.088)(t=7.184, P < 0.05),证明分割照射后HepG2细胞发生了EMT。
|
图 2 细胞形态图×200 A.对照组;B.辐照组 Figure 2 Cell morphology ×200 A.Control group; B. Irradiation group |

|
图 3 辐照前后HepG2细胞N-cadherin和Snail的表达比较 Figure 3 Comparison of the expressions of N-cadherin and Snail in HepG2 cells before and after irradiation |
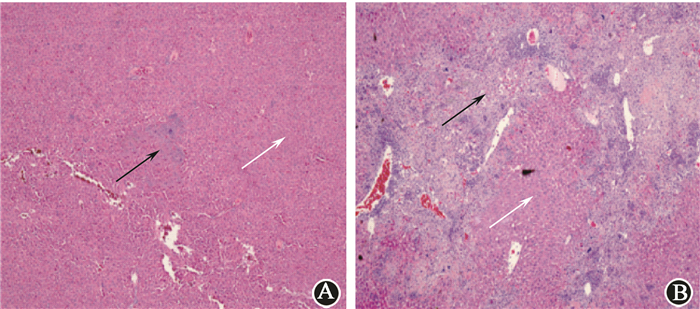
3.辐照后的残留肝癌细胞在裸鼠体内转移能力的变化:对肝脏组织切片进行HE染色(图 4),发现转移灶中细胞形态不规则(黑色箭头所指区域)且与周围正常肝脏组织中有序排列的细胞(白色箭头所指区域)呈明显的形态学区别。两组尾静脉裸鼠肝转移情况:分割照射后残留的肝癌细胞转移率为100%,高于对照组的40%;HE染色结果平均每个视野中,照射残留肝癌细胞的肿瘤转移灶为(3.689±1.386)/视野,多于对照组的(0.178±0.290)/视野(t=5.543,P < 0.05),表明分割照射后的残留肝癌细胞侵袭转移能力增强。
|
图 4 残留肝癌细胞尾静脉注入后的裸鼠肝脏组织病理观察HE染色×100 A.对照组;B.辐照组 注:黑色箭头所指为肿瘤组织;白色箭头所指为正常肝脏组织 Figure 4 HE Liver tissue of nude mice implanted with residual HepG2 cells through tail vein HE staining ×100 A. Control group; B. Irradiation group |
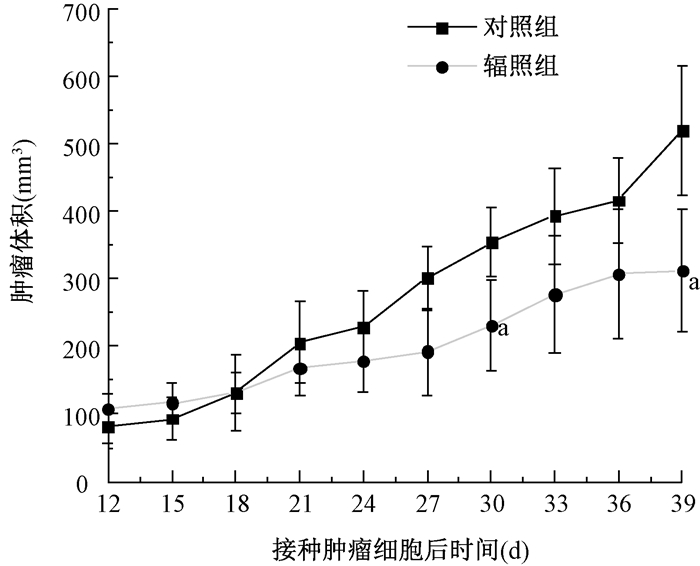
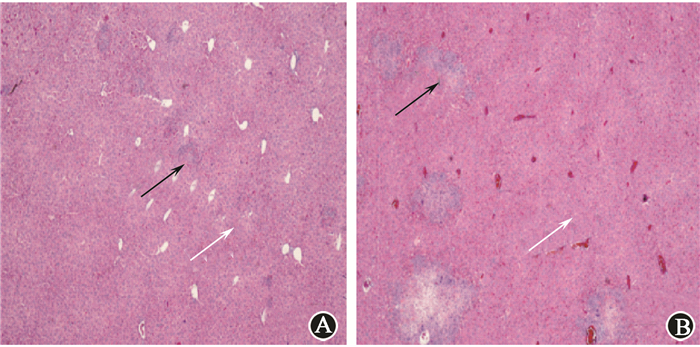
4.分割照射对裸鼠移植瘤生长和转移能力的影响:移植瘤生长曲线如图 5所示,裸鼠移植瘤受到照射后其生长受到抑制。接种后39 d解剖、测量移植瘤重量和体积,辐照组体积(312.7±100.3)mm3,低于对照组(520.1±106.5)mm3,辐照组移植瘤重量(0.306±0.776)g,低于对照组(0.477±0.139)g(t=3.170、2.396,P < 0.05)。解剖后观察肝脏并进行HE染色(图 6),辐照组的裸鼠肝转移率为80%,高于对照组的20%;平均每个视野中,辐照组肝脏肿瘤转移灶为(1.976±1.368)/视野,高于对照组(0.113±0.253)/视野(t=2.994,P < 0.05)。
|
图 5 20 Gy分割照射后裸鼠肝癌移植瘤生长曲线 注:a与对照组比较,t=2.938、3.170,P < 0.05; Figure 5 Growth curves of the fractionated irradiated (total dose 20 Gy) xenograft tumor in nude mice |
|
图 6 20 Gy分割照射组和对照组移植瘤裸鼠肝脏组织病理观察HE染色×100 A.对照组;B.辐照组 注:黑色箭头所指为肿瘤组织;白色箭头所指为正常肝脏组织 Figure 6 Liver tissues of nude mice bearing xenograft tumors after 20 Gy fractionated radiation or nonirradiated control HE staining ×100 A. Control group; B. Irradiation group |
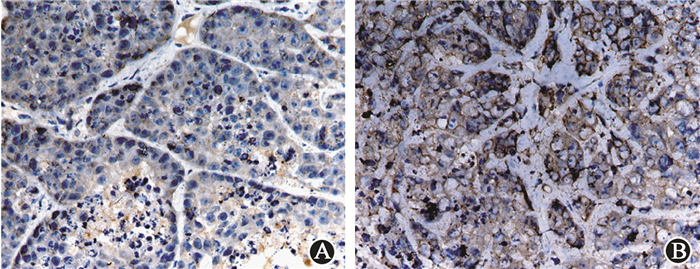
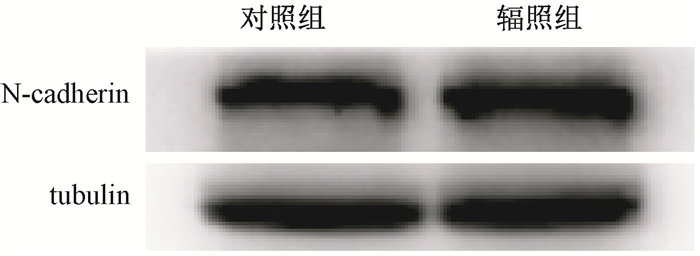
5.裸鼠移植瘤组织中N-cadherin表达:裸鼠皮下移植瘤实验发现,移植瘤受分割照射后肝转移能力增强,同时,对裸鼠移植瘤中EMT标志蛋白N-cadherin的组织化学检测表明,移植瘤组织切片中棕色加深(图 7),说明N-cadherin表达增高。同时,Western blot结果也显示(图 8),相对于对照组,辐照组小鼠的肿瘤组织中N-cadherin相对表达量(1.332±0.087)高于对照组(1.000±0.051)(t=5.695,P < 0.05),说明分割照射导致移植瘤中N-cadherin表达增高。
|
图 7 对照组及辐照组裸鼠移植瘤N-cadherin表达比较免疫组织化学染色×400 A.对照组;B.辐照组 Figure 7 N-cadherin expressions in the xenograft tumor of control and irradiation group mice Immumohistochemical staining ×400 A. Control group; B. Irradiation group |
|
图 8 对照组及辐照组裸鼠移植瘤N-cadherin表达比较 Figure 8 N-cadherin expressions in the xenograft tumor of control and irradiation group mice measured by Western blot assay |
讨论
分割照射可以使受照射的正常细胞在给予额外剂量之前得到部分修复,从而减轻放疗对正常组织的损伤[4-5],同时可让肿瘤细胞再氧合并将其细胞周期重新分配到更敏感的阶段,增加放疗对肿瘤的杀伤作用[4, 6-7],因此分割照射是临床肿瘤放射治疗的主要方式。然而,最近的研究发现乳腺癌细胞在分割照射后其侵袭迁移能力增强[8],临床上也发现结直肠癌、肺癌等多种肿瘤可在放疗结束后发生远处转移[9-11]。但是,目前的研究多集中于照射后短期内肿瘤细胞侵袭迁移能力的改变,对远期效应较少关注。因此,本研究探讨了分割照射结束后残留肝癌细胞其侵袭转移能力的长期改变及其机制,并在动物水平进行模拟验证。
本研究采用临床肿瘤分割照射中大多使用的2 Gy作为细胞和动物实验分割照射时的单次照射剂量[3]。首先,对HepG2细胞进行了总剂量为20 Gy的分割照射,照射结束后再对残留HepG2细胞进行培养,发现残留的HepG2在培养30 d后细胞状态稳定且细胞增殖能力基本恢复,本研究将此时的肝癌细胞定义为残留肝癌细胞。残留肝癌细胞中可能具有一些细胞产生辐射抗性或者具有一些干细胞表型,但是该细胞进行的侵袭转移实验现象更加符合实际照射对肝癌长期影响,所以本研究对其侵袭迁移能力的改变进行探究。体外侵袭实验及尾静脉注射细胞实验结果均显示:受照射后的残留肝癌细胞其侵袭迁移能力高于对照组。本研究通过裸鼠移植瘤实验模型,发现分割照射导致皮下移植瘤转移能力增强,在对裸鼠移植瘤照射时,采用临床肿瘤分割照射采用的2 Gy[3],对裸鼠进行20 Gy累积剂量的照射。Li等[12]发现,在带MHCC97 L细胞移植瘤的裸鼠模型中,将裸鼠肿瘤辐照后30 d发现辐照组移植瘤肝转移率显著提高。
肿瘤产生EMT后,肿瘤细胞间粘附减弱,细胞运动性增强,从而使肿瘤细胞向远处转移扩散[13]。有研究发现,EMT在肝癌肝内扩散和远端转移中起着重要作用[14],并且辐射可以诱导肿瘤细胞产生EMT[15-16],其中N-cadherin和Snail是EMT标志蛋白[17]。本研究发现, 辐照后残留的HepG2细胞在形态上从上皮细胞向间充质细胞的表型转变,分割照射后30 d残留HepG2细胞中出现EMT相关蛋白N-cadherin、Snail表达增加,进一步证实辐照后残留HepG2细胞产生EMT。
N-cadherin不仅仅标志EMT的产生,也可以诱导细胞产生EMT,在肿瘤中N-cadherin的表达会增强其侵袭迁移能力[18]。而且,Snail不仅是EMT的早期标志物,也能通过抑制E-cadherin的表达来促进肿瘤EMT产生,是EMT过程中关键的转录因子[19-20]。临床发现,肝癌细胞中Snail的高表达与其预后不良相关[20],结合本研究的结果说明了辐照可诱导残留HepG2细胞通过积累Snail蛋白刺激肝癌产生长时程EMT(long-term EMT)。同时,裸鼠移植瘤实验发现,肝转移严重的辐照组移植瘤中N-cadherin的表达也相应增高,进一步在实体肿瘤中说明分割照射通过促进EMT从而导致移植瘤转移能力的增加。
本研究结果说明,分割照射通过促进照射后残留HepG2细胞产生EMT,导致其长期具有较强的侵袭迁移能力。但是,由于辐射诱导肿瘤EMT的产生机制及其在肿瘤转移中的作用机制十分复杂,与辐射诱导肿瘤微环境各种因子的释放具有十分密切的关系[17],EMT在放疗导致肿瘤转移中具体作用及其机制仍需深入研究,以期为肿瘤放疗效果的提高提供更多的理论和实验依据。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突作者贡献声明 张行进行实验并撰写论文初稿;潘燕、邵春林负责实验指导、论文审阅与修改
| [1] |
Hernandez-Gea V, Toffanin S, Friedman SL, et al. Role of the microenvironment in the pathogenesis and treatment of hepatocellular carcinoma[J]. Gastroenterology, 2013, 144(3): 512-527. DOI:10.1053/j.gastro.2013.01.002 |
| [2] |
Ma S, Jiao B, Liu X, et al. Approach to radiation therapy in hepatocellular carcinoma[J]. Cancer Treat Rev, 2010, 36(2): 157-163. DOI:10.1016/j.ctrv.2009.11.008 |
| [3] |
Kondo Y, Kimura O, Shimosegawa T. Radiation therapy has been shown to be adaptable for various stages of hepatocellular carcinoma[J]. World J Gastroenterol, 2015, 21(1): 94-101. DOI:10.3748/wjg.v21.i1.94 |
| [4] |
Huber SM, Butz L, Stegen B, et al. Ionizing radiation, ion transports, and radioresistance of cancer cells[J]. Front Physiol, 2013, 4: 212. DOI:10.3389/fphys.2013.00212 |
| [5] |
Hubenak JR, Zhang Q, Branch CD, et al. Mechanisms of injury to normal tissue after radiotherapy: a review[J]. Plast Reconstr Surg, 2014, 133(1): 49e-56e. DOI:10.1097/01.prs.0000440818.23647.0b |
| [6] |
Bernier J, Hall EJ, Giaccia A. Radiation oncology: a century of achievements[J]. Nat Rev Cancer, 2004, 4(9): 737-747. DOI:10.1038/nrc1451 |
| [7] |
Good JS, Harrington KJ. The hallmarks of cancer and the radiation oncologist: updating the 5Rs of radiobiology[J]. Clin Oncol (R Coll Radiol), 2013, 25(10): 569-577. DOI:10.1016/j.clon.2013.06.009 |
| [8] |
Kim RK, Kaushik N, Suh Y, et al. Radiation driven epithelial-mesenchymal transition is mediated by Notch signaling in breast cancer[J]. Oncotarget, 2016, 7(33): 53430-53442. DOI:10.18632/oncotarget.10802 |
| [9] |
Cojoc M, Peitzsch C, Kurth I, et al. Aldehyde dehydrogenase is regulated by beta-catenin/tcf and promotes radioresistance in prostate cancer progenitor cells[J]. Cancer Res, 2015, 75(7): 1482-1494. DOI:10.1158/0008-5472.CAN-14-1924 |
| [10] |
Kawamoto A, Yokoe T, Tanaka K, et al. Radiation induces epithelial-mesenchymal transition in colorectal cancer cells[J]. Oncol Rep, 2012, 27(1): 51-57. DOI:10.3892/or.2011.1485 |
| [11] |
Cui YH, Suh Y, Lee HJ, et al. Radiation promotes invasiveness of non-small-cell lung cancer cells through granulocyte-colony-stimulating factor[J]. Oncogene, 2015, 34(42): 5372-5382. DOI:10.1038/onc.2014.466 |
| [12] |
Li T, Zeng ZC, Wang L, et al. Radiation enhances long-term metastasis potential of residual hepatocellular carcinoma in nude mice through TMPRSS4-induced epithelial-mesenchymal transition[J]. Cancer Gene Ther, 2011, 18(9): 617-626. DOI:10.1038/cgt.2011.29 |
| [13] |
Thiery JP, Sleeman JP. Complex networks orchestrate epithelial-mesenchymal transitions[J]. Nat Rev Mol Cell Biol, 2006, 7(2): 131-142. DOI:10.1038/nrm1835 |
| [14] |
Ye LY, Chen W, Bai XL, et al. Hypoxia-induced epithelial-to-mesenchymal transition in hepatocellular carcinoma induces an immunosuppressive tumor microenvironment to promote metastasis[J]. Cancer Res, 2016, 76(4): 818-830. DOI:10.1158/0008-5472.CAN-15-0977 |
| [15] |
Kesanakurti D, Maddirela D, Banasavadi-Siddegowda YK, et al. A novel interaction of PAK4 with PPAR gamma to regulate Nox1 and radiation-induced epithelial-to-mesenchymal transition in glioma[J]. Oncogene, 2017, 36(37): 5309-5320. DOI:10.1038/onc.2016.261 |
| [16] |
Nagarajan D, Melo T, Deng Z, et al. ERK/GSK3beta/Snail signaling mediates radiation-induced alveolar epithelial-to-mesenchymal transition[J]. Free Radic Biol Med, 2012, 52(6): 983-992. DOI:10.1016/j.freeradbiomed.2011.11.024 |
| [17] |
Shibue T, Weinberg RA. EMT, CSCs, and drug resistance: the mechanistic link and clinical implications[J]. Nat Rev Clin Oncol, 2017, 14(10): 611-629. DOI:10.1038/nrclinonc.2017.44 |
| [18] |
Serrano-Gomez SJ, Maziveyi M, Alahari SK. Regulation of epithelial-mesenchymal transition through epigenetic and post-translational modifications[J]. Mol Cancer, 2016, 15: 18. DOI:10.1186/s12943-016-0502-x |
| [19] |
Kurrey NK, Jalgaonkar SP, Joglekar AV, et al. Snail and slug mediate radioresistance and chemoresistance by antagonizing p53-mediated apoptosis and acquiring a stem-like phenotype in ovarian cancer cells[J]. Stem Cells, 2009, 27(9): 2059-2068. DOI:10.1002/stem.154 |
| [20] |
Yang MH, Chen CL, Chau GY, et al. Comprehensive analysis of the independent effect of twist and snail in promoting metastasis of hepatocellular carcinoma[J]. Hepatology, 2009, 50(5): 1464-1474. DOI:10.1002/hep.23221 |
 2018, Vol. 38
2018, Vol. 38


