2. 410008 长沙, 中南大学湘雅医院肿瘤科;
3. 410083 长沙, 中南大学信息科学与工程学院
2. Department of Oncology, Xiangya Hospital to Central South University, Changsha 410008, China;
3. College of Information Science and Engineering, Central South University, Changsha 410083, China
γ分析法是广泛用于调强放疗计划验证的方法,它率先由Low等[1]提出,其数学表达式包含百分剂量差异(percent dose difference,%DD)、一致性距离(distance to agreement,DTA)以及γ通过率3个参数。美国医学物理师协会(AAPM) TG-119报告认为,在3 %DD和3 mm DTA条件下,全局γ通过率超过90%便认为计划是合格的[2]。但是,目前已有文献证实该指导性的评价标准不具备很强的临床相关性,即在评判计划是否合格方面未能同时具备较高的敏感性和特异性[3-5]。McKenzie等[6]的研究中,针对特定的调强验证设备,基于γ分析的评价方法存在一个最佳通过率阈值。本研究拟采用受试者工作特征(receiver operating characteristic,ROC)曲线,并基于三维剂量验证系统EDoseTM(广东瑞多思公司)的剂量体积直方图(DVH)评价工具寻找食管癌调强放疗(IMRT)计划验证中的最佳γ通过率阈值,为该系统的后续应用奠定基础。
资料与方法1.患者体位固定及CT扫描:本研究选取2016—2017年在湘雅医院接受调强放疗的25例食管癌患者,采用仰卧位双臂上举抱头并使用颈胸热塑体膜进行固定,利用Somatom Definition(德国西门子公司)20层大孔径定位CT进行螺旋扫描,扫描方式为平扫加增强,扫描层厚和层距均为3 mm,扫描范围为全颈和全胸,包含双肺、心脏和脊髓等正常组织,获取CT图像之后通过网络传输至美国瓦里安Eclipse计划系统中。
2.患者计划设计与执行:计划靶区(PTV)处方剂量范围为4 922~6 600 cGy,并保证95%的靶体积满足处方要求。主要危及器官剂量限值:肺V5≤60%、V20≤30%,心脏V30≤40%,V40≤30%,脊髓Dmax≤4 000 cGy。所有计划设计均在瓦里安Eclipse治疗计划系统(TPS)11.3版上进行,并选用各向异性分析算法(anisotropie analytical algorithm, AAA)进行优化,计算网格边长为2.5 mm。调强计划采用7野照射,床角度为0°,小机头角度为0°,多叶准直器使用滑窗技术,400 MU/min。计划设计确认无误后利用瓦里安23EX加速器,配备60对多叶准直器(MLC)进行6 MV光子束照射治疗。
3.三维剂量验证:将25个食管癌IMRT计划及其相应的CT图像、计划设置参数信息、计算剂量及解剖结构信息以DICOM文件形式导入EDoseTM系统中进行治疗前三维剂量验证。本研究选用美国瓦里安23EX加速器自带的电子射野影像设备(EPID)非晶硅平板探测器进行图像采集。为确保EPID图像采集的质量,测量前需先对其进行本底图像和泛野图像的校准,以消除探测器内部的噪声,保证探头测量的一致性[7-8]。图像采集时将EPID板升至离源距离140 cm处,计划经加速器执行之后,EPID探测板在无模体条件下采集各射野的图像,通过图像像素计算出实际的通量分布并结合患者的CT解剖图像,利用筒串卷积叠加算法(CCC)来进行三维剂量重建。
4.剂量学差异比较:所有计划经剂量重建后,根据得到的不同感兴趣结构实测DVH及TPS计算得到的预测DVH,从中选取相应的剂量学指标计算出绝对百分剂量差异,其中绝对百分剂量差异=|(EDose实测剂量-TPS计算剂量)/TPS计算剂量|×100%。同时γ通过率采用全局计算方法在5%/3 mm、3%/3 mm、2%/2 mm基准下获得,剂量阈值设为10%。
选取的特定剂量学指标包括PTV的D95、D98和D2,危及器官左肺和右肺的V5、V20以及心脏的Dmax。
5.敏感性和特异性分析:一旦绝对百分剂量差异>5%且γ通过率>90%则视为假阴性,γ通过率<90%则视为真阳性;反之,绝对百分剂量差异<5%且γ通过率>90%则视为真阴性,γ通过率<90%则视为假阳性;其中敏感性=真阳性/(真阳性+假阴性);特异性=真阴性/(真阴性+假阳性)。
6.最佳阈值点的确定:ROC曲线作为重要的统计学中用于二分类判别的工具,它以1-特异性(假阳性率)作为横坐标、敏感性(真阳性率)作为纵坐标来寻找最佳界值点[9],使敏感性和特异性尽可能保持平衡,以此来减少漏判和误判的发生。在使用ROC曲线确定最佳阈值点之前,需先对选取的25个食管癌IMRT计划进行DVH评价,根据选取的特定剂量学指标获得的绝对百分剂量差异,一旦该计划选定的任一指标中出现绝对百分剂量差异>5%时[10]便视为临床不可接受计划,否则视为临床可接受计划。将此分类结果作为标准结合3种γ通过率利用SSPS 17.0绘制出ROC曲线并给出曲线下面积(area under the curve,AUC);根据AUC值的大小可以推断哪种γ分析基准的评价效果更好。在绘制完ROC曲线之后计算出约登系数(Youden index)=敏感性+特异性-1,系数最大的即为最佳γ通过率阈值。
结果1.计划分类:根据6中的分类标准将25个食管癌IMRT计划划分成两类,其中3个计划所有特定剂量学指标的绝对百分剂量差异<5%视为临床可接受计划,其余22个计划中某一剂量学指标出现绝对百分剂量差异>5%视为临床不可接受计划,结果列表 1。
|
|
表 1 25例食管癌IMRT计划在8个特定剂量学指标处的绝对百分剂量差异(%) Table 1 The absolute percent dose differences in eight specific dosimetry indices within the 25 esophageal cancer IMRT plans(%) |
2.最佳阈值点的确定:25个食管癌IMRT计划在不同测量基准下获得75个总γ通过率,其中使用5%/3 mm、3%/3 mm以及2%/2 mm基准下的平均γ通过率和对应标准差分别为97.0±1.9、92.7±2.9、78.4±4.9。
利用SPSS 17.0以及获得的绝对百分剂量差异、γ通过率可以绘制出不同测量基准下的ROC曲线(图 1)并求出约登系数确定最佳阈值(表 2)。
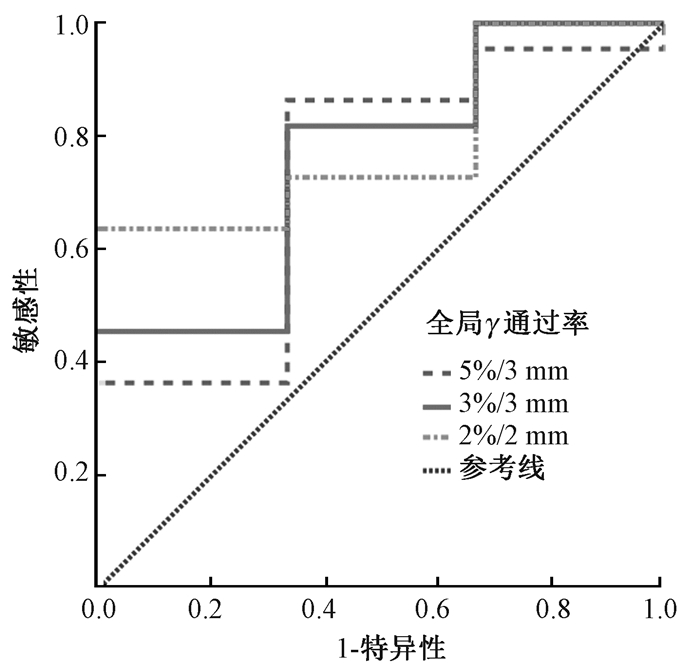
|
图 1 全局γ在5%/3 mm、3%/3 mm、2%/2 mm基准下的ROC曲线 Figure 1 ROC curves for 5%/3 mm, 3%/3 mm, 2%/2 mm as the criteria for the global gamma analysis |
|
|
表 2 全局γ在5%/3 mm、3%/3 mm、2%/2 mm基准下ROC曲线确定的最佳阈值及AUC值等相关参数 Table 2 The optimal thresholds and AUC values obtained by the ROC curves for 5%/3 mm, 3%/3 mm and 2%/2 mm as the criteria for the global gamma analysis |
3.最佳阈值点验证:为了定量比较在3%/3 mm测量基准下常规阈值(90%)和最佳阈值识别假阴性和假阳性的能力,同时观察在5%/3 mm、2%/2 mm基准下最佳阈值处的敏感性和特异性大小。本研究根据假阴性和真阳性的分类标准对产生最佳通过率阈值的25个食管癌IMRT计划进行敏感性和特异性分析,结果列于表 3。
|
|
表 3 全局γ使用5%/3 mm、3%/3 mm、2%/2 mm基准在最佳阈值处的敏感性和特异性 Table 3 The sensitivity and specificity of the optimal threshold for 5%/3 mm, 3%/3 mm and 2%/2 mm as the criteria for the global gamma analysis |
讨论
目前绝大多数IMRT患者QA都是利用γ通过率的高低来判断计划是否通过,然而γ通过率并不能给出医生更为关心的相应感兴趣解剖结构的具体剂量差异,从而导致患者治疗计划质量保证(QA)的临床意义降低[11]。目前已有研究发现,在QA过程中可能存在假阴性(计划由于γ通过率较高而被视为合格计划,但其实际剂量与预测剂量间的差异可能超过临床可接受范围)和假阳性(计划由于γ通过率过低而被判定为不合格计划,但其剂量准确性却能满足临床实际需求)的情况[12-13]。因此,本研究通过敏感性和特异性分析来定量评价γ通过率阈值判断计划是否合格的可靠程度。敏感性指的是识别不可接受计划的能力,敏感性越大,通过不可接受计划的机会就越小;而特异性则指的是区分可接受计划的能力,特异性越高,将可接受计划判定为不可接受计划的概率就越低[14]。在本研究中选取的25个食管癌IMRT计划进行患者QA时同样存在假阴性和假阳性的情况,从本研究得到的数据来看使用3%/3 mm基准,全局γ常规90%通过率的敏感性并不高,其识别绝对百分剂量差异>5%的效果并不好,不合格计划很可能因为漏判而成为合格计划;而提高通过率的办法可以使得敏感性上升,但特异性的降低则会导致一些可接受计划被误判成不可接受计划而需要物理师进行重新修改,因此如何选择γ通过率阈值和测试基准来减少漏判与误判的发生就显得至关重要。
ROC曲线作为一种用于临床疾病的诊断曲线,它可以通过确定最佳界值点的方式来降低假阴性和假阳性情况的发生,使敏感性和特异性趋于平衡;其AUC值的大小还能比较哪种试验标准的诊断效果最佳(AUC值越接近于1,分类的效果就越好;45°对角线下的AUC值为0.5,说明分类较为随机;AUC值在0.5~0.7表明分类的准确性还不高,0.7~0.9准确性较好,0.9以上准确性很高)[15]。
本研究使用基于EPID测量的三维剂量验证系统EDoseTM进行治疗前的三维剂量验证。国内已有不少文献对其使用DVH进行计划评价的准确性进行过研究,认为其能够应用于日常的患者QA工作[8, 16]。而在最佳阈值处使用5%/3 mm、3%/3 mm基准进行验证时,其特异性虽然不好,但较高的敏感性(0.85以上)能够最大程度的阻止不可接受计划通过来满足临床实际需求,减少计划由于漏判而给患者带来不必要的危害;同时3%/3 mm基准条件下得到的最佳阈值94.84%与Nelms和Simon[17]建议3%/3 mm基准通过率阈值95%也较为接近。而使用2%/2 mm基准进行测量时,最佳阈值处的敏感性和特异性更为平衡(相比于3%/3 mm基准),在尽可能阻止不可接受计划通过的同时,又减小了可接受计划被误判而增加物理师工作量的机会;同时不同测量基准下ROC曲线给出的AUC值大小也再次说明2%/2 mm基准的测试效果会更好。因此,本课题组建议在日常的患者QA过程中尽量使用更为严格的2%/2 mm基准来进行测试分析,这与Cozzolino等[18]的建议也较为吻合。
值得说明的是,从得到的绝对百分剂量差异数据来看靶区基于EDoseTM测量结果与TPS系统计算结果之间存在较多超过5%的差异,这可能是由于这部分靶区离皮肤较近,而EDoseTM软件对于浅表剂量的修正效果较差从而导致剂量差异偏高,这在Huang等[8]的研究中也得到过证实;此外像肺部这些非均匀组织结构,不同算法进行剂量计算时也会存在较大偏差(Eclipse TPS为AAA算法,EDoseTM为CCC算法),上述差异的存在都会间接影响ROC曲线给出的AUC值大小。
综上,本研究基于EDoseTM三维剂量验证系统探寻了食管癌调强计划在5%/3 mm、3%/3 mm以及2%/2 mm基准下的Gamma最佳通过率阈值,为下一步基于该系统进行不同病种的3维剂量验证提供了坚实的基础,同时也为其他机构的临床应用及研究提供了相关的参考依据和价值。此外,将更具临床相关性的DVH评价方法同γ通过率相结合能更好地对计划进行分类,提升QA的临床意义。
利益冲突 本研究由署名作者按以下贡献声明独立开展,未接受有关公司的任何赞助,不涉及各相关方的利益冲突,在此对研究的独立性和科学性予以保证作者贡献声明 刘礼东负责收集和统计数据、结果分析及论文撰写;杨振负责课题设计及学术建议;邱小平指导论文撰写及修改;赵于前、雷明军、曹瑛、杨晓喻、唐杜参与数据收集及病例选择;王翰宇、左宇浩负责临床资料分析及统计
| [1] |
Low DA, Harms WB, Mutic S, et al. A technique for the quantitative evaluation of dose distributions[J]. Med Phys, 1998, 25(5): 656-661. DOI:10.1118/1.598248 |
| [2] |
Ezzell GA, Burmeister JW, Dogan N, et al. IMRT commissioning:multiple institution planning and dosimetry comparisons, a report from AAPM Task Group 119[J]. Med Phys, 2009, 36(11): 5359-5373. DOI:10.1118/1.3238104 |
| [3] |
Carrasco P, Jornet N, Latorre A, et al. 3D DVH-based metric analysis versus per-beam planar analysis in IMRT pretreatment verification[J]. Med Phys, 2012, 39(8): 5040-5049. DOI:10.1118/1.4736949 |
| [4] |
Stasi M, Bresciani S, Miranti A, et al. Pretreatment patient-specific IMRT quality assurance:a correlation study between gamma index and patient clinical dose volume histogram[J]. Med Phys, 2012, 39(12): 7626-7634. DOI:10.1118/1.4767763 |
| [5] |
Caivano R, Califano G, Fiorentino A, et al. Clinically relevant quality assurance for intensity modulated radiotherapy plans:gamma maps and DVH-based evaluation[J]. Cancer Invest, 2014, 32(3): 85-91. DOI:10.3109/07357907.2013.877478 |
| [6] |
McKenzie EM, Balter PA, Stingo FC, et al. Toward optimizing patient-specific IMRT QA techniques in the accurate detection of dosimetrically acceptable and unacceptable patient plans[J]. Med Phys, 2014, 41(12): 121702. DOI:10.1118/1.4899177 |
| [7] |
Van Elmpt W, Nijsten S, Mijnheer B, et al. The next step in patient-specific QA:3D dose verification of conformal and intensity-modulated RT based on EPID dosimetry and Monte Carlo dose calculations[J]. Radiother Oncol, 2008, 86(1): 86-92. DOI:10.1016/j.radonc.2007.11.007 |
| [8] |
Huang M, Huang D, Zhang J, et al. Preliminary study of clinical application on IMRT three-dimensional dose verification-based EPID system[J]. J Appl Clin Med Phys, 2017, 18(4): 97-105. DOI:10.1002/acm2.12098 |
| [9] |
Carlone M, Cruje C, Rangel A, et al. ROC analysis in patient specific quality assurance[J]. Med Phys, 2013, 40(4): 042103. DOI:10.1118/1.4795757 |
| [10] |
Kutcher GJ, Coia L, Gillin M, et al. Comprehensive QA for radiation oncology:report of AAPM Radiation Therapy Committee Task Group 40[J]. Med Phys, 1994, 21(4): 581-618. DOI:10.1118/1.597316 |
| [11] |
Jin X, Yan H, Han C, et al. Correlation between gamma index passing rate and clinical dosimetric difference for pre-treatment 2D and 3D volumetric modulated arc therapy dosimetric verification[J]. Br J Radiol, 2015, 88(1047): 20140577. DOI:10.1259/bjr.20140577 |
| [12] |
Nelms BE, Zhen H, Tomé WA. Per-beam, planar IMRT QA passing rates do not predict clinically relevant patient dose errors[J]. Med Phys, 2011, 38(2): 1037-1044. DOI:10.1118/1.3544657 |
| [13] |
Zhen H, Nelms BE, Tome WA. Moving from gamma passing rates to patient DVH-based QA metrics in pretreatment dose QA[J]. Med Phys, 2011, 38(10): 5477-5489. DOI:10.1118/1.3633904 |
| [14] |
Waghorn BJ, Meeks SL, Langen KM. Analyzing the impact of intrafraction motion:correlation of different dose metrics with changes in target D95%[J]. Med Phys, 2011, 38(8): 4505-4511. DOI:10.1118/1.3605633 |
| [15] |
Hanley JA, McNeil BJ. A method of comparing the areas under receiver operating characteristic curves derived from the same cases[J]. Radiology, 1983, 148(3): 839-843. DOI:10.1148/radiology.148.3.6878708 |
| [16] |
黄妙云, 陈明秋, 陈远贵, 等. 基于EPID三维剂量验证系统的物理模型测试及临床应用的初步研究[J]. 中华放射肿瘤学杂志, 2016, 25(12): 1335-1340. Huang MY, Chen MQ, Chen YG, et al. A preliminary study of test and clinical application of a physical model based on the three-dimensional dose verification system using electronic portal imaging device[J]. Chin J Radiat Oncol, 2016, 25(12): 1335-1340. DOI:10.3760/cma.j.issn.1004-4221.2016.12.014 |
| [17] |
Nelms BE, Simon JA. A survey on planar IMRT QA analysis[J]. J Appl Clin Med Phys, 2007, 8(3): 76-90. DOI:10.1120/jacmp.v8i3.2448 |
| [18] |
Cozzolino M, Oliviero C, Califano G, et al. Clinically relevant quality assurance (QA) for prostate RapidArc plans:gamma maps and DVH-based evaluation[J]. Phys Med, 2014, 30(4): 462-472. DOI:10.1016/j.ejmp.2014.01.003 |
 2018, Vol. 38
2018, Vol. 38


