结直肠癌是全球最常见的恶性肿瘤之一[1-3],放射治疗是其主要治疗手段之一[4-5]。DDX46基因位于染色体5q31.1,它编码ATP依赖的DEAD-box RNA解旋酶,该酶是17S U2小核核糖核酸颗粒(核蛋白)复合物的成分[6]。体外研究表明,DDX46在前mRNA剪接或剪接前体组装之前或期间发挥着核心作用[7-9]。在结肠癌、食管癌的发生发展中,DDX46在肿瘤组织中高表达,沉默DDX46可促进细胞凋亡、抑制肿瘤集落形成[10-11]。然而,DDX46沉默对结直肠癌电离辐射敏感性的影响尚未见报道。本研究采用不同剂量X射线照射包装DDX46基因RNAi靶点序列慢病毒感染的SW480细胞及空载质粒转染的SW480细胞,运用CCK-8比色法、Western blot法、免疫荧光技术等研究体外DDX46下调对结肠癌细胞辐射敏感性的影响。
材料与方法1.细胞株与试剂:人结肠癌细胞株SW480购于中国科学院细胞库。二甲基亚砜(DMSO)(美国Sigma公司),DMEM细胞生长培养基、胰蛋白酶、细胞用青霉素/链霉素双抗(美国GIBCO公司),RIPA缓冲液、ECL化学显色剂、SDS聚丙烯酰胺凝胶、BCA标准蛋白试剂盒均购自江苏碧云天技术研究所,CCK-8购自杭州联科生物技术股份有限公司。短马蹄形RNA(shRNA)序列DDX46(5′ CATCCAAACCCAAGCTATT 3′)和非沉默对照序列(5′ TTCTCCGAACGTGTCACGT 3′)根据人DDX46基因(NM_014829)编码序列由GeneChem公司(上海)设计和合成。
2.细胞照射:应用美国Radsource公司照射源照射细胞,射线能量160 kV,照射剂量0、2、4、6、8 Gy,吸收剂量率1.2 Gy/min。源靶距100 cm。
3.慢病毒包装和DDX46基因沉默细胞系的建立与鉴定:合成含干扰序列的单链DNA oligo后,退火配对产生双链DNA oligo,再通过其两端所含酶切位点Age I和EcoRI直接连入酶切后的pGCSIL-GFP-慢病毒载体上。将重组pGCSIL-GFP-慢病毒载体及及其两种辅助包装原件载体质粒,按德国Invitrogen公司Lipofectamine 2000使用说明书转染SW480细胞作为实验组,同时设空载质粒作为阴性对照组。转染后收集富含慢病毒颗粒的细胞上清液,浓缩后得到高滴度的慢病毒浓缩液,测定并标定病毒滴度。转染后72 h在荧光显微镜下观察绿色荧光蛋白(GFP)的表达细胞,SW480细胞转染的率达到90%。通过Western blot检测SW480细胞转染质粒的效果。
4.细胞活力测定:采用CCK-8试剂盒进行检测。将对数生长期SW480细胞接种于96孔板,将适宜量的DDX46基因RNAi靶点序列慢病毒、阴性对照分别加入SW480细胞(MOI=10);转染72 h后分别对实验组和对照组进行0、2、4、6和8 Gy X射线照射;照射24 h后,弃培养基,加入100 μl新鲜培养基,同时加入10 μl CCK-8;37℃培养2 h后,使用酶标仪检测450 nm波长处的吸光度(A)值。
5.免疫荧光法检测γ-H2AX:分别将4 Gy X射线照射0、24 h后的对数生长期的细胞制成细胞悬液,将细胞贴附于有多聚赖氨酸涂层的载玻片上,PBS清洗,固定液(甲醇与丙酮1 :1)固定细胞15 min,采用磷酸盐吐温缓冲液(PBST)配制适量0.5%Triton X\|100室温通透细胞20 min,加入适量5%羊血清室温封闭1 h;移去封闭液,加入适量anti-γ-H2AX(1 :500稀释,美国Abcam公司),4℃孵育过夜;移去一抗,取适量PBST清洗细胞爬片,每次5 min,共3次;加入适量二抗(1 :500稀释,北京中杉金桥生物公司),室温避光孵育1 h;移去二抗,取适量PBST清洗细胞爬片,每次5 min,共3次;4,6\|联脒\|2\|苯基吲哚(DAPI)(1 :200稀释于PBST)复染,室温避光孵育20 min。在激光共聚焦显微镜下观察并记录SW480细胞中绿色γ-H2AX foci数量。
6.Western blot法:RIPA细胞裂解液(P0013B, 江苏碧云天公司)裂解洗脱SW480细胞,超声破碎,4℃环境中静置30 min后,提取上清液,使用BCA蛋白定量测定试剂盒(P0010,江苏碧云天公司),按照操作说明书测定蛋白浓度。使用SDS-PAGE凝胶配制试剂盒(P0012A,江苏碧云天公司),配制12%的分离胶与5%的浓缩胶。调整各上样量至30 μg,加入2×上样缓冲液(含10%13-巯基乙醇),煮沸5 min后取上清在制备好的浓缩胶上以60 V电压、在分离胶上以100 V的电压电泳分离。将完成电泳的凝胶与硝酸纤维素膜、滤纸组合在转移槽上,以100 V电压转膜60 min。再以含5%脱脂奶粉室温封闭60 min,分别加入ATM抗体(1 :1 000稀释,美国Cell Signaling公司),p-ATM抗体(1 :1 000稀释,美国Cell Signaling公司),γ-H2AX抗体(1 :1 000稀释,美国Abcam公司),DNA-PK抗体(1 :1 000稀释,美国Cell Signaling公司),Rad50抗体(1 :1 000稀释,美国Cell Signaling公司)4℃孵育过夜,再以辣根过氧化物酶耦联羊抗兔IgG抗体(1 :2 000到1 :10 000稀释,北京中杉金桥生物公司)孵育60 min,最后用增强化学发光法(P0018,江苏碧云天公司),显色,用FluorChem HD2多功能成像系统曝光成像,采集图像数据后,以GAPDH为参照,AlphaView分析软件分析目的蛋白的表达水平。
7.统计学处理:采用SPSS 16.0统计软件进行数据分析。实验数据均以x±s表示,组间比较正态性检验符合正态分布采用t检验,多组数据之间的比较采用方差分析(ANOVA)。P<0.05为差异有统计学意义。
结果1. DDX46基因沉默细胞系验证:DDX46在SW480细胞中高表达,DDX46基因RNA干扰慢病毒转染SW480细胞后DDX46蛋白水平显著降低,两者相比差异有统计学意义(t=19.68, P<0.01),提示DDX46基因已被沉默。而转染空载质粒后,DDX46蛋白水平与未转染前差异无统计学意义(P>0.05),见图 1。上述结果提示DDX46基因沉默细胞系已构建成功。

|
图 1 各组的DDX46蛋白表达水平 注:1. SW480细胞;2.空载质粒的SW480细胞;3. DDX46基因RNA干扰慢病毒转染后的SW480细胞 Figure 1 The expression level of DDX46 protein in each group |
2. DDX46沉默联合X射线照射能够显著抑制SW480细胞增殖:DDX46基因RNA干扰慢病毒转染的SW480细胞为实验组,空载质粒的SW480细胞为对照组,72 h后对转染的细胞分别进行0、2、4、6和8 Gy X射线照射,吸收剂量率1.2 Gy/min,并利用CCK-8检测照后0、24 h处的细胞活力。与对照组相比,实验组在不同剂量X射线照射下,细胞活力均下降,其中以2和4 Gy照射后细胞活力下降更明显,两组比较差异有统计学意义(t=5.217、4.844,P<0.05),见表 1。
|
|
表 1 DDX46-RNAi-LV联合不同剂量X射线照射后24 h细胞吸光度(A)值(x±s) Table 1 Alterations of cell viabilities in different groups of DDX46-RNAi-LV and its control at 24 h after irradiation with different doses of X-rays (x±s) |
进一步分析,实验组在4 Gy照射条件下,其细胞活力与实验组未照射时相比降低了(15.02±3.92)%,两者相比差异有统计学意义(t=-4.696, P<0.01)。同样在4 Gy照射条件下、实验组的细胞活力比对照组下降了(17.43±1.83)%,两者相比差异有统计学意义(t=4.844, P<0.01)。而对照组照射前后相比,虽然细胞活力有下降,但两者之间差异无统计学意义(P>0.05)。表明沉默DDX46可以提高结肠癌细胞系SW480的辐射敏感性。
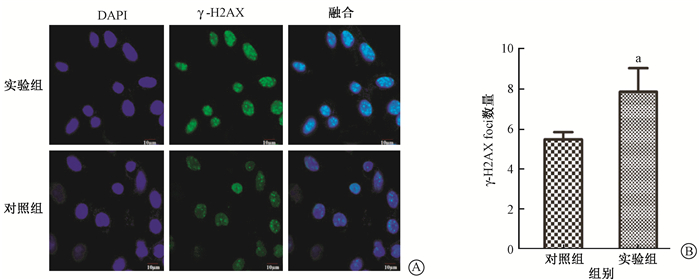
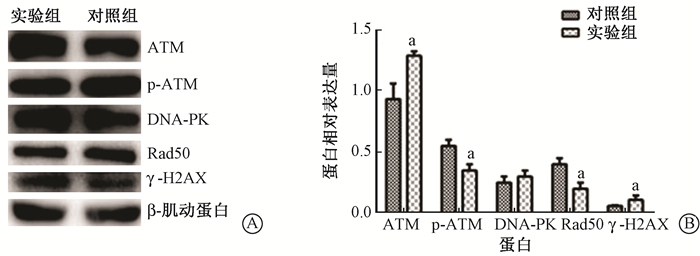
3.DDX46沉默明显抑制结肠癌细胞受照后引起DNA损伤的修复:4 Gy X射线照射24 h后,实验组SW480细胞内残存的γ-H2AX foci数量相比于对照组增加了(43.03±17.6)%,差异有统计学意义(t=-3.108, P<0.05)见图 2。4 Gy X射线照射24 h后,相比于对照组,实验组的SW480细胞内ATM的蛋白水平显著升高,而ATM的活性形式p-ATM以及ATM的下游靶蛋白Rad50的蛋白水平则明显降低,同时残存的γ-H2AX的蛋白水平也有一定程度的升高;DNA-PK在两组细胞内的蛋白水平变化不大,见图 3。这些结果表明,沉默DDX46可以通过抑制结肠癌细胞系SW480中ATM的活化,从而抑制辐射诱导的DNA损伤的同源重组修复,提高SW480的辐射敏感性。
|
图 2 4 Gy X射线照射24 h后,实验组与对照组SW480细胞内残存的γ-H2AX foci数量的变化 A.γ-H2AX的免疫荧光检测×1 000;B.实验组和对照组细胞中γ-H2AX foci数量 注:a与对照组比较,t=-3.108, P<0.05 Figure 2 At 24 h after 4 Gy X-rays irradiation, the amount of γ-H2AX foci remained in the SW480 cells of the experimental group and its control A. Immunofluorescence detection of γ-H2AX ×1 000; B. The amount of γ-H2AX foci in the SW480 cells of the experimental group and its control |
|
图 3 4 Gy X射线照射24 h后,ATM、p-ATM、DNA-PK、Rad50和γ-H2AX蛋白表达的变化 A. Western blot检测各蛋白的表达差异;B.实验组和对照组各蛋白的相对表达量及对比 注:a与对照组比较,t=7.530、4.260、4.260、-3.090,P<0.05 Figure 3 At 24 h after 4 Gy X-rays irradiation, the expressions of ATM, p-ATM, DNA-PK, Rad50 and γ-H2AX protein A.Western blot assay of these proteins; B. Relative expression levels of these proteins in the experimental group and its control |
讨论
DDX46是RNA解旋酶中DEAD-box家族的一员,其特点是保守的基序ASP-谷氨酸-丙氨酸-天冬氨酸(DEAD)[12]。DEAD-box家族成员参与细胞过程调节的RNA二级结构[13]。在许多情况下,DEAD-box蛋白表现出除了其ATP水解和RNA解旋的活动等功能。研究表明,DEAD-box蛋白涉及细胞增殖和/或肿瘤转化,这意味着这些分子在人类癌症发展中发挥作用[14-16]。在肿瘤治疗中,放疗的应用已近百年,占据着不可替代的重要地位[17],DNA损伤修复被认为影响放射敏感性的重要因素[18]。本课题主要研究DDX46在结直肠癌细胞电离辐射中的影响和作用机制。
电离辖射照射生物体后可产生直接作用和间接作用两种生物学效应[19]。直接作用为射线直接击中DNA分子链,造成DNA的单链断裂(single-strain broken,SSB)或双链断裂(double-strain broken,DSB);间接作用为射线或其次级电子对水分子或其他分子等的电离,产生自由基及其他对生物体有害的物质。自由基及那些有害物质再与生物大分子相互作用,如DNA、RNA和蛋白质等,造成DNA和细胞的损伤。
放射治疗主要利用电离福射(包括X射线及放射性同位素发出的α、β、γ等射线)的生物效应杀灭肿瘤细胞,从而达到治疗目的。影响肿瘤细胞放射敏感性的因素是多方面的,并且十分复杂。有研究认为肿瘤细胞的放射敏感性取决于遗传所决定的细胞固有辐射敏感性、细胞凋亡、辐射致DNA损伤后的修复能力、细胞周期中不同时期细胞分布、耗氧水平、分裂细胞数量、基因表达等多种因素[20]。
本研究结果显示,实验组4 Gy X射线照射条件下的细胞活力与实验组未照射相比较明显降低,与对照组4 Gy X射线照射时也呈明显降低;而对照组4 Gy X射线照射条件下的细胞活力,与对照组未照射之间差异无统计学意义。研究表明,沉默DDX46可以提高结肠癌细胞系SW480的辐射敏感性。
DNA损伤及修复是辐射生物效应的主要原因(包括细胞死亡、丧失再增殖能力、突变等),肿瘤细胞的辐射耐受性往往与过强的DNA修复能力增加有关[21]。H2AX蛋白是组蛋白H2A家族中的一员,早期研究发现H2AX参与细胞核内DNA分子的损伤修复作用以及细胞凋亡[22-23]。研究发现,受照细胞中γ-H2AX的数量可代表未被修复的DSBs数量,数量越多则代表此肿瘤细胞放射敏感性越强[24-27]。体内外细胞实验表明γ-H2AX是预测细胞内DNA损伤的一个快速敏感指标[28-29],γ-H2AX蛋白可作为肿瘤细胞DNA损伤灵敏和特异性生物学标志,可用于判断肿瘤细胞对放射治疗敏感或抵抗[30-33]。本研究中,4 Gy X射线照射24 h后,实验组SW480细胞内残存的γ-H2AX foci数量相比于对照组有所增加,表明沉默DDX46可以抑制结肠癌细胞系SW480中辐射引起的DNA损伤的修复。
目前,已知有两种主要的DNA的DSB修复机制:同源重组修复(homologous recombination repair,HRR)和非同源末端连接(nonhomologous end-joining,NHEJ)[34]。在哺乳动物中,DSB修复以NHEJ为主,后者不依赖于模板而通过直接连接DNA末端来修复DSB,主要由DNA蛋白激酶(DNA-protein kinase,DNA-PK)及其信号传导通路在细胞G0/G1期完成[35-36]。
Western blot免疫印迹分析发现,4 Gy X射线照射24 h后,相比于对照组,实验组SW480细胞内ATM的蛋白水平显著升高,而ATM的活性形式p-ATM以及ATM的下游靶蛋白Rad50的蛋白水平则明显降低,同时残存的γ-H2AX的蛋白水平也有一定程度的升高;DNA-PK在两组细胞内的蛋白水平变化不大。这些结果表明沉默DDX46可以通过抑制结肠癌细胞系SW480中ATM的活化,从而抑制辐射诱导的DNA损伤的同源重组修复,提高SW480的辐射敏感性。
近年来,肿瘤放射生物学的发展为研究肿瘤个体化放疗、预测及调控肿瘤细胞的辐射敏感性提供了大量的研究基础[37]。本研究发现,沉默DDX46可以提高结肠癌细胞系SW480的辐射敏感性,其机制可能是沉默DDX46可以通过抑制结肠癌细胞系SW480中ATM的活化,从而抑制辐射诱导的DNA损伤的同源重组修复,提高SW480的辐射敏感性。至于沉默DDX46如何抑制结肠癌细胞系中ATM的活化,还需进一步研究。
利益冲突 本研究接受江苏省2013年度普通高校研究生科研创新计划(CXLX13-824)项目资助,在此对研究的独立性和科学性予以保证作者贡献声明 黄培、钱红英设计研究方案,收集数据后统计并起草论文;孙屏、张熔熔、赵帆在实验显像方面予以大力支持;陈义钢指导、监督实验进行,修改论文
| [1] |
Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013[J]. CA Cancer J Clin, 2013, 63(1): 11-30. DOI:10.3322/caac.21166 |
| [2] |
Brenner H, Kloor M, Pox CP. Colorectal cancer[J]. Lancet, 2014, 383(9927): 1490-1502. DOI:10.1016/S0140-6736(13)61649-9 |
| [3] |
Chen WQ, Zheng RS, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [4] |
项芳芳, 毛高平. 大肠癌与抑癌基因相关性的研究现状[J]. 世界华人消化杂志, 2012, 20(5): 394-398. Xiang FF, Mao GP. Association between colorectal cancer and tumor suppressor genes:recent research progress[J]. WJCD, 2012, 20(5): 394-398. |
| [5] |
Oliveira LA, Artigiani-Neto R, Waisberg DR, et al. NM23 protein expression in colorectal carcinoma using TMA (tissue microarray):association with metastasesand survival[J]. Arq Gastroenterol, 2010, 47(4): 361-367. DOI:10.1590/S0004-28032010000400008 |
| [6] |
Abdelhaleem M, Maltais L, Wain H. The human DDX and DHX gene families of putative RNA helicases[J]. Genomics, 2003, 81(6): 618-622. DOI:10.1115/1.1865222 |
| [7] |
Kosowski TR, Keys HR, Quan TK, et al. DExD/H-box Prp5 protein is in the spliceosome during most of the splicing cycle[J]. RNA, 2009, 15(7): 1345-1362. DOI:10.1261/rna.1065209 |
| [8] |
Hirabayashi R, Hozumi S, Higashijima S, et al. Ddx46 is required for multi-lineage differentiation of hematopoietic stem cells in zebrafish[J]. Stem Cells Dev, 2013, 22(18): 2532-2542. DOI:10.1089/scd.2012.0623 |
| [9] |
Hozumi S, Hirabayashi R, Yoshizawa A, et al. DEAD-box protein Ddx46 is required for the development of the digestive organs and brain in zebrafish[J]. PLoS One, 2012, 7(3): e33675. DOI:10.1371/journal.pone.0033675 |
| [10] |
Li M, Ma Y, Huang P, et al. Lentiviral DDX46 knockdown inhibits growth and induces apoptosis in human colorectal cancer cells[J]. Gene, 2015, 560(2): 237-244. DOI:10.1016/j.gene.2015.02.020 |
| [11] |
Li B, Li YM, He WT, et al. Knockdown of DDX46 inhibits proliferation and induces apoptosis in esophageal squamous cell carcinoma cells[J]. Oncol Rep, 2016, 36(1): 223-230. DOI:10.3892/or.2016.4803 |
| [12] |
Dalbadie-McFarland G, Abelson J. PRP5:a helicase-like protein required for mRNA splicing in yeast[J]. Proc Natl Acad Sci USA, 1990, 87(11): 4236-4240. DOI:10.1073/pnas.87.11.4236 |
| [13] |
Causevic M, Hislop RG, Kernohan NM, et al. Overexpression and poly-ubiquitylation of the DEAD-box RNA helicase p68 in colorectal tumours[J]. Oncogene, 2001, 20(53): 7734-7743. DOI:10.1111/j.1467-8683.2007.00591.x |
| [14] |
Hashimoto K, Nakagawa Y, Morikawa H, et al. Co-overexpression of DEAD box protein rck/p54 and c-myc protein in human colorectal adenomas and the relevance of their expression in cultured celllines[J]. Carcinogenesis, 2001, 22(11): 1965-1970. DOI:10.1093/carcin/22.12.1965 |
| [15] |
Shin S, Rossow KL, Grande JP, et al. Involvement of RNA helicases p68 and p72 in colon cancer[J]. Cancer Res, 2007, 67(16): 7572-7578. DOI:10.1158/0008-5472.CAN-06-4652 |
| [16] |
Huang CL, Liang X, Huang RX, et al. Up-regulation and clinical relevance of novel helicase homologue DHX32 in colorectal cancer[J]. J Exp Clin Cancer Res, 2009, 28: 11. DOI:10.1186/1756-9966-28-11 |
| [17] |
Edge SB, Compton CC. The American Joint Committee on Cancer:the 7th edition of the AJCC cancer staging manual and the future of TNM[J]. Ann Surg Oncol, 2010, 17(6): 1471-1474. DOI:10.1245/s10434-010-0985-4 |
| [18] |
殷蔚伯, 余子豪, 徐国镇, 等. 肿瘤放射治疗学[M]. 北京: 中国协和医科大学出版社出版, 2008, 829-830. Ying WB, Yu ZH, Xu GZ, et al. Tumor radiotherapy[M]. Beijing: Beijing Union Medical University Press, 2008, 829-830. |
| [19] |
Martin NM. DNA repair inhibition and cancer therapy[J]. J Photochem Photobiol B, 2001, 63(1-3): 167-170. DOI:10.5772/20855 |
| [20] |
Goldfarb T, Lichten M. Frequent and efficient use of the sister chromatid for DNA double-strand break repair during budding yeast meiosis[J]. PLoS Biol, 2010, 8(10): e1000520. DOI:10.1371/journal.pbio.1000520 |
| [21] |
Pardo B, Gómez-González B, Aguilera A. DNA repair in mammalian cells:DNA double-strand break repair:how to fix a broken relationship[J]. Cell Mol Life Sci, 2009, 66(6): 1039-1056. DOI:10.1007/s00018-009-8740-3 |
| [22] |
Redon C, Pilch D, Rogakou E, et al. HistoneH2A variants H2AX and H2AZ[J]. Curr Opin Genet Dev, 2002, 12(2): 162-169. DOI:10.1016/S0959-437X(02)00282-4 |
| [23] |
Paull TT, Rogakou EP, Yamazaki V, et al. A critical role for histone H2AX inrecruitment of repair factors to nuclear foci after DNA damage[J]. Curr Biol, 2000, 10(15): 886-895. DOI:10.1016/S0960-9822(00)00610-2 |
| [24] |
Daniel R, Ramcharan J, Rogakou E, et al. Histone H2AX isphosphorylated at sites of retroviral DNA integration but is dispensable forpost integration repair[J]. J Biol Chem, 2004, 279(44): 45810-45814. DOI:10.1074/jbc.M407886200 |
| [25] |
Nowak E, Etienne O, Millet P, et al. Radiation-induced H2AX phosphorylation and neural precursor apoptosis in the developing brain of mice[J]. Radiat Res, 2006, 165(2): 155-164. DOI:10.1667/RR3496.1 |
| [26] |
Falck J, Coates J, Jackson SP. Conserved modes of recruitment of ATM, ATR and DNA-PKcs to sites of DNA damage[J]. Nature, 2005, 434(7033): 605-611. DOI:10.1038/nature03442 |
| [27] |
Yoshida K, Morita T. Control of radio sensitivity of F9 mouse teratocarcinoma cells by regulation of histone H2AX gene expression using a tetracycline turn-off System[J]. Cancer Res, 2004, 64(12): 4131-4136. DOI:10.1158/0008-5472.CAN-03-2566 |
| [28] |
Mahrhofer H, Bürger S, Oppitz U, et al. Radiation induced DNA damage and damage repair in human tumor and fibroblast cell lines assessed by histone H2AX phosphorylation[J]. Int J Radiat Oncol Biol Phys, 2006, 64(2): 573-580. DOI:10.1016/j.ijrobp.2005.09.037 |
| [29] |
Redon CE, Nakamura AJ, Gouliaeva K, et al. Q(γ-H2AX), an analysis method for partial-body radiation exposure using γ-H2AX in nonhuman primate lymphocytes[J]. Radiat Meas, 2011, 46(9): 877-881. DOI: 10.1016/j.radmeas.2011.02.017. 2011, 46(9): 877-881.
|
| [30] |
Kinner A, Wu W, Staudt C, et al. Gamma-H2AX in recognition and signaling of DNA double-strand breaks in the context of chromatin[J]. Nucleic Acids Res, 2008, 36(17): 5678-5694. DOI:10.1093/nar/gkn550 |
| [31] |
Seo J, Kim SC, Lee HS, et al. Genome-wide profiles of H2AX and γ-H2AX differentiate endogenous and exogenous DNA damage hotspots in human cells[J]. Nucleic Acids Res, 2012, 40(13): 5965-5674. DOI:10.1093/nar/gks287 |
| [32] |
Rogakou EP, Boon AC, Redon AC, et al. Mega base chromatin domains involved in DNA double-strand breaks in vivo[J]. Cell Biol, 1999, 146(5): 905-915. DOI:10.1083/jcb.146.5.905 |
| [33] |
An J, Huang YC, Xu QZ, et al. DNA-PKcs plays a dominant role in the regulation of H2AX phosphorylation in response to DNA damage and cell cycle progression[J]. BMC Mol Biol, 2010, 11: 18. DOI:10.1186/1471-2199-11-18 |
| [34] |
Suzuki K, Yamauchi M, Yamashita S. ATM-dependent cellular response to DNA double strand breaks plays a pivotal role in the maintenance of the integrity of the genome[J]. Radiat Prot Dosim, 2011, 143(2-4): 279-283. DOI:10.1093/rpd/ncq533 |
| [35] |
Smith J, Tho LM, Xu N, et al. The ATM-Chk2 and ATR-Chk1 pathways in DNA damage signaling and cancer[J]. Adv Cancer Res, 2010, 108: 73-112. DOI:10.1016/B978-0-12-380888-2.00003-0 |
| [36] |
Alexander A, Walker CL. Differential localization of ATM is correlated with activation of distinct downstream signaling pathways[J]. Cell Cycle, 2010, 9(18): 3685-3686. DOI:10.4161/cc.9.18.13253 |
| [37] |
Abbotts R, Thompson N, Madhusudan S. DNA repair in cancer:emerging targets for personalized therapy[J]. Cancer Manag Res, 2014, 6: 77-92. DOI:10.2147/CMAR.S50497 |
 2018, Vol. 38
2018, Vol. 38


