2. 100142 北京大学肿瘤医院暨北京市肿瘤防治研究所放射治疗科 恶性肿瘤发病机制及转化研究教育部重点实验室
2. Key laboratory of Carcinogenesis and Translational Research(Ministry of Education/Beijing), Department of Radiotherapy, Peking University Cancer Hospital & Institute, Beijing 100142, China
放疗是早期乳腺癌患者保乳术后的主要治疗方式,保乳术后进行放疗可将局部复发率降低2/3[1-2]。随着治疗技术的进步,早期乳腺癌患者保乳术加放疗后生存期也显著提高。但是放疗后辐射致二次癌症的风险也是一个不容忽视的重要问题,尤其是对于生存期长的早期乳腺癌患者[3-4]。常规加速器中,射线经均整后用于临床治疗。均整器的存在损失了大部分初始光子并产生大量散射线;无均整模式(FFF)时均整器移除,机头散射明显降低,射束中粒子通量显著提高,可缩短治疗时间,提高治疗效率[5-7]。本研究回顾性地将均整模式(FF)和无均整模式下固定野两野动态调强技术(d-IMRT)应用于40岁以下早期、左侧乳腺癌保乳术后患者的治疗计划制定,并通过模型对这两种放疗技术的辐射致癌风险进行比较。
资料与方法1.病例选取:回顾性分析北京大学肿瘤医院接受保乳术后放疗的早期、左侧乳腺癌患者20例,其中,0期4例(新辅助化疗后),Ⅰ期12例,ⅡA期4例。患者年龄23~40岁,中位年龄34岁。
2.体位固定及CT扫描:患者在乳腺托架上采用仰卧、左臂上抬体位,并在平静呼吸状态下,应用德国西门子公司大孔径Somatom Sensation Open CT进行定位扫描,扫描层厚为5 mm,扫描范围从环甲膜水平至膈下以包括双侧乳腺和全肺。
3.靶区及危及器官勾画:在放射治疗计划系统(TPS,Eclipse 13.5, Varian Medical Systems)勾画靶区,临床靶区(CTV)包括全部左侧乳腺,前界为皮下5 mm,后界紧贴胸肌前缘,内界不超体中线,外界不超腋中线。将CTV向皮侧外放3 mm,其他方向分别外放5 mm边界为计划靶区(PTV)。同时,勾画出右侧乳腺、双肺、甲状腺、肝脏等危及器官。
4.计划设计:采用TPS进行固定野动态调强放射治疗计划设计,能量分别选择TrueBeam加速器(美国,Varian公司)的6 MV和6 MV FFF X射线。以PTV为参考体积,射野角度采用切线2野照射方式,400 MU/min,剂量计算采用Acuros XB算法。在保证95%的PTV达到处方剂量46 Gy的情况下,危及器官的剂量限制:同侧肺V20 < 20%,V5 < 50%;心脏V30 < 10%,V40 < 5%。FFF模式下的治疗计划优化参数与FF模式下治疗计划的优化参数一致,因此为满足95%的PTV达到处方剂量46 Gy的要求,需要对计划进行剂量归一。
5.不同组织和器官发生二次癌症的风险评估:对通过验证的患者计划分别读取甲状腺、右侧乳腺、肺、肝脏等组织、器官的受照剂量和相应剂量的照射体积。利用基于器官当量剂量(OED)的辐射致癌风险模型分别对不同方式的治疗计划中,右侧乳腺、肺、肝脏等器官的辐射致癌超额绝对风险(excess absolute risk, EAR)进行风险评估[8-9]:
| $ {\rm{EAR}} = {\beta _{\rm{o}}}{\rm{OED}}e{^{\left[{{\gamma _{\rm{e}}}\left( {e-30} \right) + {\gamma _{\rm{a}}}\ln \left( {\frac{a}{{70}}} \right)} \right]}} $ | (1) |
式中,βo是西方人群辐射致癌的剂量-响应曲线的初始斜率;γe和γa是不同年龄结构的修正参数;βo、γe和γa来源于参考文献[8-10];e是患者在放射治疗期间的年龄;a是患者的到达年龄,本研究中所有患者,a =70岁。
OED直接与二次癌症风险的大小有关,其值可以通过线性模型(LM)、机制模型(MM)、Plateau模型(PM)或者Bell模型(BM)计算得到[8-9]。本研究中,射野外组织器官的OED用LM得到:
| $ {\rm{OED}} = \frac{1}{{{V_{\rm{o}}}}}\mathop \sum \limits_i {V_{{D_i}}}{D_i} $ | (2) |
射野边界以及射野内组织器官的OED用Schneider MM计算得到:
| $ \begin{array}{l} {\rm{OE}}{{\rm{D}}_{{\rm{MM}}}} = \frac{1}{{{V_{\rm{o}}}}}\sum\limits_i {{V_{{D_i}}}\frac{{e\left( {- \alpha {'_i}{D_i}} \right)}}{{\alpha {'_i}R}}} \\ [1-2R + {R^2}{e^{\left( {-\alpha {'_i}{D_i}} \right)}}-\left( {1 - R} \right){e^{\left( { - \frac{{\alpha {'_i}R}}{{1 - R}}{D_i}} \right)}}] \end{array} $ | (3) |
式中,VDi是吸收辐射剂量为Di的器官体积,cm3;Vo 是由CT图像勾画出的整个器官的体积,cm3;R是每个感兴趣器官的细胞再增值参数。α′i表示由细胞杀伤造成的细胞减少:
当公式(3)中的R=1时,即假设分次放疗后存在组织完全修复时,射野边界以及射野内组织器官的OED由(4)式得到,此模型称为Plateau模型:
| $ {\rm{CD}}{{\rm{E}}_{{\rm{PM}}}} = \frac{1}{{{V_{{o}}}}}\sum\limits_i {{V_{{D_i}}}\frac{{1-{e^{\left( {-\alpha {'_i}{D_i}} \right)}}}}{{\alpha {'_i}}}} $ | (4) |
当公式(3)中的R=0时,即假设分次放疗后没有组织修复时,射野边界以及射野内组织器官的OED由(5)式得到,此模型称为Bell模型:
| $ {\rm{OE}}{{\rm{D}}_{{\rm{BM}}}} = \frac{1}{{{V_{{o}}}}}\sum\limits_i {{V_{{D_i}}}{D_i}{e^{\left( {-\alpha {'_i}{D_i}} \right)}}} $ | (5) |
6.统计学处理:采用SPSS 19.0软件进行处理,当数据呈正态分布时,结果采用x±s形式表示,并采用独立样本t检验进行分析;当数据非正态分布时,采用Wilcoxon非参数检验方法进行分析。P < 0.05为差异有统计学意义。
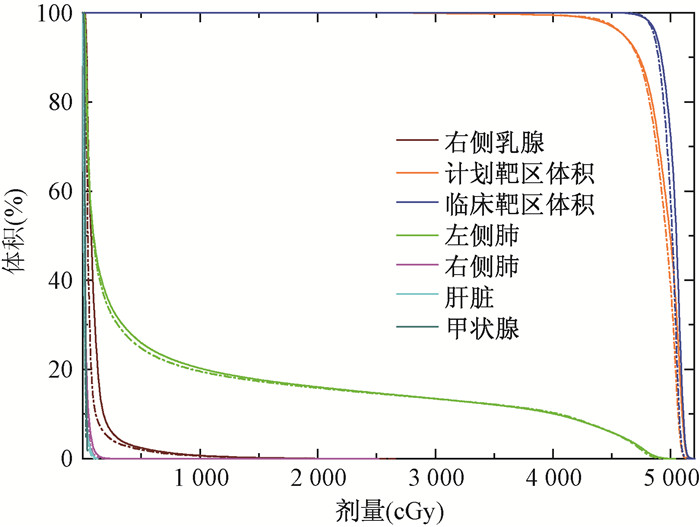
结果1.两种计划的剂量-体积直方图(DVH)比较:由图 1可知,在95%的PTV、CTV满足处方剂量46 Gy的情况下,FFF模式治疗计划中右侧乳腺、患侧肺等器官的低剂量区优于FF模式下的治疗计划。FFF模式治疗计划中靶区内高剂量区要低于FF模式计划中相应值。
|
图 1 6 MV有无均整器模式下DVH图比较 注:实线为均整模式;虚线为无均整模式 Figure 1 Comparison of DVH between flattening filter and flattening filter free plans at 6 MV |
2.由不同模型计算得到的不同组织器官的OED值:结果见表 1。FFF模式下计划中右侧乳腺、肺、甲状腺、肝脏等器官的OED均小于FF模式下计划中的相应值,差异有统计学意义(t=2.18~9.72,P < 0.05)。尤其对右侧乳腺,FFF模式下的计划能明显降低其OED。从总体结果来看,无论是FFF模式还是FF模式,右侧乳腺和左侧肺的OED要明显高于其他器官。
|
|
表 1 不同组织器官的OED值(cGy,x±s) Table 1 The OED values for different organs (cGy, x±s) |
3.采用不同OED模型得到两种能量模式下不同组织器官的EAR:结果见表 2。FFF模式下计划中右侧乳腺、肺、甲状腺、肝脏等器官的EAR均小于FF模式下计划中的相应值,差异有统计学意义(t=2.11~9.99, P < 0.05)。尤其对右侧乳腺,FFF模式下的计划能明显降低该器官EAR。
|
|
表 2 不同OED计算模型和能量模式下各个组织器官的EAR (10-4·人年-1) Table 2 The EAR values for different organs in different energy modes and OED calculation models (10-4·PY-1) |
讨论
近年来,随着放射治疗技术的进步,调强放射治疗技术在临床中得到日益广泛地应用。与常规放射治疗技术和三维适形放疗技术相比,调强技术可以进一步提高肿瘤患者靶区的剂量适形度,减少正常器官的不良反应,提高肿瘤治愈率以及延长患者的生存期[11-12]。但是,这些新技术会造成靶区外散射剂量的增加,从而增加了患者放疗后辐射致癌风险[13-15]。Lee等[16]借助人体仿真模体,分别用光致发光剂量计测量了野中野3D-CRT、5野IMRT以及容积旋转调强放疗(VMAT)等技术治疗时,右侧乳腺、肺、甲状腺等器官的剂量,进而用BEIR Ⅶ模型评估了相应技术的辐射致癌风险。研究结果表明,采用野中野3D-CRT技术,甲状腺、右侧乳腺和患侧肺等器官的终生归因风险要远小于采用5野IMRT和VMAT技术。
本研究主要针对目前乳腺癌放疗最常用的两野d-IMRT技术进行展开,研究相同优化参数和射野条件时6 MV、6 MV FFF两种能量模式下的辐射致癌风险。常规加速器中,均整器的存在损失了大部分初始光子并产生大量散射线;FFF模式下机头散射明显降低,射束中粒子通量显著提高,剂量率明显增加,可缩短治疗时间,进一步提高治疗效率[5-7]。由于乳腺癌患者放疗过程中仰卧于乳腺托架上,没有其他固定装置,因此,采用FFF模式高剂量率治疗,可以缩短治疗时间,进一步保证患者治疗过程中的体位一致性。同时,由于FFF模式下均整器移除,机头散射线明显减少,可以降低患者所受低剂量照射[5-7]。本研究的结果表明,相同优化参数和射野条件时6 MV、6 MV FFF两种能量模式均能满足临床中早期乳腺癌患者IMRT治疗计划要求。对左侧乳腺癌患者采用FFF模式放疗后右侧乳腺、肺、甲状腺、肝脏等器官的辐射致癌风险要低于FF模式下的相应值。从模型计算得到的结果来看,无论是FFF模式还是均整模式下,右侧乳腺和左侧肺的OED要明显高于其他组织和器官的相应值,因此制定治疗计划时,在保证靶区受到处方剂量照射的情况下,要通过治疗计划的优化设计,尽可能地减少右侧乳腺和左侧肺等器官的受照剂量,以降低其辐射致癌风险。
本研究中的模型参数主要基于日本原爆幸存者的寿命研究和Hodgkin淋巴瘤放疗患者的队列研究[8-10],由于人群的转移,将这些模型应用于我国癌症患者放疗后辐射致二次癌症风险评估存在一定的偏差,需要在今后结合辐射流行病学的研究进行相应修正;其次,如将FFF高剂量率模式用于乳腺癌患者的放疗,其产生的临床效果与常规剂量率产生的临床效果还有待进一步验证;另外,在评估不同放疗技术辐射致癌风险的同时,还要考虑该技术的临床治疗效果以及相应的剂量分布产生的不良反应等,否则容易以偏概全,给临床中治疗方式的选择带来误导。
利益冲突 本人与本人家属、其他研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 冯仲苏负责设计研究方案,收集数据后统计并起草文章;吴昊、程金生、孙全富负责指导、监督科研工作进行和文章修改;铁剑负责靶区勾画和计划的临床实用性评估
| [1] |
Veronesi U, Cascinelli N, Mariani L, et al. Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer[J]. N Engl J Med, 2002, 347(16): 1227-1232. DOI:10.1056/NEJMoa020989 |
| [2] |
Early Breast Cancer Trialists' Collaborative Group. Favourable and unfavourable effects on long-term survival of radiotherapy for early breast cancer:an overview of the randomised trials[J]. Lancet, 2000, 355(9217): 1757-1770. DOI:10.1016/S0140-6736(00)02263-7 |
| [3] |
Hall EJ, Wuu CS. Radiation-induced second cancers:the impact of 3D-CRT and IMRT[J]. Int J Radiat Oncol Biol Phys, 2003, 56(1): 83-88. DOI:10.1016/S0360-3016(03)00073-7 |
| [4] |
Hall EJ. Intensity-modulated radiation therapy, protons, and the risk of second cancers[J]. Int J Radiat Oncol Biol Phys, 2006, 65(1): 1-7. DOI:10.1016/j.ijrobp.2006.01.027 |
| [5] |
Fu W, Dai J, Hu Y, et al. Delivery time comparison for intensity-modulated radiation therapy with/without flattening filter:a planning study[J]. Phys Med Biol, 2004, 49(8): 1535-1547. DOI:10.1088/0031-9155/49/8/011 |
| [6] |
Vassiliev ON, Titt U, Pönisch F, et al. Dosimetric properties of photon beams from a flattening filter free clinical accelerator[J]. Phys Med Biol, 2006, 51(7): 1907-1917. DOI:10.1088/0031-9155/51/7/019 |
| [7] |
Salter BJ, Sarkar V, Wang B, et al. Rotational IMRT delivery using a digital linear accelerator in very high dose rate 'burst mode'[J]. Phys Med Biol, 2011, 56(7): 1931-1946. DOI:10.1088/0031-9155/56/7/002 |
| [8] |
Schneider U. Mechanistic model of radiation-induced cancer after fractionated radiotherapy using the linear-quadratic formula[J]. Med Phys, 2009, 36(4): 1138-1143. DOI:10.1118/1.3089792 |
| [9] |
Schneider U, Sumila M, Robotka J. Site-specific dose-response relationships for cancer induction from the combined Japanese A-bomb and Hodgkin cohorts for doses relevant to radiotherapy[J]. Theor Biol Med Model, 2011, 8: 27. DOI:10.1186/1742-4682-8-27 |
| [10] |
Murray L, Sethugavalar B, Robertshaw H, et al. Involved node, site, field and residual volume radiotherapy for lymphoma:a comparison of organ at risk dosimetry and second malignancy risks[J]. Clin Oncol (R Coll Radiol), 2015, 27(7): 401-410. DOI:10.1016/j.clon.2015.03.005 |
| [11] |
Verhey LJ. Comparison of three-dimensional conformal radiation therapy and intensity-modulated radiation therapy systems[J]. Semin Radiat Oncol, 1999, 9(1): 78-98. DOI:10.1016/S1053-4296(99)80056-3 |
| [12] |
Haertl PM, Pohl F, Weidner K, et al. Treatment of left sided breast cancer for a patient with funnel chest:volumetric-modulated arc therapy vs. 3D-CRT and intensity-modulated radiotherapy[J]. Med Dosim, 2013, 38(1): 1-4. DOI:10.1016/j.meddos.2012.04.003 |
| [13] |
Kry SF, Salehpour M, Followill DS, et al. Out-of-field photon and neutron dose equivalents from step-and-shoot intensity-modulated radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2005, 62(4): 1204-1216. DOI:10.1016/j.ijrobp.2004.12.091 |
| [14] |
Becker SJ, Elliston C, Dewyngaert K, et al. Breast radiotherapy in the prone position primarily reduces the maximum out-of-field measured dose to the ipsilateral lung[J]. Med Phys, 2012, 39(5): 2417-2423. DOI:10.1118/1.3700402 |
| [15] |
Kourinou KM, Mazonakis M, Lyraraki E, et al. Scattered dose to radiosensitive organs and associated risk for cancer development from head and neck radiotherapy in pediatric patients[J]. Phys Med, 2013, 29(6): 650-655. DOI:10.1016/j.ejmp.2012.08.001 |
| [16] |
Lee B, Lee S, Sung J, et al. Radiotherapy-induced secondary cancer risk for breast cancer:3D conformal therapy versus IMRT versus VMAT[J]. J Radiol Prot, 2014, 34(2): 325-331. DOI:10.1088/0952-4746/34/2/325 |
 2018, Vol. 38
2018, Vol. 38


