2. 310022 杭州, 浙江省肿瘤医院放疗科;
3. 310022 杭州, 浙江省肿瘤医院胸外科
2. Department of Radiation Oncology, Zhejiang Cancer Hospital, Hangzhou 310022, China;
3. Department of Thoracic Surgery, Zhejiang Cancer Hospital, Hangzhou 310022, China
食管鳞癌是中国常见的消化道恶性肿瘤,预后差。放化疗(chemoradiotherapy,CRT)和手术是局部晚期食管鳞癌患者的主要治疗方法,但疗效不佳,5年生存率不足30%[1]。
为进一步提高治疗疗效,术前新辅助放化疗(卡铂联合紫杉醇)较单纯手术能显著改善可手术食管癌或食管-胃交界癌患者总生存(overall survival,OS)和无进展生存(progression-free survival,PFS)[2],降低患者3年死亡率和局部复发率[3-4]。回顾性研究提示手术联合术后CRT也能使患者生存获益,但到目前尚无前瞻性随机临床试验证实[5]。也有临床试验显示新辅助CRT联合手术并未使OS获益[6-7],尤其是对新辅助CRT后疾病缓解的局部晚期食管鳞癌患者[7]。因此,对于局部晚期食管鳞癌的最佳治疗模式至今尚不明确。
本研究旨在探讨局部晚期可手术食管鳞癌患者的最佳治疗方案,明确三联疗法是否可减少肿瘤的局部复发并延长患者生存。同时探究可能影响患者生存和复发的其他因素。
资料与方法1.临床资料:收集2011年4月—2015年11月连续在浙江省肿瘤医院接受手术+术前/术后CRT或根治性CRT的局部晚期可手术(cT3及潜在可手术的cT4或N+)的食管鳞癌患者。纳入标准:年龄在18~75岁; 东部肿瘤协作组(ECOG)/世界卫生组织(WHO)的体力状态(PS)评分小于2分; 体重下降 < 10%。排除标准:颈段食管癌; 食管癌为第二原发或继发性恶性肿瘤。部分患者来自一项新辅助CRT联合手术对比手术联合辅助CRT的随机临床试验即ZTOG1201研究(NCT01463501)。共纳入了124例患者,根据治疗方法的不同分为三联疗法组54例(43.5%),根治性放化疗组70例(56.5%)。总中位年龄为60岁(41~75岁),三联疗法组的中位年龄为59岁,范围为43~71岁;根治性CRT组患者的中位年龄为61岁,范围为41~75岁,两组没有统计学差异(P>0.05)。患者临床病理特征见表 1。
|
|
表 1 124例食管癌患者临床病理特征资料 Table 1 The clinicopathological characteristics of 124 patients with squamous cell carcinoma of esophagus |
2.化疗:①三联疗法组(患者来自于ZTOG1201研究):患者先接受紫杉醇(50 mg/m2)联合卡铂(2 mg·ml-1·min-1)每周方案化疗,于第1、8、15、22、29和36天静脉注射,与术前放射治疗同步进行;或者,患者先行手术,术后予紫杉醇(150 mg/m2)联合卡铂(5 mg·ml-1·min-1)化疗2周期,再序贯行术后辅助放疗。②根治性放化疗组:紫杉醇(50 mg/m2)联合卡铂(AUC 2 mg·ml-1·min-1)每周方案化疗,于第1、8、15、22、29和36天静脉注射,与根治性放射治疗同步进行。
3.放射治疗:所有患者均采用调强放疗技术,用美国瓦里安23EX医用直线加速器进行常规外照射,放疗靶区包括肿瘤原发灶及受累淋巴结,根据定位CT勾画大体肿瘤体积(GTV)。计划靶区(PTV)在GTV的基础上在上下方向外扩3.5 cm,食管前后左右方向外扩1.0 cm。处方剂量要求包绕95%的PTV体积,术前患者放疗剂量为41.4~50.4 Gy,术后患者放疗剂量为45~50.4 Gy,根治性放化疗患者放疗剂量为50~64.8 Gy。
4.手术方法:允许行微创食管切除术(minimally invasive esophagectomy,MIE)或开胸食管切除术(open esophagectomy,OE),包括Lvor lewis术或Mckeown术。外科医师根据肿瘤位置和患者情况决定手术方案,并对包括腹腔淋巴结在内的N1淋巴结进行清扫。
5.肿瘤复发评估:包括局部和远处复发。局部复发包括肿瘤原发灶和区域淋巴结复发。远处复发包括非区域淋巴结复发、全身转移、恶性胸水或腹腔转移等。
6.统计学处理:采用SPSS 22.0软件进行数据分析,计数资料采用χ2检验。用Kaplan-Meier曲线绘制生存曲线,Log-rank检验分析曲线之间差异。Cox回归(单因素和多因素)评估危险因素(年龄、性别、ECOG/WHO评分,肿瘤位置,T分期,N分期)对患者生存的影响,结果以风险比(Hazard Ratio,HR)和95%可信区间(CI)表示。以P<0.05为差异有统计学意义。
结果1.复发分析:所有患者中位随访时间24个月(5~49个月),三联疗法组24.1%(13/54)患者出现复发,根治性放化疗组52.9%(37/70)患者出现复发,两组复发率有统计学意义(χ2=10.495,P<0.05)。局部区域和远处复发率三联疗法组为18.5%(10/54)和11.1%(6/54),根治性放化疗组分别为35.7%(25/70)和20.0%(14/70),两组比较局部区域复发差异有统计学意义(χ2=4.445,P<0.05),远处复发差异无统计学意义(P>0.05)。
2.复发相关因素分析:Cox单因素分析显示年龄 < 60岁和接受根治性CRT是食管鳞癌患者局部区域复发的危险因素,年龄 < 60岁的HR为1.799,(95%CI:1.029~3.145,P<0.05);接受根治性CRT的复发风险是接受三联疗法的1.672倍(95%CI:1.219~2.294,P<0.05),而性别、PS评分、肿瘤位置、T分期、N分期均不是食管鳞癌患者局部区域复发的相关因素。多因素分析结果与单因素分析结果一致,年龄 < 60岁的HR为2.301,(95%CI:1.292~4.097,P<0.05),接受根治性CRT的HR为1.916,(95%CI:1.383~2.652,P<0.05)。
3. PFS分析:三联疗法组3年PFS显著高于根治性放化疗组,分别为65.3%(95% CI 50.7~80.5)和31.9%(95% CI 19.6~44.2%;P<0.05)。两组PFS、局部区域PFS和远处PFS生存曲线见图 1。三联疗法组局部区域PFS为77.4%(95% CI 64.7~90.1),明显高于根治性放化疗组54.5%(95% CI 41.0~67.2;P<0.05)。远处PFS方面三联疗法虽高于根治性放化疗组,差异无统计学意义(P>0.05)。
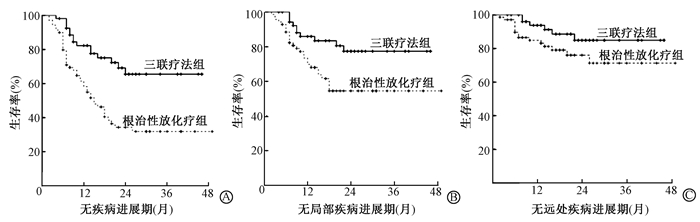
|
图 1 124例食管鳞癌两组3年无疾病进展生存期分析 A.总无进展生存(P<0.05); B.局部区域无进展生存(P<0.05);C.远处无进展生存 Figure 1 Kaplan-Meier curve of 3-year PFS in 124 patients with squamous cell carcinoma of esophagus A.Overall PFS(P < 0.05); B.Local-regional PFS(P < 0.05); C. Distance metastasis PFS |
4. OS分析:三联疗法也具有更好的OS,3年OS率为66.3%(95% CI 43.0~89.6),尚未达到中位时间,而根治性放疗组3年OS率仅为34.4%(95% CI 21.1~47.7),中位OS为21.0个月,两组有统计学意义(P<0.05),见图 2。此外,治疗相关死亡率两组差异无统计学意义(P>0.05)。
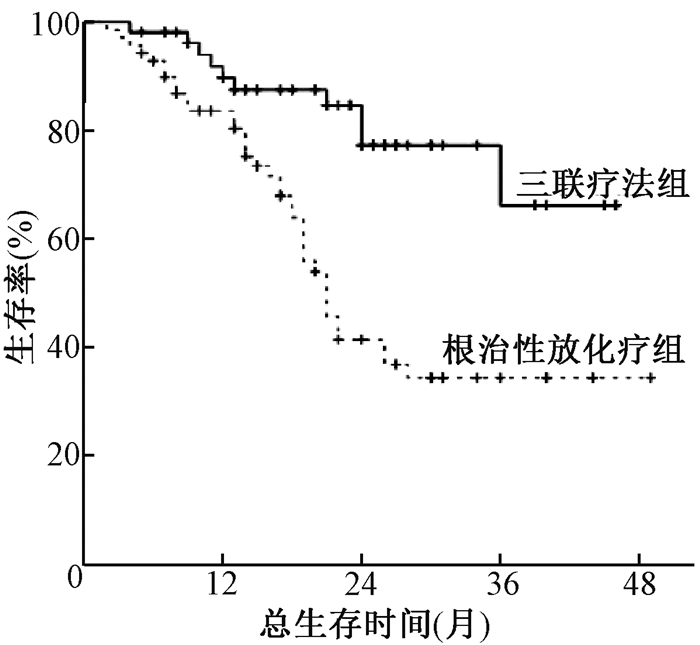
|
图 2 124例食管鳞癌患者接受三联疗法和根治性放化疗3年生存分析 注:两组比较P<0.05 Figure 2 Kaplan-Meier curve of 3-year OS in trimodality therapy and CRT alone group in 124 patients with squamous cell carcinoma of esophagus |
5.不同放疗剂量下生存分析:根治性放化疗组中,37.1%患者(26/70)接受50~50.4 Gy的放疗剂量,62.9%患者(44/70)接受>54 Gy的放疗剂量。亚组分析显示,50~50.4 Gy的患者中位OS为19个月(95% CI:8.2~29.8),3年OS率为39.9%(95% CI 18.5~61.3);而接受>54 Gy放疗剂量患者中位OS为21.0个月(95% CI 19.3~22.7),3年OS率为31.5%(95% CI 14.8~48.2),两组比较差异无统计学意义(P>0.05)。多因素分析显示增加放疗剂量与OS无相关性,年龄 < 60岁可能是影响患者预后的因素,但差异无统计学意义(P>0.05)。
讨论本研究结果显示,相比根治性放化治疗,放化疗联合手术的治疗模式能够显著降低肿瘤局部复发率,并显著延长患者PFS和OS,而治疗相关死亡与根治性放化疗组相似。这与CROSS研究新辅助CRT组的结果相似[2]。
手术是可切除食管癌患者的主要治疗手段。在放化疗剂量达到新辅助治疗标准后,联合手术能够效改善患者预后。美国国家癌症数据库数据显示三联疗法和根治性放化疗法中位OS和3年OS分别为35.6和16.8个月、49.6%和26.8%,三联疗法显著高于根治性放化疗法[8]。Stahl等[6]对172例食管鳞癌患者进行诱导化疗联合同步放化疗+手术或诱导化疗联合同步CRT的随机对照研究,结果显示联合手术组在2年PFS方面优于未联合手术组(64.3% vs. 40.7%),但两组3年OS率比较差异无统计学意义(31% vs. 24%)。而FFCD9102试验的结果则显示CRT联合手术并未提高疗效,尤其是对CRT后疾病有缓解的局部晚期食管鳞癌患者[7]。但该试验结果可能受不合理研究设计的影响,研究者在分析FFCD9102 Ⅲ期临床试验未入随机组的患者结果时发现CRT后缓解患者与CRT治疗失败后行挽救性手术的患者在OS并上差异无统计学意义[9]。此外,近期一项比较单纯手术与术前CRT完全缓解食管癌患者预后的前瞻性研究也显示手术切除与低复发率(32.7% vs. 50.8%;P=0.021)和较好的中位OS有相关性[10]。另一项单中心临床试验也报道了类似的结果,完成CRT和手术的患者对比根治性CRT患者有更好的局部控制率,5年局控率分别为82%和60%(P<0.001)[11]。
根据美国国家癌症网(NCCN)指南推荐术前、术后及根治性放疗的剂量范围分别为41.4~50.4 Gy、45~50.4 Gy和50~50.4 Gy[12]。本研究结果显示,对比>50.4 Gy和50~50.4 Gy,放疗剂量增加并没有使患者生存显著获益。RTOG8501试验显示接受总剂量50 Gy的CRT患者5年OS为26%,而接受总剂量64 Gy的CRT患者为0%[13]。由于根治性CRT的低OS和高局部失败率,INT 0123试验将接受相同化疗方案化疗的患者随机分为50.4和64.8 Gy放疗剂量放疗进行对比分析,中期分析显示2年中位OS(13 vs. 18.1个月)和局部区域失败率(56% vs. 52%)在标准放疗组和高剂量放疗组没有明显差异[14]。本研究与上述报道结果相似,无论是三联疗法或者根治性CRT,放疗剂量增加到50 Gy以上与OS和复发没有显著相关性。本研究结果提示根治性CRT不能代替手术在局部晚期食管鳞癌中的治疗作用,即使增加放疗剂量。
本项研究尚存在一些不足之处。首先,对于食管鳞癌的回顾性研究,本研究存在患者选择偏倚且缺乏意向性分析。虽然两组的临床特征无显著差异,放化疗组患者的年龄较高、T分期偏晚、淋巴结转移率偏高等,这些因素都可能影响到最终患者的生存。其次,对于CRT完全缓解的患者,手术治疗是否有价值尚不明确;再次,关于放疗剂量,基于回顾性研究的特性,本研究无法对不同放疗剂量照射的患者特点进行细分,故最佳放疗剂量仍有待于临床研究证实。另外,本研究没有分析接受根治性CRT后实行挽救性手术治疗患者(如挽救性食管癌切除术)的结果,建议开展相关临床研究,以明确其价值,荷兰正在进行一项Ⅲ期临床试验preNANO研究,分析术前CRT联合挽救性食管切除术的疗效(NTR4834),结果值得关注。未来的分子生物学技术可能会有助于对不同患者进行分层,根据患者的分子生物学特征区分和明确可能受益于手术治疗的患者,从而改善食管鳞癌患者总体生存[15-18]。
综上所述,对于可手术局部晚期食管鳞癌,手术联合CRT有更好的局部控制率、PFS和OS。即使增加放疗剂量,手术的作用仍不能被单纯CRT所代替。
利益冲突 无作者贡献声明 蒋晨雪、陈武成负责统计数据、起草论文;韩水云、朱湘负责采集数据、整理资料和论文修改;孙晓江、许亚萍负责对整个研究设计和监督;陈奇勋、毛伟敏指导论文写作和部分论文修改
| [1] |
祝淑钗, 宋长亮, 沈文斌, 等. 食管癌根治性切除术后患者预后的影响因素分析[J]. 中华肿瘤杂志, 2012, 34(4): 281-286. Zhu SC, Song CL, Shen WB, et al. Prognostic analysis of clinicopathological factors in patients after radical resection of esophageal carcinoma[J]. Chin J Oncol, 2012, 34(4): 281-286. DOI:10.3760/cma.j.issn.0253-3766.2012.04.010 |
| [2] |
van Hagen PC, Hulshof M, van Lanschot JJ, et al. Preoperative chemoradiotherapy for esophageal or junctional cancer[J]. N Engl J Med, 2012, 366(22): 2074-2084. DOI:10.1056/NEJMoa1112088 |
| [3] |
Urschel J D, Vasan H. A meta-analysis of randomized controlled trials that compared neoadjuvant chemoradiation and surgery to surgery alone for resectable esophageal cancer[J]. Am J Surg, 2003, 185(6): 538-543. DOI:10.1016/S0002-9610(03)00066-7 |
| [4] |
Fiorica F, di Bona D, Schepis F, et al. Preoperative chemoradiotherapy for oesophageal cancer:a systematic review and meta-analysis[J]. Gut, 2004, 53(7): 925-930. DOI:10.1136/gut.2003.025080 |
| [5] |
Xu Y, Chen Q, Yu X, et al. Factors influencing the risk of recurrence in patients with esophageal carcinoma treated with surgery:a single institution analysis consisting of 1002 cases[J]. Oncol Lett, 2013, 5(1): 185-190. DOI:10.3892/ol.2012.1007 |
| [6] |
Stahl M, Stuschke M, Lehmann N, et al. Chemoradiation with and without surgery in patients with locally advanced squamous cell carcinoma of the esophagus[J]. J Clin Oncol, 2005, 23(10): 2310-2317. DOI:10.1200/JCO.2005.00.034 |
| [7] |
Bedenne L, Michel P, Bouché O, et al. Chemoradiation followed by surgery compared with chemoradiation alone in squamous cancer of the esophagus:FFCD 9102[J]. J Clin Oncol, 2007, 25(10): 1160-1168. DOI:10.1200/JCO.2005.04.7118 |
| [8] |
Shao MS, Wong AT, Schwartz D, et al. Definitive or preoperative chemoradiation therapy for esophageal cancer:patterns of care and survival outcomes[J]. Ann Thorac Surg, 2016, 101(6): 2148-2154. DOI:10.1016/j.athoracsur.2015.12.056 |
| [9] |
Vincent J, Mariette C, Pezet D, et al. Early surgery for failure after chemoradiation in operable thoracic oesophageal cancer. Analysis of the non-randomised patients in FFCD 9102 phase Ⅲ trial: chemoradiation followed by surgery versus chemoradiation alone[J]. Eur J Cancer, 2015, 51(13): 1683-1693. DOI: 10.1016/j.ejca.2015.05.027.
|
| [10] |
Piessen G, Messager M, Mirabel X, et al. Is there a role for surgery for patients with a complete clinical response after chemoradiation for esophageal cancer? An intention-to-treat case-control study[J]. Ann Surg, 2013, 258(5): 793-799; discussion 799-800. DOI: 10.1097/SLA.0000000000000228.
|
| [11] |
Sio TT, Wilson ZC, Stauder MC, et al. Long-term treatment outcomes for locally advanced esophageal cancer:a single-institution experience[J]. Am J Clin Oncol, 2016, 39(5): 448-452. DOI:10.1097/COC.0000000000000089 |
| [12] |
Ajani JA, D'amico TA, Almhanna K, et al. Esophageal and esophagogastric junction cancers, version 1.2015[J]. J Natl Compr Canc Netw, 2015, 13(2): 194-227. DOI:10.6004/jnccn.2015.0028 |
| [13] |
Bendell JC, Meluch A, Peyton J, et al. A phase Ⅱ trial of preoperative concurrent chemotherapy/radiation therapy plus bevacizumab/erlotinib in the treatment of localized esophageal cancer[J]. Clin Adv Hematol Oncol:H&O, 2012, 10(7): 430-437. |
| [14] |
Minsky BD, Pajak TF, Ginsberg RJ, et al. INT 0123(Radiation Therapy Oncology Group 94-05) phase Ⅲ trial of combined-modality therapy for esophageal cancer:high-dose versus standard-dose radiation therapy[J]. J Clin Oncol, 2002, 20(5): 1167-1174. DOI:10.1200/JCO.2002.20.5.1167 |
| [15] |
Tu CC, Hsu P-K, Chien LI, et al. Prognostic histological factors in patients with esophageal squamous cell carcinoma after preoperative chemoradiation followed by surgery[J]. BMC cancer, 2017, 17(1): 62. DOI:10.1186/s12885-017-3063-5 |
| [16] |
Tao CJ, Lin G, Xu YP, et al. Predicting the response of neoadjuvant therapy for patients with esophageal carcinoma:an in-depth literature review[J]. J Cancer, 2015, 6(11): 1179-1186. DOI:10.7150/jca.12346 |
| [17] |
Hamai Y, Hihara J, Emi M, et al. Ability of fluorine-18 fluorodeoxyglucose positron emission tomography to predict outcomes of neoadjuvant chemoradiotherapy followed by surgical treatment for esophageal squamous cell carcinoma[J]. Ann Thorac Surg, 2016, 102(4): 1132-1139. DOI:10.1016/j.athoracsur.2016.04.011 |
| [18] |
Shen LY, Wang H, Dong B, et al. Possible prediction of the response of esophageal squamous cell carcinoma to neoadjuvant chemotherapy based on gene expression profiling[J]. Oncotarget, 2016, 7(4): 4531-4541. DOI:10.18632/oncotarget.6554 |
 2018, Vol. 38
2018, Vol. 38


