2. 518036 深圳, 北京大学深圳医院肿瘤放疗科
2. Department of Radiation Oncology, Peking University Shenzhen Hospital, Shenzhen 518036, China
目前乳腺癌保乳术后辅助放疗已成为早期乳腺癌主要治疗模式[1],但却明显增加患者特别是左侧乳腺癌患者缺血性心脏病的发病率和死亡率[2-3]。Darby等[3]发现,乳腺癌放疗后冠状动脉事件风险与心脏受照平均剂量呈线性相关,剂量每增加1 Gy,发病风险增加7.4%,没有阈值,且这种风险随放疗后生存时间的延长持续增加至放疗后20年。甚至有更长的随访研究发现,乳腺癌放疗后心脏损伤风险在放疗30年后将更高[4]。依据美国1973—2008年检测、流行病学和最终结果(SEER)数据库,Henson等[4]发现1973—1982年接受放疗的乳腺癌患者,随生存期的延长,左侧乳腺癌比右侧乳腺癌放疗心脏病死亡率明显增加,而1982年以后这种差异明显降低。该研究提示,出现这种差异的主要原因是1982年以前内乳淋巴结区受照率高达62%,而1982年以后内乳区受照率仅1%。因此,对于靶区包括内乳淋巴结区的左侧乳腺癌放疗,降低心脏受照剂量成为极大挑战。乳腺癌放疗后心脏放射损伤的研究早期大多关注心脏的剂量[5-6],随着越来越认识到放射线心脏损伤的主要发生机制是微血管和冠状动脉大血管病变[7],近来相继有研究报道冠状动脉前降支(left anterior descending coronary artery,LAD)的受照剂量[8-9]。本研究对左侧乳腺癌保乳术后患者行国内鲜有报道的切向50°双弧容积弧形调强放疗VMAT(T-VMAT)技术,通过与目前乳腺癌放疗常用的传统的加楔形板切线野(W-TF)技术和6野IMRT(6F-IMRT)技术比较的剂量学优势,评价T-VMAT对心脏和LAD的保护作用。
资料与方法1.病例选择:选择2016年8月至2017年7月在深圳市人民医院行左侧乳腺癌保乳术后放疗患者15例,均为女性。术后病理分期ⅡA~ⅢA期,患者年龄23~45岁,中位年龄38岁。乳腺体积285~844 cm3,平均体积554 cm3。
2.CT模拟定位:患者采用仰卧位双手上举抱头体位,真空垫固定,平静呼吸下行CT Brilliance 16(荷兰飞利浦公司)定位扫描,层厚5 mm,扫描范围从环状软骨上缘至膈肌水平,CT图像经网络传输至Oncentra 4.3(瑞典医科达公司)治疗计划系统。
3.靶区及危及器官勾画:所有15例患者靶区和危及器官(organ at risk,OAR)均由同一位放疗医师在CT图像上勾画。临床靶体积(CTV)包括整个左侧乳腺、内乳淋巴结区、腋顶和锁骨上下区。乳腺区域定义为临床靶区CTV1,勾画范围包括:左侧完整的乳腺组织,上界至锁骨头下缘水平,下界至乳腺褶皱下2 cm,内外侧至所有可见的乳腺组织,考虑剂量建成区问题,前界至皮下5 mm,后界至肋骨表面。内乳淋巴结区未单独定义靶区,包括在CTV1内,勾画范围为1~3肋间内乳动静脉周围5 mm。腋顶和锁骨上下区域定义为临床靶区CTV2,勾画范围:上界为环状软骨下缘水平,下界至锁骨头下缘水平,内界为气管旁,避开甲状腺,外界为肱骨头内侧缘。由CTV外扩0.5 cm生成计划靶体积PTV,外扩至皮下做相应调整,使皮下保留5 mm。后界扩至肺与胸壁交界。危及器官勾画心脏、LAD、双侧肺、脊髓和健侧乳腺。心脏和LAD勾画依据密歇根大学心脏图谱[10],考虑呼吸运动和心脏跳动,LAD边界外放5 mm。
4.治疗计划设计:利用Oncentra 4.3治疗计划系统为每例患者设计W-TF、6F-IMRT及T-VMAT 3种治疗计划,剂量计算采用3 C(collapsed cone convolution)算法,选用瑞典医科达Synergy S加速器,1 cm多叶准直器,6 MV光子线。靶区处方剂量50 Gy/25次,共5周,不考虑瘤床局部加量。所有计划均由两名物理师设计并优化计划,选择其中较优化方案。W-TF计划:乳腺野采用切线野对穿照射,加(20±5)°楔形板,射野包括整个PTV1,避免照射健侧乳腺,根据靶区空间位置分布不同,角度设置为α(120°±5°)和β(300°±5°),皮肤方向镂空2 cm;腋顶和锁骨上下区PTV2采用345°单野照射,避开脊髓、气管和食管中线结构,腋锁野及乳腺野衔接点设在锁骨头下缘。6F-IMRT计划按文献[5]方法:采用6个共面野照射,内外侧各3野,两侧中间野角度设置根据切线野角度,分别为α-25°,α、α+25°、β-12°、β和β+12°。T-VMAT计划按文献[11]方法:采用切线野方向的左右两个共面双弧,并在每个弧的基础上增加一个反向的弧,每个弧长50°,起始角度设置分别为α-25°和β-25°,准直器角度20°,每隔4°设置一个控制点。图 1为6F-IMRT计划和T-VMAT计划机架角度设置。6F-IMRT和T-VMAT计划优化最先考虑计划靶区(PTV)剂量即PTV至少95%体积达到95%处方剂量(47.5 Gy),其次考虑心脏和LAD剂量限制。靶区与危及器官剂量限制见表 1。
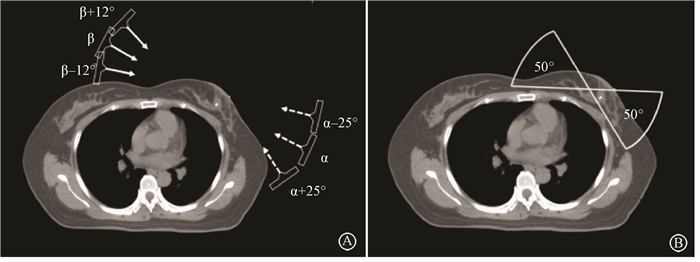
|
图 1 6F-IMRT(A)和T-VMAT(B)计划射野设置 Figure 1 Typical beam arrangements for 6F-IMRT(A) and T-VMAT(B) |
|
|
表 1 乳腺癌患者6F-IMRT和T-VMAT计划优化目标函数 Table 1 The optimization objectives for 6F-IMRT and T-VMAT for breast cancer patients |
5.剂量学评价指标:采用剂量体积直方(DVH)图评价靶区和OAR剂量。靶区剂量学参数包括D95、V95、V110、均匀指数(homogeneity index,HI)[12]和适形指数(conformal index,CI)[13]。其中,HI=(D2%-D98%)/Dmedian,D2%和D98%分别为2%和98%靶区体积所接受的剂量,代表靶区最大和最小剂量;Dmedian为50%靶区体积接受的剂量。HI值越小越接近0代表均匀性越好。CI=VT.ref /VT × VT.ref /Vref,式中VT为靶区体积;VT.ref为参考等剂量线包绕的靶区体积;Vref 为参考等剂量曲线所包绕的所有区域体积,参考剂量取靶区95%处方剂量47.5 Gy。CI值范围0~1之间,越接近于1适形度越好。OAR评价指标包括心脏和LAD平均剂量(Dmean)、最大剂量(Dmax)和V5、V10、V20、V30和V40(Vx分别为接受大于等于5、10、20、30和40 Gy剂量的体积);左肺Dmean、V5、V20、V30和V40;健侧乳腺V5和Dmean。
6.统计学处理:采用SPSS 19.0软件进行数据分析。数据以x±s表示,正态性检验采用Shapiro-Wilk检验,各剂量学评价指标均符合正态分布。多组间比较采用单因素方差分析,组内两两比较采用LSD法。P<0.05为差异有统计学意义。
结果1.3种计划间心脏和LAD的剂量学指标比较:与W-TF计划比较,T-VMAT计划降低了心脏和LAD的Dmean,分别降低了2.95和30.32 Gy;T-VMAT计划不仅明显降低心脏和LAD接受中高剂量(V10、V20、V30和V40)照射的体积,也降低了心脏和LAD接受低剂量5 Gy的受照体积,但差异均无统计学意义(P>0.05)。与6F-IMRT计划比较,T-VMAT计划可进一步降低心脏和LAD的Dmean、V5和V10等参数,差异有统计学意义(P<0.05),但Dmax和高剂量区(V30和V40)受照体积差异无统计学意义(P>0.05)。
2. 3种计划间左肺与健侧乳腺的剂量学指标比较:W-TF、6F-IMRT和T-VMAT计划左肺Dmean分别为11.4、11.3和11.8 Gy,V20分别为21.9%、21.8%和24.1%,3种计划间差异无统计学意义(P>0.05);高剂量区受照体积V30和V40,W-TF(17.92%、12.89%)计划明显高于6F-IMRT(12.59%、5.72%)和T-VMAT(13.91%、6.04%)计划(P<0.05);但低剂量区(V5)的照射体积,T-VMAT(49.73%)和6F-IMRT(50.02%)计划明显高于W-TF(38.55%)计划(P<0.05)。
T-VMAT计划中健侧乳腺的Dmean高于W-TF计划,但显著低于6F-IMRT计划,差异均有统计学意义(P<0.05);但T-VMAT与W-TF计划的V5分别为3.7%和2.3%,两个计划比较差异无统计学意义(P>0.05),但比6F-IMRT计划降低2%,差异有统计学意义(P<0.05),见表 2。
|
|
表 2 15例乳腺癌患者不同计划剂量参数比较(x±s) Table 2 Comparison of dosimetric parameters for different plans in 15 cases of breast cancer patients(x±s) |
3.3种计划间PTV的剂量学指标比较:与W-TF计划的0.47相比,T-VMAT计划CI值为0.57,明显改善PTV的适形度(P<0.05),但低于6F-IMRT计划的0.65(P<0.05);剂量均匀性指标HI值T-VMAT(0.15)和6F-IMRT(0.16)计划间差异无统计学意义,但均显著低于W-TF计划(P<0.05);对于PTV中大于110%处方剂量的体积,T-VMAT计划与6F-IMRT计划比较差异无统计学意义(P>0.05),但均明显低于W-TF计划,见表 2。
讨论容积弧形调强放射治疗(volumetric modulated arc therapy,VMAT)通过治疗机架的弧形旋转和多叶光栅的动态运动,改变射野的方向、大小和形状,同时改变加速器的剂量率,从而实现对靶区的快速调强治疗。然而,早期有剂量学研究发现,与乳腺癌常规楔形板切线野3D-CRT计划(W-TF)或切线2野IMRT计划(T-IMRT)相比,VMAT可致健侧乳腺、肺和心脏低剂量区体积增加,因此早期VMAT技术不推荐用于乳腺癌术后放疗[14-15]。但分析这两项研究发现,VMAT设计采用全弧或连续半弧,因无角度限制,故使OAR低剂量区受照体积增加。本研究T-VMAT采用切线野方向50°双弧照射,以期克服OAR低剂量区体积增加的局限。乳腺癌保乳术后T-IMRT虽较W-TF改善靶区剂量均匀性,但在降低心脏和同侧肺高剂量区体积方面作用有限[16];同时相对于仅照射胸壁野,PTV包括胸壁野、腋锁区和内乳淋巴区靶区复杂较多,T-IMRT计划剂量调节因受射野角度限制,为降低心脏和同侧肺的受量,只能以降低靶区剂量覆盖为代价,结果导致靶区剂量均匀性降低,显示出较差的V95、CI和HI以及较高的V110[17]。而多野调强技术(MB-IMRT)克服射野角度受限的局限,目前乳腺癌多野调强技术的野数设置主要有4野、6野和7野等。7野计划在保护患侧肺、心脏和LAD等OAR方面并未显示出剂量学优势[14],而有报道4野和6野调强技术不仅可进一步改善靶区剂量均匀性,同时并未增加心脏、肺和健侧乳腺低剂量区的受照体积[5, 17]。考虑到靶区包括内乳淋巴区较复杂,因此,本研究设计T-VMAT与常规W-TF和6F-IMRT进行剂量学比较,以期获得T-VMAT在乳腺癌局部复杂区域放疗中保护心脏的剂量学优势更具说服力。
目前为止,还未有研究明确提出心脏的绝对安全受照剂量,以及究竟是大体积低剂量还是小体积高剂量照射对心脏的放射性损伤更严重。因而,在保证靶区剂量的前提下,最大限度降低心脏的受照剂量和体积显得极其重要,特别是对于有增加放射性心脏损伤因素的乳腺癌患者,如放疗前合并高血压等心血管疾病[3]或应用有心脏毒性的辅助化疗药物[18]。Virén等[11]发现左侧乳腺癌保乳术后胸壁野放疗,切线野方向双弧VMAT比W-TF和T-IMRT计划显著降低心脏平均剂量和高剂量区受照体积,且2 Gy低剂量区受照体积并未增加。Pasler等[6]也通过对10例淋巴结阳性左侧乳腺癌保乳术后患者,进行50°双弧VMAT技术的剂量学研究,发现双弧VMAT计划心脏Dmean、V5、V10和V30分别为3.3 Gy、13.2%、5.6%和0.6%,与本研究结果中相应的心脏剂量学指标一致。本研究显示T-VMAT计划心脏的Dmean明显低于W-TF和6F-IMRT计划,并且T-VMAT计划比W-TF计划不仅明显降低中高剂量区受照体积,而且有降低低剂量5 Gy区受照体积的趋势,但可能因样本量有限,差异无统计学意义;与6F-IMRT计划相比,明显降低低剂量区(5和10 Gy)受照体积,但高剂量区受照体积两者无明显差异。因此,笔者认为左侧乳腺癌保乳术后患者,包括内乳淋巴结的复杂局部区域放疗采用T-VMAT技术心脏获益明显。
心脏灌注方面的研究发现心脏灌注缺损主要发生于心脏照射野内[19]。Nilsson等[20]通过对199例乳腺癌放疗后患者行冠状动脉造影术并进行分析,发现冠状动脉狭窄部位与剂量热点区相关,狭窄主要发生于LAD,且放疗组左侧乳腺癌LAD严重狭窄的发生率较高,是右侧乳腺癌的4~7倍,而未放疗组LAD狭窄的发生率无明显患侧差异,该研究者建议左侧乳腺癌放疗LAD应作为重要危及器官(OAR),并应尽量降低LAD的受照剂量和体积。因此,相继有放疗学者对左乳腺癌保乳术后放疗患者进行LAD的剂量学研究。Pham等[21]和Virén等[11]发现与W-TF和IMRT计划相比,VMAT可显著降低LAD的Dmax、Dmean和高剂量区体积(V25和V30)。本研究结果与其相似。本研究还发现,与W-TF相比,T-VMAT技术不仅没有增加低剂量区受照体积,相反有降低5 Gy低剂量区体积的趋势,虽差异无统计学意义,本研究将继续加大样本量,进行深入研究。
在靶区剂量方面,本研究显示,对于乳腺癌保乳术后包括内乳淋巴结的复杂靶区放疗,T-VMAT与6F-IMRT较W-TF更易满足靶区对剂量覆盖、适形度和均匀性方面的要求。随着乳腺癌患者发病年龄逐渐年轻化,加之健康乳腺组织对放射极为敏感,使得健侧乳腺受量成为乳腺癌放疗中不容忽视的问题[22]。Virén等[11]通过对乳腺癌保乳术后患者进行T-VAMT与W-TF剂量学比较,发现健侧乳腺Dmean和V2低剂量区体积无明显差异,因此,该研究认为T-VMAT并未比3D-CRT增加诱导第二原发癌风险。本研究结果也显示T-VMAT的低剂量区V5与W-TF无明显差异。目前的研究显示V20、V30和Dmean是乳腺癌放疗后预测放射性肺炎的重要参数[23]。姚晖等[24]通过对乳腺癌保乳术后部分乳腺放疗患者研究发现,VMAT在保护患侧肺V20方面较3D-CRT显示明显优势。本研究显示, V20和Dmean 3种计划间差异均无统计学意义,而V30和V40VMAT计划明显低于W-TF计划,提示T-VAMT并无增加放射性肺炎的风险。
本研究存在一些不足,Oncentra 4.3计划系统IMRT和VMAT计划版块无处理乳腺“皮肤镂空”功能,因此T-VMAT和6F-IMRT计划设计未考虑“皮肤镂空”问题;纳入的乳腺体积异质性大,但因样本数相对少,未能行亚组分析,以后将继续收集样本,按乳腺体积进行亚组分析;仅为计划的剂量学比较,但是否能如剂量学显示的在临床上真正获益,还需进一步进行临床研究。
因此,针对左侧乳腺癌保乳术后靶区包括内乳淋巴结和腋锁淋巴结的复杂局部放疗,本研究从剂量学上评价T-VMAT技术对心脏的保护作用,结果发现与常规W-TF相比,T-VMAT不仅可以降低心脏和LAD高剂量区受照体积,而且并未增加心脏和LAD 5 Gy低剂量受照体积,反而有降低的趋势。同时健侧乳腺V5以及同侧肺V20的受照体积也无明显增加,还可显著提高靶区PTV的剂量覆盖、适形度和均匀性。综上所述,对于乳腺癌保乳术后靶区包括内乳淋巴结的局部复杂放疗患者,T-VMAT技术有望成为放疗前合并有心脏危险因素或应用心脏毒性的辅助化疗药物患者,需要最大限度保护心脏时可选择的放疗方案。
利益冲突 本研究接受深圳市科技研发基金(JCYJ20150403101028189)资助,所有作者无任何利益冲突作者贡献声明 高艳负责收集资料、整理数据、统计分析和撰写论文;钟鹤立和刘雅洁负责论文选题、设计和论文修改;周亚燕负责协助统计分析和修改论文;李壮玲和李炜澔负责放疗计划的具体设计和协助整理数据
| [1] |
Darby S, McGale P, Correa C, et al. Effect of radiotherapy after breast-conserving surgery on 10-year recurrence and 15-year breast cancer death:meta-analysis of individual patient data for 10, 801 women in 17 randomised trials[J]. Lancet, 2011, 378(9804): 1707-1716. DOI:10.1016/S0140-6736(11)61629-2 |
| [2] |
Bouillon K, Haddy N, Delaloge S, et al. Long-term cardiovascular mortality after radiotherapy for breast cancer[J]. J Am Coll Cardiol, 2011, 57(4): 445-452. DOI:10.1016/j.jacc.2010.08.638.1 |
| [3] |
Darby SC, Ewertz M, McGale P, et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer[J]. N Engl J Med, 2013, 368(11): 987-998. DOI:10.1056/nejmoa1209825 |
| [4] |
Henson KE, McGale P, Taylor C, et al. Radiation-related mortality from heart disease and lung cancer more than 20 years after radiotherapy for breast cancer[J]. Br J Cancer, 2013, 108(1): 179-182. DOI:10.1038/bjc.2012.575 |
| [5] |
Mulliez T, Speleers B, Madani I, et al. Whole breast radiotherapy in prone and supine position:is there a place for multi-beam IMRT?[J]. Radiat Oncol, 2013, 8(151): 1-7. DOI:10.1186/1748-717x-8-151 |
| [6] |
Pasler M, Lutterbach J, Björnsgard M, et al. VMAT techniques for lymph node-positive left sided breast cancer[J]. Z Med Phys, 2015, 25(2): 104-111. DOI:10.1016/j.zemedi.2014.03.008 |
| [7] |
Stewart JR, Fajardo LF, Gillette SM, et al. Radiation injury to the heart[J]. Int J Radiat Oncol Biol Phys, 1995, 31(5): 1205-1211. DOI:10.1016/0360-3016(94)00656-6 |
| [8] |
Taylor CW, Povall JM, McGale P, et al. Cardiac dose from tangential breast cancer radiotherapy in the year 2006[J]. Int J Radiat Oncol Biol Phys, 2008, 72(2): 501-507. DOI:10.1016/j.ijrobp.2007.12.058 |
| [9] |
Taylor CW, Nisbet A, McGale P, et al. Cardiac doses from Swedish breast cancer radiotherapy since the 1950s[J]. Radiother Oncol, 2009, 90(1): 127-135. DOI:10.1016/j.radonc.2008.09.029 |
| [10] |
Feng M, Moran JM, Koelling T, et al. Development and validation of a heart atlas to study cardiac exposure to radiation following treatment for breast cancer[J]. Int J Radiat Oncol Biol Phys, 2011, 79(1): 10-18. DOI:10.1016/j.ijrobp.2009.10.058 |
| [11] |
Virén T, Heikkilä J, Myllyoja K, et al. Tangential volumetric modulated arc therapy technique for left-sided breast cancer radiotherapy[J]. Radiat Oncol, 2015, 10: 79. DOI:10.1186/s13014-015-0392-x |
| [12] |
International Commission on Radiation Units and Measurements. ICRU Report 83.Prescribing, recording, and reporting photon-beam intensity-modulated radiation therapy (IMRT):contents[J]. J ICRU, 2010, 10(1): 1-106. DOI:10.1016/j.canrad.2011.04.003 |
| [13] |
van't RA, Mak AC, Moerland MA, et al. A conformation number to quantify the degree of conformality in brachytherapy and external beam irradiation:application to the prostate[J]. Int J Radiat Oncol Biol Phys, 1997, 37(3): 731-736. DOI:10.1016/s0360-3016(96)00601-3 |
| [14] |
Jin GH, Chen LX, Deng XW, et al. A comparative dosimetric study for treating left-sided breast cancer for small breast size using five different radiotherapy techniques:conventional tangential field, filed-in-filed, tangential-IMRT, multi-beam IMRT and VMAT[J]. Radiat Oncol, 2013, 8: 89. DOI:10.1186/1748-717X-8-89 |
| [15] |
Popescu CC, Olivotto IA, Beckham WA, et al. Volumetric modulated arc therapy improves dosimetry and reduces treatment time compared to conventional intensity modulated radiotherapy for locoregional radiotherapy of left-sided breast cancer and internal mammary nodes[J]. Int J Radiat Oncol Biol Phys, 2010, 76(1): 287-295. DOI:10.1016/j.ijrobp.2009.05.038 |
| [16] |
Barnett GC, Wilkinson JS, Moody AM, et al. Randomized controlled trial of forward-planned intensity modulated radiotherapy for early breast cancer:interim results at 2 years[J]. Int J Radiat Oncol Biol Phys, 2012, 82(2): 715-723. DOI:10.1016/j.ijrobp.2010.10.068 |
| [17] |
Wang J, Li X, Deng Q, et al. Postoperative radiotherapy following mastectomy for patients with left-sided breast cancer:A comparative dosimetric study[J]. Med Dosim, 2015, 40(3): 190-194. DOI:10.1016/j.meddos.2014.11.004 |
| [18] |
Florescu M, Magda LS, Enescu OA, et al. Early detection of epirubicin-induced cardiotoxicity in patients with breast cancer[J]. J Am Soc Echocardiogr, 2014, 27(1): 83-92. DOI:10.1016/j.echo.2013.10.008 |
| [19] |
Marks LB, Yu X, Prosnitz RG, et al. The incidence and functional consequences of RT-associated cardiac perfusion defects[J]. Int J Radiat Oncol Biol Phys, 2005, 63(1): 214-223. DOI:10.1016/j.ijrobp.2005.01.029 |
| [20] |
Nilsson G, Holmberg L, Garmo H, et al. Distribution of coronary artery stenosis after radiation for breast cancer[J]. J Clin Oncol, 2012, 30(4): 380-386. DOI:10.1200/JCO.2011.34.5900 |
| [21] |
Pham TT, Ward R, Latty D, et al. Left-sided breast cancer loco-regional radiotherapy with deep inspiration breath-hold:Does volumetric-modulated arc radiotherapy reduce heart dose further compared with tangential intensity-modulated radiotherapy?[J]. J Med Imaging Radiat Oncol, 2016, 60(4): 545-553. DOI:10.1111/1754-9485.12459 |
| [22] |
Grantzau T, Mellemkjær L, Overgaard J. Second primary cancers after adjuvant radiotherapy in early breast cancer patients:a national population based study under the Danish Breast Cancer Cooperative Group (DBCG)[J]. Radiother Oncol, 2013, 106(1): 42-49. DOI:10.1016/j.radonc.2013.01.002 |
| [23] |
Rodrigues G, Lock M, D'Souza D, et al. Prediction of radiation pneumonitis by dose-volume histogram parameters in lung cancer——a systematic review[J]. Radiother Oncol, 2004, 71(2): 127-138. DOI:10.1016/j.radonc.2004.02.015 |
| [24] |
姚晖, 邱健健, 王芸, 等. 乳腺癌保乳术后部分乳腺三种放疗计划的剂量学比较[J]. 中华放射医学与防护杂志, 2014, 34(5): 358-361. Yao H, Qiu JJ, Wang Y, et al. Dosimetric comparison of three techniques in treatment of accelerated partial breast irradiation[J]. Chin J Radiol Med Prot, 2014, 34(5): 358-361. DOI:10.3760/cma.j.issn.0254-5098.2014.05.010 |
 2018, Vol. 38
2018, Vol. 38


