2. 100088 北京, 火箭军总医院核与辐射损伤实验室;
3. 100088 北京, 火箭军总医院放疗科;
4. 100088 北京, 火箭军总医院肿瘤科
2. Laboratory of Nuclear and Radiation Damage, The General Hospital of PLA Rocket Force, Beijing 100088, China;
3. Department of Radiotherapy, The General Hospital of PLA Rocket Force, Beijing 100088, China;
4. Department of Oncology, The General Hospital of PLA Rocket Force, Beijing 100088, China
肺癌是世界范围内死亡率较高的恶性肿瘤[1],约57%的肺癌患者初诊时已发生了远处转移[2]。肺癌按病理类型可分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC),NSCLC主要包括腺癌、鳞癌及大细胞癌等。放射治疗作为肺癌常见的治疗方法[3],在抗肿瘤治疗中占有重要地位,但放疗对于肺癌患者5年生存期提高并不明显[4]。近年来,有关于头颈部癌、直肠癌、卵巢癌等的研究显示,一定剂量电离辐射可能会促进恶性肿瘤细胞的侵袭转移,且一些微小RNA(miRNA、microRNA)可能参与此过程[5-9]。
在本研究前期工作中,利用miRNA表达谱芯片初步筛选了2、4 Gy X射线照射前后A549细胞差异表达的miRNA,发现miR-21表达发生了显著变化,本研究拟进一步在细胞、动物及临床肺癌患者中较为系统地验证其变化及意义。
材料与方法1.肺癌组织和血清样本:20例肺癌组织样本来自原北京军区总医院,术后病理诊断10例腺癌,10例鳞癌,同时取相邻正常肺组织作为对照。103例肺癌患者血清样本来自火箭军总医院,其中非小细胞肺癌78例,包括62例腺癌,25例鳞癌,16例小细胞癌,均为ⅢB~Ⅳ期或广泛期患者,所有样本均为在患者首次接受直线加速器放疗后3 d内收集,放疗单次剂量为1.8~2.0 Gy,总剂量为50~70 Gy;所有患者以确诊时间为观察起点,随访终点为2017年6月31日,计算患者总生存(OS)。另抽取火箭军总医院10例健康体检者的血清作为健康对照组。抽取患者外周血4 ml,待凝固后离心半径7.5 cm,5 000 r/min离心6 min,吸取血清样本于1.5 ml无RNA酶的EP管中,每例3管,置-80℃冰箱冻存备用。所有纳入本次研究的患者均经病理细胞学确诊,且均签署知情同意书,依据国际肺癌研究学会(IASLC)第8版肺癌TNM分期标准完整记录资料,所选病例无妊娠,无高血压、糖尿病、肝肾功能不全等并发症。本研究得到本院伦理委员会批准,批件号为2015036。
2.细胞与试剂:人肺癌A549细胞购自北京协和医学院细胞库,胎牛血清(FBS)、DMEM培养基购自美国GIBCO公司,细胞系用含有10%灭活FBS、100 U/ml青霉素、链霉素的DMEM培养液,37℃、5%CO2、饱和湿度培养箱中培养。取细胞生长数目为80%以上的A549细胞,常温下以直线加速器(火箭军总医院放射治疗中心,瑞典Elekta公司Precise型)进行照射,源靶距为100 cm,X射线能量为6 MV,吸收剂量率为442.89 cGy/min,吸收剂量分别为2、4 Gy,于照射后1、2、12、24、48 h收集细胞进行检测,未照射(0 Gy)的A549细胞作为对照组。
3.动物实验分组及样品采集:取18~22 g体重的BALB/c nu/nu雌性裸鼠(购于北京市实验动物中心),SPF级饲养,许可证号:SCXK(京)2016-0011。采用简单随机化分组方法分为5组(0 Gy 3、6、10周,2 Gy 10周,4 Gy 10周),每组6只;于小鼠尾静脉注射不同剂量照射的A549细胞5×106,以未注射的裸鼠作为空白对照组,分别于照射后3、6、10周眼球放血,快速打开胸腔分离肺组织,迅速放入液氮中冷冻,-80℃冰箱保存,用于miRNA提取;同时分离血清,分装后-20℃冰箱保存,待后续miRNA检测。
4. miRNA提取及RT-qPCR检测:A549细胞RNA提取:用磷酸盐缓冲液(PBS)冲洗处于对数生长期的A549细胞,每102~107细胞内加入600 μl裂解液(lysis/binding solution),裂解细胞3 min;收集裂解液于1.5 ml EP管中用于RNA提取。裸鼠肺组织RNA提取:液氮研磨 < 200 mg裸鼠肺组织,转移粉末至1.5 ml EP管中,加入1 000 μl Lysis/Binding Solution裂解细胞。裸鼠血清miRNA提取:取冻存血清后充分融化,室温条件下于625 μl血清中加入等体积的2×变性液(denaturing solution),立即混匀,冰上孵育5 min;miRNA的提取、反转录体系及反应条件、qPCR参照相应的操作手册;探针和引物参照miRBase,由美国ABI公司合成。以U6表达水平作为miRNA的内参;每个样品3个复孔,实验重复3次,取均值。microRNA提取试剂盒、microRNA反转录试剂盒均购自美国ABI公司。
5. miRNA相对表达量的倍数计算方法:倍数变化(Fold change)=2-ΔΔCt=2-(ΔCt实验组-ΔCt对照组);ΔCt=Ct待测样品-Ct内参,以对照组中U6 miRNA的表达量为内参,表达倍数≥1.8定义为阳性。
6.统计学处理:计量数据以x±s表示,采用SPSS 23.0软件进行数据分析。正态分布及方差齐的数据比较采用单因素k水平方差分析;实验组与空白对照组之间采用独立样本t检验;不同病理类型样本检出率比较采用χ2检验;采用Kaplan-Meier法进行生存分析,Cox回归模型进行多因素分析。P<0.05为差异有统计学意义。
结果1. miR-21在肺癌组织和血清样本中的表达:肺癌组织中有60.0%(12/20)miR-21表达升高,升高2.18~24.36倍,在87例非小细胞肺癌中,10例腺癌组织检出5例,10例鳞癌组织检出7例,两者差异无统计学意义(P>0.05)。103例肺癌血清中miR-21表达升高占50.5%(52/103),与健康对照者血清相比,升高1.80~11.98倍,其中62例腺癌患者血清miR-21检出率为43.5%(27/62),25例鳞癌患者血清miR-21检出率为72.0%(18/25);16例小细胞癌患者血清miR-21检出率为43.75%(7/16)。腺癌与鳞癌之间检出率差异有统计学意义(χ2=4.008,P<0.005),非小细胞肺癌与小细胞肺癌之间检出率差异无统计学意义(P>0.05)。在87例非小细胞肺癌中,放疗患者血清miR-21阳性检出率为66.7%(26/39),显著高于未放疗患者血清阳性检出率39.6%(19/48)(χ2=6.321,P<0.05)。
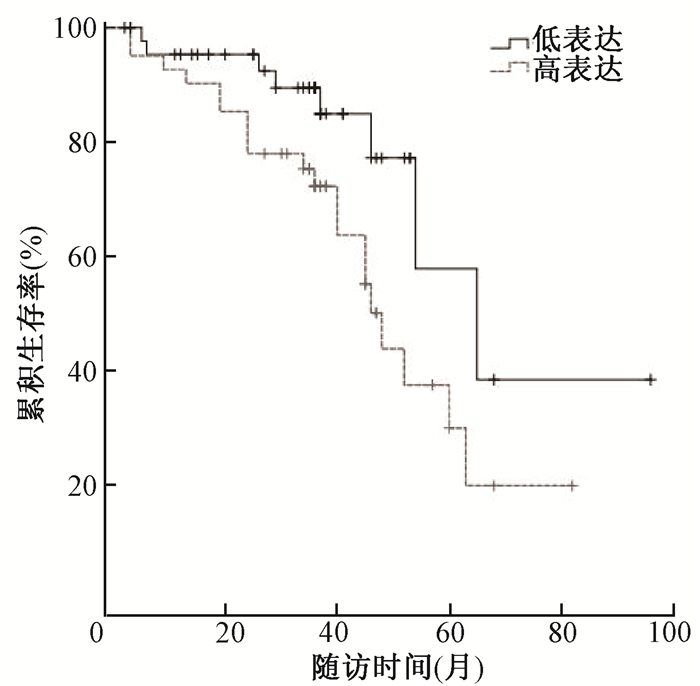
2. miR-21与肺癌患者总生存及预后因素的相关性分析:130例肺癌患者中,87例非小细胞肺癌患者纳入总生存及多因素预后分析,结果显示,miR-21高表达与淋巴结转移及是否接受放疗相关(χ2=15.865、6.321, P<0.05, 表 1),Kaplan-Meier法生存分析显示(图 1),miR-21高表达的肺癌患者预后显著低于miR-21低表达的患者,差异有统计学意义(P<0.05)。Cox回归模型多因素分析显示,非小细胞肺癌患者miR-21高表达与区域淋巴结转移(P<0.05)及放疗(P<0.05)均为影响患者预后的独立危险因素(表 2)。
|
|
表 1 不同miR-21表达水平患者总生存的单因素分析 Table 1 The univariate analysis of overall survival between different miR-21 expressions and clinical features |
|
图 1 不同miR-21表达水平的非小细胞肺癌患者生存曲线 Figure 1 Kaplan-Meier survival curve of NSCLC patients with different expression levels of miR-21 |
|
|
表 2 不同miR-21表达水平患者总生存的Cox回归分析 Table 2 Overall survival of the patients with different expression levels of miR-21 analyzed by the Cox proportional hazard regression model |
3.电离辐射对A549细胞体内外miR-21表达影响:结果见表 3。上述临床标本的检测结果提示,放疗与miR-21表达可能密切相关,进一步以X射线体外照射A549细胞。结果显示,与空白对照组相比,2 Gy X射线照射后1、12、24及48 h,miR-21表达均显著升高(t=-7.503、-1.680、-2.615、-1.571,P<0.05);4 Gy X射线照射后1、2、12、24及48 h,miR-21表达亦均显著升高(t=-7.552、-5.020、-6.017、-1.206、-1.502,P<0.05),且照射后1 h,4 Gy组miR-21表达水平显著高于2 Gy组(t=-5.202,P<0.05)。
|
|
表 3 2、4 Gy X射线照射后不同时间点A549细胞miR-21表达变化(x±s) Table 3 The relative expression level of miR-21 in A549 cells at different time after 2 and 4 Gy X-ray irradiation(x±s) |
4. miR-21在肺转移癌裸鼠血清及肺组织中的表达:结果见表 4。将A549细胞经尾静脉注入裸鼠后3、6周,肺组织中无肉眼可见肿瘤灶,裸鼠血清miR-21表达显著升高,分别为空白对照组的7.40及4.81倍(t=-4.783、-5.572,P<0.05),裸鼠肺组织中miR-21表达与空白对照组相比,升高1.11及1.32倍,但差异无统计学意义(P>0.05);注射后10周,裸鼠血清和肺组织miR-21表达均显著升高,分别为空白对照组的8.16及7.43倍(t=-8.983、-7.646,P<0.05)。注射后10周,肺组织中肉眼可见肿瘤灶,与空白对照组相比,0、2、4 Gy组裸鼠血清中miR-21表达均显著升高(t=-8.983、-47.845、-4.503,P<0.05),2 Gy组显著高于0与4 Gy组(t=-19.979、-4.711,P<0.05);0、2、4 Gy组肺组织中miR-21表达也均显著升高(t=-7.646、-7.262、-4.752,P<0.05);2 Gy组亦显著高于0和4 Gy组(t=-3.694、-2.356,P<0.05)。
|
|
表 4 肺转移癌裸鼠受照后10周血清及肺组织中miR-21表达(x±s) Table 4 The expression of miR-21 in the serum and lung tissue of nude mice 10 weeks post-irradiation(x±s) |
讨论
miRNA是一类长度约为22个核苷酸的小分子非编码RNA,广泛存在于真核细胞中,具有高度的保守性和组织特异性,主要通过与靶基因3′端非编码区(3′-UTR)的完全或部分互补来降解、抑制mRNA转录后表达,超过50%的miRNA位于肿瘤相关区域或脆性区域,参与肿瘤的发生发展及侵袭转移等过程[10-13]。miR-21为miRNA家族一员,其基因定位于人类染色体17q23.2上[14]。研究显示,miR-21具备癌基因的功能[15],在多种肿瘤如结肠癌、肝癌、胰腺癌、前列腺癌中均表达上调,与肿瘤的发生密切相关[16-17]。
本研究就miR-21在肺癌组织及血清中的表达进行了研究。结果发现,在肺癌术后组织标本中,miR-21检出率鳞癌高于腺癌,在所有肺癌血清样本中,鳞癌血清miR-21检出率显著高于腺癌及小细胞肺癌患者,两者检测结果一致,上述发现提示miR-21表达水平可能与肺癌病理类型相关,其有可能成为肺癌病理诊断新的潜在标志物。本研究在非小细胞肺癌中,放疗组血清miR-21检出率显著高于非放疗组患者,结果初步提示电离辐射(放疗)可能会增加miR-21的表达。Kaplan-Meier法生存分析显示,miR-21高表达的肺癌患者预后显著低于miR-21低表达患者;Cox回归模型分析显示,miR-21高表达、区域淋巴结转移及放疗,可能为影响患者预后的独立危险因素,这与Wang等[18]和Jiang等[19]对非小细胞肺癌患者生存分析的研究结果相一致,提示miR-21有可能作为非小细胞肺癌患者预后判断的新指标及靶向治疗的新靶点。
放疗在抗肿瘤治疗中占有重要地位,然而Hartford等[20]对小鼠原发肿瘤进行照射后发现,射线能加速小鼠原发肿瘤的侵袭转移能力;Lv等[21]研究发现,2、4 Gy X射线能增强A549细胞的体外侵袭能力,其机制与调节血管内皮生长因子(VEGF)及趋化因子受体-7(CCR-7)的表达相关;Shin等[22]报道指出,不同辐射剂量可导致A549细胞表达miR-16-2*等6种miRNA发生显著变化,提示相关miRNA可能参与了辐射生物学效应的调节;为进一步验证电离辐射是否增加肺癌细胞表达miR-21,本研究体外分别以0、2、4 Gy X射线照射A549细胞,qRT-PCR检测发现,照射1、2、12、24及48 h后miR-21表达均有不同程度升高,4 Gy照射组miR-21平均升高水平高于2 Gy照射组,说明2、4 Gy X射线照射可增加A549细胞miR-21的表达,与前期以TaqMAN微流体芯片初步筛选的结果及临床放疗患者外周血的检测结果基本一致[20-23]。同时,本研究将X射线照射后的A549细胞经尾静脉注射裸鼠,发现注射后10周,裸鼠肺中可见散在的肿瘤灶形成,裸鼠血清及肺组织中miR-21表达水平较对照组均显著升高,该结果进一步说明,2、4 Gy X射线照射后的A549细胞亦能增加miR-21在肺组织及血清中的表达水平,并可能促进其体内侵袭转移过程。在目前关于miR-21辐射相关的文献中,Zhu等[24]发现在高传能线密度(LET)辐射所致的小鼠肝癌组织中,miR-21是唯一一个升高6倍的miRNA,且受照的人或小鼠肝细胞以及全身受照的小鼠肝组织中miR-21表达也上调,可能与辐射敏感性相关;Wang等[18]研究提示,下调miR-21表达能促进A549细胞的辐射敏感性、抑制A549细胞增殖并促进辐射诱导的A549细胞凋亡。本研究结果与上述研究一致,发现一定剂量的X射线可以上调A549细胞体内、外miR-21的表达,且其表达水平与不同辐射剂量及辐照后不同时间密切相关,提示miR-21可能参与辐射诱导的A549细胞生物学活性改变的调控,并可能促进了A549细胞体内侵袭转移过程,其具体机制有待后续实验进一步研究明确。
本研究的发现在寻找新的肺癌标志物和新的治疗靶点方面,以及在对肺癌患者常规放疗方案的调整、优化等方面有一定价值和指导意义,值得进一步深入研究。同时由于时间和经费等因素的原因,未能对miR-21进行深入的功能研究,且在收集血清样本时包含的患者分期面比较局限,这些在后续的研究中会作进一步的完善。
利益冲突 无作者贡献声明 林小华进行数据统计、论文撰写和修改;江其生、吕进、陈火明负责对论文进行审校;高俊、段影负责实验设计和实施;王思念、宋秀军、于慧杰负责准备试剂和实验材料
| [1] |
Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [2] |
Howlader N, Noone AM, Krapcho M, et al. SEER cancer statistics review, 1975-2012[EB/OL]. (2015-11-18)[2017-08-23]. http://seer.cancer.gov/csr/1975_2012.
|
| [3] |
Pollom EL, Qian Y, Durkee BY, et al. Hypofractionated intensity-modulated radiotherapy for patients with non-small-cell lung cancer[J]. Clin Lung Cancer, 2016, 17(6): 588-594. DOI:10.1016/j.cllc.2016.05.024 |
| [4] |
Kim MJ, Yeo SG, Kim ES, et al. Intensity-modulated stereotactic body radiotherapy for stage Ⅰ non-small cell lung cancer[J]. Oncol Lett, 2013, 5(3): 840-844. DOI:10.3892/ol.2012.1082 |
| [5] |
Brieger J, Kattwinkel J, Berres M, et al. Impact of vascular endothelial growth factor release on radiation resistance[J]. Oncol Rep, 2007, 18(6): 1597-1601. DOI:10.3892/or.18.6.1597 |
| [6] |
Inoue Y, Ojima E, Watanabe H, et al. Does preoperative chemo-radiotherapy enhance the expression of vascular endothelial growth factor in patients with rectal cancer?[J]. Oncol Rep, 2007, 18(2): 369-375. DOI:10.3892/or.18.2.369 |
| [7] |
Jia JB, Wang WQ, Sun HC, et al. A novel tripeptide, tyroserleutide, inhibits irradiation-induced invasiveness and metastasis of hepatocellular carcinoma in nude mice[J]. Invest New Drugs, 2011, 29(5): 861-872. DOI:10.1007/s10637-010-9435-1 |
| [8] |
Cha HJ, Shin S, Yoo H, et al. Identification of ionizing radiation-responsive microRNAs in the IM9 human B lymphoblastic cell line[J]. Int J Oncol, 2009, 34(6): 1661-1668. DOI:10.3892/ijo_00000297 |
| [9] |
Simone NL, Soule BP, Ly D, et al. Ionizing radiation-induced oxidative stress alters miRNA expression[J]. PLoS One, 2009, 4(7): e6377. DOI:10.1371/journal.pone.0006377 |
| [10] |
Crea F, Clermont PL, Parolia A, et al. The non-coding transcriptome as a dynamic regulator of cancer metastasis[J]. Cancer Metastasis Rev, 2014, 33(1): 1-16. DOI:10.1007/s10555-013-9455-3 |
| [11] |
Cheng Q, Yi B, Wang A, et al. Exploring and exploiting the fundamental role of microRNAs in tumor pathogenesis[J]. Onco Targets Ther, 2013, 6: 1675-1684. DOI:10.2147/OTT.S52730 |
| [12] |
Farazi TA, Spitzer JI, Morozov P, et al. miRNAs in human cancer[J]. J Pathol, 2011, 223(2): 102-115. DOI:10.1002/path.2806 |
| [13] |
Mohr AM, Mott JL. Overview of microRNA biology[J]. Semin Liver Dis, 2015, 35(1): 3-11. DOI:10.1055/s-0034-1397344 |
| [14] |
Lagos-Quintana M, Rauhut R, Lendeckel W, et al. Identification of novel genes coding for small expressed RNAs[J]. Science, 2001, 294(5543): 853-858. DOI:10.1126/science.1064921 |
| [15] |
Roldo C, Missiaglia E, Hagan JP, et al. MicroRNA expression abnormalities in pancreatic endocrine and acinar tumors are associated with distinctive pathologic features and clinical behavior[J]. J Clin Oncol, 2006, 24(29): 4677-4684. DOI:10.1200/JCO.2005.05.5194 |
| [16] |
Volinia S, Calin GA, Liu CG, et al. A microRNA expression signature of human solid tumors defines cancer gene targets[J]. Proc Natl Acad Sci USA, 2006, 103(7): 2257-2261. DOI:10.1073/pnas.0510565103 |
| [17] |
Buscaglia LE, Li Y. Apoptosis and the target genes of microRNA-21[J]. Chin J Cancer, 2011, 30(6): 371-380. DOI:10.5732/cjc |
| [18] |
Wang XC, Wang W, Zhang ZB, et al. Overexpression of miRNA-21 promotes radiation-resistance of non-small cell lung cancer[J]. Radiat Oncol, 2013, 8: 146. DOI:10.1186/1748-717X-8-146 |
| [19] |
Jiang LP, He CY, Zhu ZT. Role of microRNA-21 in radiosensitivity in non-small cell lung cancer cells by targeting PDCD4 gene[J]. Oncotarget, 2017, 8(14): 23675-23689. DOI:10.18632/oncotarget.15644 |
| [20] |
Hartford AC, Gohongi T, Fukumura D, et al. Irradiation of a Primary tumor, unlike surgical removal, enhances angiogenesis suppression at a distal site:potential role of host-tumor interaction[J]. Cancer Res, 2000, 60(8): 2128-2131. |
| [21] |
Lv J, Jiang QS, Song XJ, et al. Role of VEGF-A/C and CCR-7 in the enhanced metastasis of A549 cells induced by 2 and 4 Gy X-rays in vitro and in vivo[J]. Sci China(Tech Sci), 2014, 57(5): 990-997. DOI:10.1007/s11431-014-5517-1 |
| [22] |
Shin S, Cha HJ, Lee EM, et al. Alteration of miRNA profiles by ionizing radiation in A549 human non-small cell lung cancer cells[J]. Int J Oncol, 2009, 35(1): 81-86. DOI:10.3892/ijo_00000315 |
| [23] |
高俊, 吕进, 胡斌, 等. miR-424*在X射线照射后的A549细胞体内、外及非小细胞肺癌组织和血清中的表达[J]. 中华放射医学与防护杂志, 2017, 37(5): 332-338. Gao J, Lyu J, Hu B, et al. The expression of miR-424* in vivo and in vitro irradiated A549 cells, tissue and serum samples of non-small cell lung cancer[J]. Chin J Radiol Med Prot, 2017, 37(5): 332-338. DOI:10.3760/cma.j.issn.0254-5098.2017.05.003 |
| [24] |
Zhu Y, Yu X, Fu H, et al. MicroRNA-21 is involved in ionizing radiation-promoted liver carcinogenesis[J]. Int J Clin Exp Med, 2010, 3(3): 211-222. |
 2018, Vol. 38
2018, Vol. 38


