睾丸精原细胞瘤(testicular seminoma, TS)是男性泌尿生殖系统常见的恶性肿瘤之一,占睾丸生殖细胞瘤的50%。放射治疗是其Ⅰ期和ⅡA-B期术后的标准治疗手段,治疗的效果好、生存期长,患者5年无病生存率达90%以上[1-2]。由于睾丸高度放射敏感,低至200 cGy的照射剂量即可导致永久性不育[3-4]。因此,作为年轻男性高发的癌症,如何在放疗过程中对患者健侧正常睾丸进行剂量防护越来越受到人们的关注。使用睾丸防护装置是一种有效的方法,虽然现在有可用于性腺防护的商业产品,但有些是根据处方剂量较高的肿瘤进行放疗而设计,厚重且使用不便,也有许多放疗部门并没有这些特殊的装置可以随时使用。本研究针对精原细胞瘤靶区处方剂量较低的特点,采用放疗常用的低熔点铅材料制作不同厚度的睾丸防护装置,并对其防护效果进行测量,为患者健侧睾丸受照剂量的评估及制作便捷有效的防护装置提供数据参考。
材料与方法1.患者定位及放射治疗计划:选取1例Ⅰ期精原细胞瘤术后患者,采用热塑膜固定,仰卧体位进行螺旋CT扫描,获取定位图像并传至治疗计划系统(Pinnacle 9.8)。勾画临床靶体积(CTV)包括腹主动脉-下腔静脉间隙(上界至T11)、主动脉前区、主动脉旁淋巴结及同侧髂外和髂总淋巴结。CTV左右及前后方向外扩0.8 cm,上下方向外扩1.0 cm形成计划靶体积(PTV)。采用医科达Synergy直线加速器的6 MV X射线为上述患者设计三维适形治疗计划。以CTV几何中心为射野中心点,在射野方向观(BEV)上采用0°和180°前后野对穿设置,两野权重相等。处方剂量为26 Gy,分13次照射,计划完成时95%的PTV体积达到处方剂量。
2.防护铅模制作:先采用高密度(>30 kg/m3)的聚苯乙烯泡沫材料,利用全自动热丝切割机(上海戈瑞公司,GY-CUT2DPRO型)加工一个泡沫盒并用胶带加固,盒内长度为15.0 cm,宽6.6 cm,高6.0 cm。再加工一个实心长方体泡沫块,长14.4 cm,宽6.0 cm,高5.4 cm。将实心泡沫块固定在上述泡沫盒内,四周边缘及底部间隔3 mm,上表面与泡沫盒齐平。确认固定好后浇铸铅模,熔铅的温度为85℃左右。经自然凝固冷却后,取出模具得到厚度为3 mm的低熔点铅防护盒。用锉刀将铅盒打磨光滑并在防护盒窄侧打一圆孔用以插入指形电离室,孔径尺寸略大于电离室直径,如图 1所示。用同样的方法制作5、7、10及15 mm,共5组模具。

|
图 1 防护铅模及体模 A.实验使用的低熔点铅剂量防护盒;B.SZMC_Ⅳ型高仿真人体模型 Figure 1 Protective lead and human body simulation model A. Low melting point lead dose protective box used in experiment; B. SZMC_Ⅳ human body high simulation model |
3.剂量测量:利用苏州大学放射医学院研制的SZMC-Ⅳ型高仿真可拼装的人体模型模拟患者实施射野的照射。参考患者的治疗计划在模体的CT图像上确定出射野的等中心点,利用激光灯在加速器治疗床上对模体进行治疗摆位后,调取上述治疗计划中0°的照射野,卸除健侧腿部结构,采用带平衡帽,灵敏体积为0.6 cm3的指形电离室(TW30013, PTW-Unidos)及剂量计(Farmer 2670A),在距离射野边缘1~25 cm范围内的不同距离测量无挡铅时的吸收剂量。然后将电离室分别插入不同厚度铅防护盒的圆孔中,盒口朝下,测量在具有不同挡铅屏蔽条件下相应距离处的吸收剂量。为了避免铅防护盒进入照射野当中,在其厚度为10和15 mm时分别从距离射野边缘1.5和2 cm时开始测量。在完成0°射野的测量后,再调取治疗计划中180°的射野进行照射,重复上述的剂量测量过程。
4.统计学处理:采用SPSS 16.0软件进行分析,利用线性和非线性回归分析,获取描述非屏蔽和不同厚度挡铅屏蔽睾丸时辐射剂量与测量点离射野边界距离之间关系的公式。
结果1.射野剂量测量结果:精原细胞瘤放疗计划射野的单次照射中,不同厚度低熔点挡铅屏蔽条件下的剂量测量值与测量点离射野边缘距离的关系如图 2所示。与无挡铅屏蔽相比,有挡铅时剂量测量值显著下降,并且随着挡铅厚度的增加,剂量防护的效果更加明显。在同一测量点,无挡铅屏蔽时0°照射野比180°照射野对睾丸散射剂量的贡献更大,而挡铅对0°照射野的屏蔽作用更为明显。
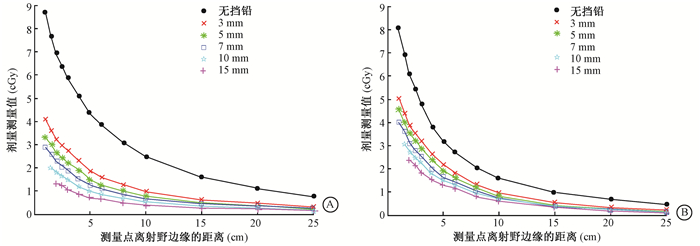
|
图 2 单次照射中不同厚度挡铅屏蔽条件下剂量测量值与测量点离射野边缘距离的关系 A.0°射野;B.180°射野 Figure 2 The relationship between dose measurement value and distance from the edge of the radiation field at different thickness shielding exposed in a single exposure A. field with angle of 0; B. field with angle of 180 |
2.睾丸受照相对于靶区处方剂量(归一化剂量)的计算:不同厚度挡铅屏蔽条件下测量点的相对靶区处方剂量与测量点离射野边缘距离的关系如图 3所示。无挡铅时的测量结果相对于靶区处方剂量,由距离射野边缘1 cm处的8.41%降到25 cm处的0.61%。有3、5及7 mm挡铅时,分别由距离射野边缘1 cm处的4.55%、3.98%及3.47%降到25 cm处的0.27%、0.21%及0.17%。有10 mm挡铅时,由距离射野边缘1.5 cm处的2.55%降到25 cm处的0.15%。有15 mm挡铅时,由距离射野边缘2 cm处的1.86%降到25 cm处的0.13%。随着测量距离的增加,在上述各挡铅厚度条件下的剂量测量结果呈指数形式衰减,归一化剂量以指数函数表示:
| $ \frac{D}{{{D}_{m}}}=S\exp \left( -Kx \right) $ | (1) |
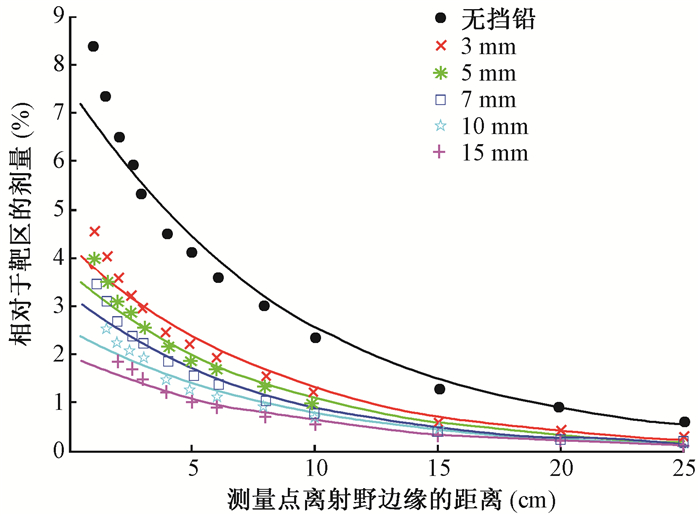
|
图 3 不同厚度挡铅屏蔽条件下测量点相对于靶区处方剂量与测量点离射野边缘距离的关系 Figure 3 The relationship between relative dose of the measurement point to the target and distance from the edge of the radiation field at different thickness shielding |
式中,D为健侧睾丸总的受照剂量,cGy;Dm为靶区处方剂量,cGy;x为健侧睾丸离照射野边界的距离,cm;S和K为拟合参数。不同挡铅厚度条件下归一化剂量的拟合参数见表 1,各曲线的拟合优度R2≥0.982,拟合效果较好。
|
|
表 1 不同挡铅厚度时射野外归一化剂量拟合参数 Table 1 Normalized dose fitting parameters outside the field at different thickness shielding |
3.精原细胞瘤术后放疗睾丸防护中低熔点挡铅厚度的选择:表 2所示为Ⅰ~ⅡB期精原细胞瘤术后放疗中腹主动脉旁照射野以及腹主动脉旁及同侧髂血管淋巴引流区照射野(狗腿野)在标准处方剂量下,无挡铅和有一定厚度挡铅时健侧睾丸的受照剂量,其中挡铅的厚度选择为将睾丸受照剂量降低至0.5 Gy以下。由表 2可见睾丸剂量的计算值与测量值很接近,公式(1)能比较准确地计算睾丸在无挡铅和有类似防护装置条件下的受照剂量。
|
|
表 2 精原细胞瘤术后放疗照射野在不同靶区处方剂量及挡铅屏蔽条件下健侧睾丸的受照剂量 Table 2 Dose of contralateral testis in different prescription dose and blocking shield of postoperative irradiation field for seminoma |
讨论
睾丸生殖细胞瘤是20~35岁男性青壮年最常见的恶性肿瘤,其中睾丸精原细胞瘤占睾丸生殖细胞瘤的一半。作为年轻男性高发的癌症之一,肿瘤切除是其首要的诊断和治疗手段,放射治疗是Ⅰ期和ⅡA-B期精原细胞瘤术后的标准治疗,照射野包括腹主动脉旁及同侧髂血管淋巴引流区。由于睾丸高度放射敏感,较低的受照剂量即可导致不育,从而使患者生活质量受到严重损害。放射治疗对雄性性腺功能的损伤是剂量依赖性的,在接受电离辐射后,精原细胞的干细胞在修复,再生和补偿方面的能力非常有限,这是精子的产生对男性性腺低剂量辐射极高灵敏度的原因。有文献报道,低至150 cGy的性腺剂量即可导致永久性的无精子症[5]。在睾丸接受了100~150 cGy剂量的患者中,观察到精子细胞的产生可部分恢复[5-6],而接受 < 100 cGy的剂量时,精子的产生可以完全恢复[5, 7]。
在放射治疗中,睾丸受到的辐射剂量主要包括外部和内部的散射剂量。外部散射主要由加速器机头漏射线,准直器、均整器等装置和空气的散射产生,内部散射在患者体内产生并占有显著的剂量贡献。因此,在实际放疗过程中靶区的处方剂量,射线的能量,照射野的大小与形状,睾丸离射野边界的距离,照射部位的体厚,有无防护装置等都会对睾丸受到的剂量产生影响。Ravichandran等[8]采用1.5 cm厚的类似屏蔽对采用15 MV的X射线治疗的精原细胞瘤患者进行防护,发现在距离射野边界3及7.5 cm处,采用0.6 cm3电离室测得的散射剂量分别为处方剂量40 Gy的1.7%和0.8%。Bieri等[9]利用热释光剂量计测量了27例Ⅰ期和2例ⅡA期精原细胞瘤患者接受放疗时睾丸的受照剂量。放疗采用6 MV的X射线前后对穿照射,单次剂量为1.8 Gy。结果显示,在腹主动脉旁和同侧髂外淋巴结照射时,无屏蔽和有1.5 cm厚低熔点挡铅屏蔽条件的单次照射中睾丸平均受照剂量分别为3.89和1.48 cGy,在单纯腹主动脉旁照射时分别为1.86和0.65 cGy。指出即使是采用单纯的腹主动脉旁照射的患者,也能从性腺的剂量屏蔽中获益。Mazonakis等[10]测量了腹主动脉旁照射野及“狗腿野”的射野边界离患者睾丸的距离范围分别为13.0~14.5和6.0~9.0 cm,并利用电离室在模体中测量了6 MV的X射线照射野,在无屏蔽及有1.3 cm厚挡铅屏蔽条件下的吸收剂量。结果显示,在15 cm×39 cm的“狗腿野”照射中,距离射野边界4 cm处上述两种条件下测量的相对靶区剂量分别为4.30%和1.45%。本研究中,该处测量无屏蔽的剂量测量结果为4.53%,采用1.0和1.5 cm厚度挡铅屏蔽时测量结果分别为1.49%和1.20%,与Mazonakis等[10]获得的剂量范围近似但略高于Bieri等[9]的测量结果。这可能与剂量测量工具有关,本研究和Mazonakis等[10]都采用电离室,而Bieri等[9]采用的是热释光剂量计。
腹主动脉旁和同侧盆腔照射是Ⅰ期睾丸精原细胞瘤的标准治疗手段,照射剂量为20~26 Gy,除既往有睾丸下降不全、盆腔手术史、腹股沟区和阴囊手术史的患者,单纯的腹主动脉旁照射可以取得和腹主动脉旁盆腔照射野同样的效果,且不良反应较低。ⅡA-B期睾丸精原细胞瘤术后放疗采用腹主动脉旁和盆腔野照射,照射剂量30 Gy后缩野,对肿瘤部位补量至36 Gy[2]。参考Mazonakis等[10]的距离测量结果,并考虑到东西方人种的形体差别,本研究着重分析了靶区处方剂量为26 Gy并且距离射野边界为10(腹主动脉旁照射野)和4 cm(腹主动脉旁及同侧盆腔照射野),以及靶区处方剂量为36 Gy并且距离射野边界为4 cm这几种条件下,将睾丸受照剂量屏蔽至0.5 Gy以下所需低熔点挡铅的厚度。
本研究所采用的低熔点铅是一种熔点低的轻质合金,能加工成各种不规则形状且可回收重新制作,适合日常临床使用。需要指出的是,上述在不同厚度挡铅屏蔽条件下睾丸受照剂量与射野边界之间关系的计算方法限于医用加速器6 MV X射线的测量结果,进一步的研究将把本工作扩展到具有较高能量的X射线束。同时,在实际的临床治疗中,可调整挡铅防护装置的形状,并将其内表面附上蜡质层以提高患者治疗时的舒适度。
总之,治疗Ⅰ~ⅡB期精原细胞瘤的挑战是保持目前高的治愈率,同时降低治疗不良反应,特别是对年轻的、有生育愿望的患者。在放射治疗前,性腺的防护应被视为评估降低睾丸精原细胞瘤治疗风险的重要措施,有效的防护使得睾丸受照剂量降低可能不仅限于减少无精子症的严重程度和持续时间,还可以使剂量相关的遗传异常最小化。
利益冲突 本研究接受苏州市科技计划项目(SS201642, SZS201509)资助。所有作者均于投稿前阅读并认可本研究内容,本研究不存在任何潜在的利益冲突作者贡献声明 严利明负责实验数据处理并起草论文;周钢和孙彦泽负责放疗计划设计及审核;陈烈松负责验证体模制作、治疗方案的实施以及论文写作指导;邹莉负责患者图像扫描和采集数据;田野负责制定患者治疗方案,并指导论文写作
| [1] |
Mead GM, Fossa SD, Oliver RT, et al. Randomized trials in 2466 patients with stage Ⅰ seminoma:patterns of relapse and follow-up[J]. J Natl Cancer Inst, 2011, 103(3): 241-249. DOI:10.1093/jnci/djq525 |
| [2] |
殷蔚伯, 余子豪, 徐国镇, 等. 肿瘤放射治疗学[M]. 4版, 北京: 中国协和医科大学出版社, 2008, 921-931. Yin WB, Yu ZH, Xu GZ, et al. Radiation oncology[M]. 4th ed. Beijing: Peking Union Medical College Press, 2008, 921-931. |
| [3] |
Singhal MK, Kapoor A, Singh D, et al. Scattered radiation to gonads:role of testicular shielding for para-aortic and homolateral illiac nodal radiotherapy[J]. J Egypt Natl Canc Inst, 2014, 26(2): 99-101. DOI:10.1016/j.jnci.2014.03.002 |
| [4] |
Chao KS, Perez CA, Brady LW. In radiation oncology: management decisions[M]. 2nd ed. Philadelphia: Lippincot Williams and Wilkins, 2002.
|
| [5] |
Greiner R. Spermatogenesis after fractionated, low-dose irradiation of the gonads[J]. Strahlentherapie, 1982, 158(6): 342-355. |
| [6] |
Hansen PV, Trykker H, Svennekjaer IL, et al. Long-term recovery of spermatogenesis after radiotherapy in patients with testicular cancer[J]. Radiother Oncol, 1990, 18(2): 117-125. DOI:10.1016/0167-8140(90)90137-L |
| [7] |
Shanei A, Baradaran-Ghahfarokhi M. Evaluation of testicular dose and associated risk from common pelvis radiation therapy in Iran[J]. Phys Med, 2014, 30(8): 867-870. DOI:10.1016/j.ejmp.2014.06.038 |
| [8] |
Ravichandran R, Binukumar JP, Kannadhasan S, et al. Testicular shield for para-aortic radiotherapy and estimation of gonad doses[J]. J Med Phys, 2008, 33(4): 158-161. DOI:10.4103/0971-6203.44477 |
| [9] |
Bieri S, Rouzaud M, Mirabell R. Seminoma of the testis:is scrotal shielding necessary when radiotherapy is limited to the para-aortic nodes?[J]. Radiother Oncol, 1999, 50(3): 349-353. DOI:10.1016/S0167-8140(99)00023-7 |
| [10] |
Mazonakis M, Kokona G, Varveris H, et al. Data required for testicular dose calculation during radiotherapy of seminoma[J]. Med Phys, 2006, 33(7): 2391-2395. DOI:10.1118/1.2208936 |
 2018, Vol. 38
2018, Vol. 38


