2. 310022 杭州, 浙江省肿瘤医院放疗科
2. Department of Radiation Oncology, Zhejiang Cancer Hospital, Hangzhou 310022, China
鼻咽癌(nasopharyngeal carcinoma, NPC)是头颈部常见的恶性肿瘤,高发于我国南部地区,据估计,2015年鼻咽癌在我国发病达60 600人次,总体预后良好[1]。鼻咽癌通常采取放化疗综合治疗[2]。初诊时,鼻咽癌患者以T3、T4多见[3-4],颞叶及其内侧的海马结构(hippocampus formation, HF)受照剂量较高。颞叶是实现记忆功能的重要脑叶,其内侧的海马和邻近皮质在信息获取、存储和检索中起到关键性作用,对放疗敏感,鼻咽癌患者放疗后出现记忆等认知功能障碍[5],可能与这两者受到较高剂量照射有关。鼻咽癌患者5年生存率可达80%[3-4],治疗后的生活质量值得重视。故本研究对接受放疗的鼻咽癌患者进行数字广度测试及脑磁共振随访,现将结果进行如下报道。
资料与方法1.一般临床资料:搜集于2015年11月至2016年8月于浙江省肿瘤医院进行治疗的14例鼻咽癌患者资料。男性8名,女性6名,年龄18~57岁,中位年龄37岁。所有患者KPS评分≥90。根据国际抗癌联盟(UICC)2002版分期,T2 1例,T3 7例,T4 6例。其中,9例患者靶区可进行海马及颞叶靶区剂量统计,10名患者在放疗前及放疗后3个月接受数字广度测试,9例患者进行结构MRI检查。患者详细资料见表 1。
|
|
表 1 患者临床特点及治疗情况 Table 1 The characteristics of patients and treatment |
2.治疗情况:根据2010鼻咽癌调强放疗靶区及剂量设计指引专家共识勾画靶区,原发肿瘤体积GTVnx和阳性淋巴结GTVnd定义为CT和MR协同分析后的可见肿瘤。GTV外扩0.5 cm边界并包括鼻咽黏膜定义为CTV1。CTV2定义为CTV1外扩0.5 cm边界并包括鼻腔后部、上颌窦后部、翼腭窝、咽旁间隙、颅底、部分后组筛窦、部分颈椎和斜坡,加上双侧非浸润淋巴引流区(咽后及咽旁淋巴结,Ⅱ~Ⅴ组颈淋巴引流区),如果ⅠB有阳性淋巴结或Ⅱ区淋巴侵犯严重,则ⅠB组也包括在CTV2内。PTVnx、PTVnd、PTV1和PTV2的处方剂量分别为7 040、6 880、6 400和5 440 cGy,32次分割[6]。脑干、视交叉和视神经的限量均为54 Gy。颞叶、下颌骨、颞颌关节和颈髓限量分别为60、65、65和45 Gy。双侧腮腺50%体积值的限量分别为30 Gy。内耳/中耳、眼球、眼晶状体和喉软骨的限量分别为50、35、9和45 Gy。患者接受CT模拟定位(层厚3 mm,重建为1 mm)后,在相同体位下接受脑MRI(层厚1.25~1.5 mm),将脑MRI与CT模拟定位图像相融合。根据美国肿瘤放射治疗协作组(RTOG) 0933海马靶区勾画标准,在脑MRI T1加权相进行海马勾画[7]。14例患者均接受同步放化疗,具体治疗见表 1。
3.随访测试:患者在放疗前、放疗后以及每3个月随访时,都尽量完成中国修订版韦氏智力测试量表(WAIS-CR)中的数字广度测试及结构磁共振成像。WAIS-CR言语测试中的数字广度测试包括14个测题,过程为主试者读出一个2~9位的随机数字,要求被试者顺背或倒背,两者分别进行,顺背从3位数字至9位数字,倒背从2位数字到8位数字,按最高通过位数计加和分,记录为正背分、倒背分。结构MRI数据的采集使用T1加权成像方法在西门子Verio 3.0 T的核磁共振扫描仪上完成。扫描方向沿矢状位方向进行。扫描参数如下:TR/TE 13/3.4 ms,翻转角(FA) 25°,视野(FOV) 240 mm×240 mm,层数144,扫描矩阵256×256,体素大小0.937 5 mm×0.937 5 mm×1 mm。
4.颞叶及海马区域剂量获取:采用RayStation 4.0v (RaySearch Laboratories AB)进行放疗计划设计,利用剂量体积直方图(DVH)获取颞叶及海马区域剂量,记为颞叶最大剂量Dmax,颞叶平均剂量Dmean,海马区最大剂量Dmax,海马区平均剂量Dmean,并记录海马体积及颞叶体积。根据公式,计算得出生物等效均衡剂量(EUD)。公式意为对DVH中剂量二进制(vj, Dj)剂量微分求和,其中a∈(1,∞)。据以往文献,脑组织中,a取值为5[8]。
| $ \rm{EUD}={{\left( \sum\limits_{j}{{{v}_{j}}D_{j}^{a}} \right)}^{\frac{1}{a}}} $ | (1) |
5.图像处理及分析方法:采用基于Matlab的VBM(VBM8, http://dbm.neuro.uni-jena.de/VBM/)软件包进行预处理。检查每个受试者的扫描伪迹及解剖结构,手动矫正图像原点为前联合-后联合位(anterior commissure-posterior commissure, AC-PC)。采用SPM8中的“new segment”精确分割出灰质,将所有受试者的MR图像配准至模板图像,进行空间标准化处理;再应用三维高斯核进行图像的平滑处理。将脑图像变换到标准脑空间,通用采用的蒙特利尔学神经研究所(Montreal Neurological Institute, MNI)的坐标系统,每个像素点位置坐标用x、y、z显示,坐标单位为mm,然后逐体素进行分析。
6.统计学处理:图像灰度比较采用VBM软件两样本t检验进行比较,P<0.005 (未校正)为差异有统计学意义,据此选取相邻体素(voxels)>30个的像素簇(cluster)视为有差异的脑区。记忆量表分析采用SPSS 23.0软件。数据符合正态分布,用x±s表示。采用独立样本t检验比较记忆量表分析结果。P < 0.05为差异有统计学意义。
结果1.颞叶及海马区域剂量分析:剂量学可分析资料者9例,根据实际情况,采用7~9野调强放疗技术(IMRT),海马Vmean(15.17±2.17)cm3,颞叶Vmean(95.07±12.26)cm3,海马Dmean(1 154.06±771.63) cGy,颞叶Dmean(1 306.61±603.69)cGy,海马Dmax(3 797.61±1 450.98)cGy,颞叶Dmax(5 394.17±982.28)cGy,海马EUD(2 233.28±872.73)cGy,颞叶EUD(3 113.11±603.69)cGy。
2.记忆量表分析:10名患者在放疗前及放疗后3个月接受数字广度测试。放疗前正背、倒背均值分别为8.8±1.8和6.2±1.04,放疗后正背、倒背均值分别为8.1±1.59和5.3±2.36,放疗前后倒背均值差异有统计学意义(t=3.25, P < 0.05)。
3.结构脑磁共振分析:对9例进行磁共振随访的患者的T1加权的结构像数据进行基于体素的形态学测量分析。对两组患者的灰质图像进行全脑逐点统计。放疗后患者组较放疗前患者组,双侧颞叶均观察到局部灰质体积萎缩,表 2中显示为相应脑区体积萎缩区峰值处的t值,及其在MNI坐标系中的位置,图 1显示为相应体积萎缩脑区在脑磁共振图像中的位置,每个颜色与t值相对应,并在图像中显示(表 2和图 1,P < 0.005, 未校正,像素簇>30)。
|
|
表 2 放疗后较放疗前颞叶灰质脑区减少区域 Table 2 Regions of grey matter reduced in temporal lobe before-and post-radiotherapy |
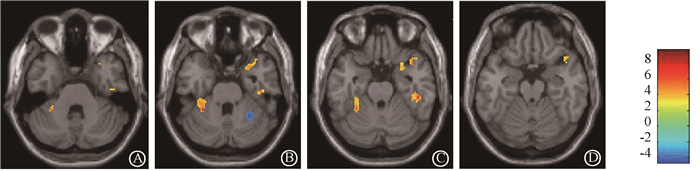
|
图 1 放疗后较放疗前灰质脑区减少区域的统计参数图 A~D分别为灰质改变的不同层面 注:红色、黄色区域为放疗后海马旁回、颞叶较放疗前灰质体积减少的区域,蓝色区域为放疗后其他脑区较放疗前灰质体积增加的区域。不同颜色所对应的数值为t值。像素簇cluster size>30,P<0.005,未校正 Figure 1 Statistical parametric mapping of regions of grey matter reduced in temporal lobe before-and after-radiotherapy A-D.Representing grey matter changes on different slides |
讨论
过去鼻咽癌患者采用二维放疗,常造成口干、张口困难、放射性脑损伤(radiation encephalopathy, REP)等远期反应[9-10]。随着IMRT等三维放疗技术的应用,以及化疗、靶向药物的综合使用,鼻咽癌患者的生存得到进一步提高,5年生存率可达80%以上[3-4],其生活质量更值得重视。相较于二维放疗,IMRT技术可以使靶区剂量更均匀,并形成陡峭的剂量梯度,极大减少正常组织受量。在目前放疗技术下,由影像学诊断得出的REP已大大降低,但仍有患者出现记忆等认知功能损害。推测这可能与某些与认知功能相关的关键脑组织受到照射有关,并且该种损伤具有一定隐蔽性,常规检查难以检出。
海马结构位于端脑颞叶内侧深面,与颞叶解剖关系紧密。由于局部晚期鼻咽癌侵犯颅底,放疗时颞叶及海马区域仍受到较高的剂量。苏胜发等[9]对870名接受IMRT鼻咽癌患者资料进行分析,发现T3-4期患者中,颞叶最大受照剂量达57.2~84.9 Gy,平均剂量达6.2~34.8 Gy。吴晨彬等[11]分析59例鼻咽癌患者海马受照剂量,发现T3-4期海马最大剂量及平均剂量分别为(40.8±9.4)和(12.5±5.1) Gy。本研究结果显示,颞叶及海马组织的最大剂量约为54和38 Gy,平均剂量约为13和12 Gy,海马及颞叶组织均受到不低的照射剂量。一般而言,器官受到的照射剂量是不均匀的,EUD的定义为对于两种能够产生相同生物学效应的剂量分布,它们在放射生物学效应是一样的。将实际不均匀受照剂量转化为EUD,使得不同器官间的剂量有了可比性。本研究中,海马及颞叶的平均剂量相似,经剂量公式转化后,颞叶EUD明显高于海马,这与其后的VBM结果中颞叶损伤更明显的结果相符合。
几项在肺癌脑部照射开展的临床试验表明,脑部放疗患者记忆功能降低可能与海马区域受到照射存在一定联系。RTOG 0212及RTOG 0214分别评估了全脑预防照射对肺癌患者认知功能的影响,两项研究分别在全脑总剂量36 Gy组和30 Gy组观察到了霍普金斯词汇学习测验(Hopkins verbal learning test,HVLT)明显异常[12]。RTOG 0933是一项单臂Ⅱ期多中心临床试验,对接受全脑放疗的脑转移瘤患者进行海马保护,结果表明,进行HA-WBRT组的HVLT结果明显低于历史对照组[7]。海马结构所在的海马环路(Papez环路),与学习、记忆等高级精神活动密切相关。大量研究表明,人体中长期存在神经形成活动,形成的神经前体细胞及新的神经元对维持学习记忆等具有重要作用。成人大脑中只有少数几个区域能够产生新的神经元,这包括室下区(subventricular zone, SVZ)、纹状体和海马齿状回的颗粒细胞亚区(SGZ)[13]。有研究对小鼠进行1、2、5、10 Gy脑部照射,10 Gy组在受照后12 h,SGZ的增殖细胞减少了75%,不成熟神经元减少了36%,提示SGZ细胞对射线敏感[14]。本研究撷取WAIS-CR中数字广度评分测试得分进行分析,结果显示,放疗后3个月较放疗前倒背得分有所降低,差异具有统计学意义,提示患者记忆功能一定程度受损。
基于体素的形态学测量方法(voxel-based morphometry,VBM)是一种全自动分析技术,该技术通过定量计算局部灰质体素的大小及信号强度,可以客观地对大脑结构改变进行分析,自20世纪90年代以来,VBM技术主要应用于神经病学及精神病学领域[15]。本研究中,受试者的常规磁共振影像并未发现明显脑部结构异常,采用VBM方法对结构磁共振图像进行分析,可以观察到双侧颞叶的局部灰质体积萎缩(P < 0.005)。随着放疗技术的进展,虽然严重的放射性脑损伤已不常见,但放疗仍可对脑部造成损伤,该种放射脑损伤具有一定的隐蔽性,在一定程度上影响生活质量。
本研究为一项回顾性研究,利用数字广度测试及VBM分析,从不同方面阐释头颈部放疗患者脑部关键组织受到照射后脑功能受损的不同临床表现。但由于量表测试患者配合度存在一定差异,结构像磁共振分析在临床上并未成为常规,本研究尚未得到大样本的数据,虽然能在一定程度上说明两者联系,但研究结果仍存在局限性,同时,不同T分期及化疗方案是否也是相关的影响因素还需进一步扩大样本量、细化分析,采用功能磁共振分析及开展前瞻性研究将成为下一步研究目标。
综上,可以初步得出结论,局部晚期鼻咽癌患者接受放疗,海马及颞叶均不可避免受到照射。放疗后,记忆功能部分受损,双侧部分颞叶等关键脑组织体积萎缩,两者间可能存在一定相关性,需进一步扩大样本量研究。
利益冲突 本研究受浙江省医药卫生科技项目(2018250455)和浙江省医药卫生科技计划平台项目(2013RCA007)支持。所有研究者,未因进行该研究而接受任何不正当的职务或财务利益,在此对研究的独立性和科学性予以保证作者贡献声明 谢铁明负责设计研究方案,收集数据后统计并起草论文;孔月、石磊、黄爽、花永虹、胡巧英、金厅、陈晓钟负责数据收集和文章校对;杜锋磊负责放疗计划设计和整理;陈媛媛指导、监督试验并修改论文
| [1] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [2] |
刘孟忠. 鼻咽癌治疗新进展[J]. 广东医学, 2014, 35(1): 1-4. Liu MZ. New progress in the treatment of nasopharyngeal carcinoma[J]. Guangdong Med J, 2014, 35(1): 1-4. |
| [3] |
Sun X, Su S, Chen C, et al. Long-term outcomes of intensity-modulated radiotherapy for 868 patients with nasopharyngeal carcinoma:an analysis of survival and treatment toxicities[J]. Radiother Oncol, 2014, 110(3): 398-403. DOI:10.1016/j.radonc.2013.10.020 |
| [4] |
赵充, 肖巍魏, 韩非, 等. 419例鼻咽癌患者调强放疗疗效和影响[J]. 中华放射肿瘤学杂志, 2010, 19(3): 191-196. Zhao C, Xiao WW, Han F, et al. Long-term outcome and prognostic factors of patients with nasopharyngeal carcinoma treated with intensity-modulated radiation therapy[J]. Chin J Radiat Oncol, 2010, 19(3): 191-196. DOI:10.3760/cma.j.issn.1004-4221.2010.03.005 |
| [5] |
Ma Q, Wu D, Zeng LL, et al. Radiation-induced functional connectivity alterations in nasopharyngeal carcinoma patients with radiotherapy[J]. Medicine (Baltimore), 2016, 95(29): e4275. DOI:10.1097/MD.0000000000004275 |
| [6] |
中国鼻咽癌临床分期工作委员会. 2010鼻咽癌调强放疗靶区及剂量设计指引专家共识[J]. 中华放射肿瘤学杂志, 2011, 20(4): 267-269. Chinese Nasopharyngeal Carcinoma Clinical Staging Committee. Expert consensus on planned area of intensity modulated radiation thearapy and dose design guidelines for nasopharyngeal carcinoma, 2010[J]. Chin J Radiat Oncol, 2011, 20(4): 267-269. DOI:10.3760/cma.j.issn.1004-4221.2011.04.001 |
| [7] |
Gondi V, Pugh SL, Tome WA, et al. Preservation of memory with conformal avoidance of the hippocampal neural stem-cell compartment during whole-brain radiotherapy for brain metastases (RTOG 0933):a phase Ⅱ multi-institutional trial[J]. J Clin Oncol, 2014, 32(34): 3810-3816. DOI:10.1200/JCO.2014.57.2909 |
| [8] |
Bodensohn R, Söhn M, Ganswindt U, et al. Hippocampal EUD in primarily irradiated glioblastoma patients[J]. Radiat Oncol, 2014, 9: 276. DOI:10.1186/s13014-014-0276-5 |
| [9] |
苏胜发, 黄莹, 韩非, 等. 鼻咽癌调强放疗后放射性脑损伤的临床特征分析[J]. 中华放射医学与防护杂志, 2012, 32(1): 60-64. Su SF, Huang Y, Han F, et al. Clinical characteristics with radiation encephalopathy after intensity-modulated radiotherapy in nasopharyngeal carcinoma patients:analysis of 42 cases[J]. Chin J Radiol Med Prot, 2012, 32(1): 60-64. DOI:10.3760/cma.j.issn.0254-5098.2012.01.015 |
| [10] |
Su SF, Huang Y, Xiao WW, et al. Clinical and dosimetric characteristics of temporal lobe injury following intensity modulated radiotherapy of nasopharyngeal carcinoma[J]. Radiother Oncol, 2012, 104(3): 312-316. DOI:10.1016/j.radonc.2012.06.012 |
| [11] |
吴晨彬, 吴君心, 徐鹭英, 等. 鼻咽癌调强放疗对海马结构的剂量影响分析[J]. 中华放射医学与防护杂志, 2012, 32(3): 297-300. Wu CB, Wu JX, Xu LY, et al. Dosimetric study of influence of intensity modulated radiotherapy for nasopharyngeal carcinoma on hippocampal formation[J]. Chin J Radiol Med Prot, 2012, 32(3): 297-300. DOI:10.3760/cma.j.issn.0254-5098.2012.03.019 |
| [12] |
Gondi V, Paulus R, Bruner DW, et al. Decline in tested and self-reported cognitive functioning after prophylactic cranial irradiation for lung cancer:pooled secondary analysis of Radiation Therapy Oncology Group randomized trials 0212 and 0214[J]. Int J Radiat Oncol Biol Phys, 2013, 86(4): 656-664. DOI:10.1016/j.ijrobp.2013.02.033 |
| [13] |
Lazarov O, Hollands C. Hippocampal neurogenesis:Learning to remember[J]. Prog Neurobiol, 2016, 138-140: 1-18. DOI:10.1016/j.pneurobio.2015.12.006 |
| [14] |
Mizumatsu S, Monje ML, Morhardt DR, et al. Extreme sensitivity of adult neurogenesis to low doses of X-irradiation[J]. Cancer Res, 2003, 63(14): 4021-4027. |
| [15] |
Ashburner J, Friston KJ. Voxel-based morphometry-the methods[J]. Neuroimage, 2000, 11(6 Pt 1): 805-521. DOI:10.1006/nimg.2000.0582 |
 2018, Vol. 38
2018, Vol. 38


