我国是结直肠癌高发国家,发病率和死亡率均占所有恶性肿瘤的第5位[1]。术前放化疗可以起到降低肿瘤分期、提高完整切除率、增加保肛率、降低术后复发率的作用,已成为局部晚期直肠癌的标准治疗手段。随着精确放疗时代的到来,现有的放疗技术可以按照靶区的形状给予肿瘤高剂量的照射,同时最大限度地减少周围正常组织的剂量。而精确放疗计划实施的前提就是对肿瘤范围的正确判断和精准的靶区勾画。
目前的放疗计划系统(TPS)多基于CT影像进行靶区勾画,但是CT对密度值相近的盆腔软组织区分度不佳。磁共振成像(magnetic resonance imaging,MRI)具有软组织分辨率高的优点,有助于判断肿瘤与正常肠壁、肛提肌和肛门括约肌等的关系。因此,MRI定位的应用可能会提高直肠癌靶区勾画的准确性。本研究通过分别在CT和MRI两种定位图像上进行直肠癌大体肿瘤靶区(gross tumor volume,GTV)勾画,比较两组GTV的差异,并统计应用CT-MRI融合定位制定放疗计划后放疗不良反应发生情况及病理完全缓解(pathological complete response,pCR)率来探讨MRI定位技术在局部晚期低位直肠癌术前放疗中的应用价值。
资料与方法1.研究对象:选取2016年5月—2017年6月本院放疗科收治的局部晚期低位直肠癌患者40例。男性22例,女性18例,中位年龄58 (31~80)岁。纳入标准:经结肠镜及组织病理活检诊断为直肠腺癌;临床分期为Ⅱ~Ⅲ期[美国癌症联合委员会(AJCC)第7版分期];肛门指诊提示肿瘤下界距肛缘≤5 cm(所有患者均由同一位医师进行肛门指诊并记录数据);体力状况评分0~1分;白细胞≥4.0×109/L,血红蛋白≥90 g/L,血小板≥100×109/L,肝肾功能正常;无盆腔放疗史。排除标准:身体内有金属不宜行MRI;MRI扫描体位与CT扫描体位明显不一致者;有明显伪影者。本研究经过医院伦理委员会论证,所有患者均签署了知情同意书。
2. CT/MRI定位扫描方法
(1) 定位前准备:定位前1 h排空膀胱和直肠,对于排便不畅者,使用开塞露或乳果糖口服液等药物。排空后饮入含20 ml碘海醇的1 000 ml水以显影小肠,并使膀胱充盈。
(2) 体位固定:按调强放疗体位要求进行体位固定。患者仰卧于治疗床,双手抱肘,置于额上,用热塑料体膜固定于定位床板(pelvicast base plate,35781-N1,比利时Orfit公司)上。使用3D激光灯确定参考点位置,以十字交叉线标记在体膜表面。
(3) CT定位扫描:CT定位扫描由40排螺旋CT扫描机(德国西门子公司)完成。扫描基线垂直于水平面,扫描范围:从第二腰椎上缘到股骨中段水平,层厚5 mm逐层扫描。增强采用自动注射(美国Medrad公司产品)以3.0 ml/s的速度静脉注射碘海醇(1.0 ml/kg, 30 g碘海醇/100 ml),35 s后进行图像采集。
(4) MRI定位扫描:CT定位扫描完成后随即进行核磁定位扫描。核磁定位扫描由Magnetom Skyra 3.0T超导型磁共振成像系统(德国西门子公司)完成,定位前准备、扫描体位及固定装置与CT定位时保持一致。扫描基线与水平面垂直。扫描范围:第3腰椎上缘至会阴,扫描层厚同样为5 mm,不使用增强对比剂。扫描序列为T2加权序列(体素大小为1.1 mm×1.1 mm×5.0 mm, 重复时间4 000.0 ms, 回波时间107.0 ms)、弥散加权序列(b值50 800)。
3.图像融合方法:扫描完成后,将定位图像传输至美国瓦里安Eclipse计划系统(TPS 11.0)。图像融合由相应软件进行,先采取手动匹配,选择源图像(平扫CT)和目标图像(MRI T2WI序列)根据人体解剖标志(首选骨性标志)分别在横断面、矢状面、冠状面进行初步匹配。然后点击自动匹配按钮,由软件自动完成各个方向的精细匹配。配准效果由本科副主任及以上的医师进行判定,排除体位相差大、有伪影的配准图像。CT、MRI定位图像及配准效果如图 1所示。
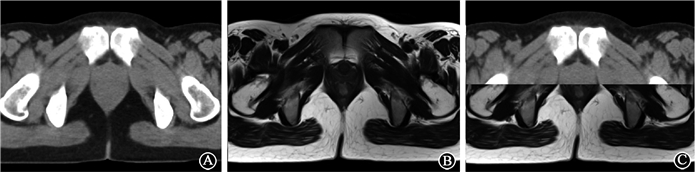
|
图 1 CT、MRI定位图像及CT-MRI图像融合效果 A.CT定位图像,由于组织密度相近,无法判断肿瘤是否浸润肛管,以及肿瘤和周围组织的分界;B.MRI定位T2WI图像,可以看到高信号的肿瘤组织浸润肛管,肿瘤和肛门外括约肌及阴道界限清晰;C. CT-MRI图像融合效果 Figure 1 CT, MRI simulation image and CT/MRI fusion A. CT simulation image, it is difficult to determine the existence of anal canal invasion and distinguish tumor from surrounding normal tissues because of similar tissue density; B. MRI T2WI simulation image, tumor of high signal with anal canal infiltration is visible and the boundaries between the tumor and the external anal sphincter and vagina are clear; C. CT/MRI fusion |
4.靶区勾画:由两名从业直肠癌放疗专业的医生分别在两种定位图像下进行直肠原发肿瘤GTV的勾画。GTVCT在平扫和增强CT定位的融合图像上进行勾画,最终在平扫CT图像上进行修正,采用的窗宽为400 HU, 窗位为40 HU。GTVMRI在MRI定位的T2WI序列上进行勾画。勾画靶区时除了参照定位图像,也要参考肠镜、影像科的诊断核磁和肛门指诊结果。勾画完成后由两位副主任以上医师分别审核。通过TPS分别计算得出GTVCT、GTVMRI的长度、体积以及GTV下界距离肛缘的距离。临床肿瘤靶区(clinical tumor volume, CTV)勾画原则参照2009年美国肿瘤放射治疗协作组织(Radiation Therapy Oncology Group, RTOG)靶区勾画共识[2],GTVMRI三维外扩5 mm形成计划大体肿瘤靶区(planning gross tumor volume, PGTV),CTV三维外扩5 mm形成计划肿瘤靶区(planning tumor volume, PTV)。
5.放化疗计划实施:应用TPS制定放疗计划,采用调强放疗技术,处方剂量为95%PGTV 50.6 Gy,95%PTV 41.8 Gy/22次,同步化疗方案为卡培他滨825 mg/m2,2次/d,放疗日服用。放疗期间每周复查一次血常规,同时记录患者放射性直肠炎、小肠炎、泌尿系统反应、皮肤反应发生情况。根据RTOG急性放射反应评价标准进行不良反应分级。
6.肿瘤退缩分级评价:放疗结束6~8周复查盆腔核磁,并转至胃肠外科行手术治疗。记录40例患者术后病理所示肿瘤退缩分级(tumor regression grading, TRG)情况。分级标准参照2013版美国国家综合癌症网络(NCCN)结直肠癌指南:0级(完全反应):无活的癌细胞残留;1级(中度反应):单个或小簇癌细胞残留;2级(轻度反应):残留癌灶,间质纤维化;3级(反应不良):仅少数或未见癌细胞消退。
7.统计学处理:计量资料采用x±s表示,采用SPSS 19.0软件进行分析。组间差异比较经正态性检验符合正态分布,采用配对t检验。P < 0.05为差异有统计学意义。
结果1.患者特征:通过肛门指诊测量肿瘤距肛门的平均距离为(3.72±0.93)cm。盆腔MRI检查提示,11例患者病灶下缘超过肛提肌和直肠交界水平,10例接近肛提肌和直肠交界水平,其余19例肿瘤下缘距肛提肌和直肠交界水平均≤2 cm。根据AJCC第7版结直肠癌分期标准,T3期38例,T4B期2例,N0期2例,N1期3例,N2A期15例,N2B期20例。
2. GTVCT、GTVMRI的长度比较:28例(70%)患者GTVCT的长度大于GTVMRI,11例(26.5%)GTVCT的长度等于GTVMRI,仅有1例(2.5%)患者GTVMRI的长度大于GTVCT。GTVCT的平均长度为(5.21±1.65)cm,长于GTVMRI的(4.46±1.51) cm,差异有统计学意义(t=5.059,P < 0.05,表 1)。
|
|
表 1 GTVCT、GTVMRI的差异比较(x±s) Table 1 Comparison of the differences between GTVCT and GTVMRI(x±s) |
3.GTVCT、GTVMRI的体积比较:36例(90%)患者的GTVCT体积大于GTVMRI,仅有4例(10%)患者的GTVCT体积略小于GTVMRI。GTVCT与GTVMRI的体积比为1.33±0.29。GTVCT的平均体积为(55.71±31.57)cm3,大于GTVMRI的平均体积(44.02 ±25.11)cm3,差异有统计学意义(t=6.977,P < 0.05,表 1)。
4.GTVCT、GTVMRI下界距肛缘的距离:25例(62.5%)患者GTVCT下界距肛缘的距离小于GTVMRI,12例(30%)患者两者相等,仅有3例(7.5%)患者GTVCT下界距肛缘的距离略大于GTVMRI。GTVCT下界距肛缘的距离的均值(3.18±1.06)cm,明显小于GTVMRI下界距肛缘的距离(3.66±0.98)cm (t=-5.503,P < 0.05,表 1)。通过肛门指诊判断的肿瘤下界距肛缘的平均距离为(3.72±0.93)cm,大于GTVCT下界距肛缘的距离(t=4.539,P < 0.05),但与GTVMRI有较高的一致性(P>0.05,表 2)。
|
|
表 2 肛门指诊示肿物下界距肛缘的距离与GTVCT、GTVMRI下界距肛缘的距离比较(cm) Table 2 Comparison of the distance of distal tumor to the anal verge on digital examination with distance of lower bound of GTVCT and GTVMRI to the anal verge(cm) |
5.放疗不良反应发生情况:骨髓抑制方面,22例(55.0%)患者白细胞降低为1级,6例(15.0%)2级,5例(12.5%)患者中性粒细胞1级,3例(7.5%)2级,3例(7.5%)患者血红蛋白1级,1例(2.5%)患者血小板1级。放射性直肠炎:19例(47.5%)患者为1级,7例(17.5%)2级。放射性小肠炎:10例(25.0%)患者为1级,4例(10.0%)2级。放射性泌尿系统反应:13例(32.5%)患者为1级,2例(5.0%)2级。放射性皮肤反应:19例(47.5%)患者为1级,5例(12.5%)2级。无3~4级放疗不良反应发生(表 3)。
|
|
表 3 放疗不良反应发生率(%) Table 3 Incidence of adverse effects of radiotherapy(%) |
6.手术及TRG情况:40例患者均达到R0切除,22例患者行腹会阴联合切除术,18例患者行直肠癌低位前切除术,保肛率为45.0%。13例(32.5%)患者TRG 0级,即病理完全缓解,15例(37.5%)患者TRG 1级,12例(30%)患者TRG 2级。
讨论与三维适形计划相比,调强放疗计划能实现更优的靶区适形度、更陡的正常组织边缘剂量跌落以及更低的正常组织受量[3]。然而放疗技术越是精准,对于靶区勾画的要求就越高。一旦肿瘤定位不准确,则会直接导致肿瘤控制率的下降和正常组织损伤的增加。
CT主要通过肠壁厚度和强化情况判断肿瘤位置,对于下段直肠癌,由于没有明显的空腔形态,难以判断肠壁厚度;直肠与盆腔其他组织器官如肛提肌、肛门外括约肌、阴道、前列腺位置相邻又密度接近,无法区分界限。随着成像技术的迅速发展,MRI以其高软组织分辨率、多方位、多序列成像、无辐射的优势,已经成为公认的直肠癌术前分期的金标准。MERCURY研究结果表明,直肠癌术前MRI检查进行T分期与病理检查结果的一致性高达94%,两者仅相差0.046 mm[4]。
以往在进行直肠癌靶区勾画时也会参考影像科的诊断MRI,但是诊断MRI检查前未进行直肠膀胱准备,且检查床板不同,也不使用固定装置,用于靶区勾画会产生较大的误差。目前已有MRI定位技术应用于多种肿瘤靶区勾画的报道,如颅脑肿瘤、鼻咽癌、前列腺癌、直肠癌等。Tan等[5]发现在CT定位图像上勾画的GTV的体积是MRI上的1.2倍,但仍有遗漏靶区的可能。O′Neill等[6]的研究纳入的是局部晚期低位直肠癌的患者,结果显示GTVMRI比GTVCT更短,体积更小,肿瘤下缘距离肛缘更远。国内少见MRI定位应用于直肠癌放疗靶区勾画的相关研究。
本研究结果显示,GTVCT的长度显著大于GTVMRI。仅使用CT定位进行靶区勾画时,70%的患者存在肿瘤长度被过度估计的可能。MRI定位对肿瘤下界的判断更为准确,与直肠指诊有较高的一致性。这可能是因为本研究中纳入的都是低位直肠癌患者,在CT定位图像上勾画靶区会把一部分正常直肠和肛管误判为肿瘤有关。研究结果还表明,GTVCT的平均体积是GTVMRI的1.33倍。这一方面与肿瘤长度被过度估计有关,另一方面与CT判断不清楚肿瘤与正常肠壁、肛门括约肌及盆腔器官的界限,一部分正常组织器官被勾画入GTV中有关。
MRI定位的应用在缩小靶区体积的同时会带来危及器官受量的减少[7],从而有可能降低放射性损伤的发生风险。本研究显示,应用CT-MRI融合定位制定放疗计划后,放疗不良反应有降低趋势,无3~4级不良反应发生。pCR率为32.5%,较既往仅应用CT定位的直肠癌术前放疗研究中的18.5%有增加的趋势[8]。
MRI影像由于静态磁场的不均匀性和梯度的非线性等原因会存在几何失真。如今大多数现代MRI机器通过后期处理工具即可校正[9]。本研究中进行核磁扫描定位时,扫描中心定位在直肠肿瘤层面,同时使用ACR Largerphantom模体定期监测几何畸变,确保几何畸变在亚毫米范围内[10]。现有的放疗计划系统仍然以CT图像的电子密度信息为主要依据进行放疗剂量的计算,MRI图像的信号强度与电子密度没有相关性[11],不能直接用于剂量计算。因此,还需要通过图像融合软件将CT和MRI图像进行配准融合,在同一水平面结合两种不同成像技术的特点进行放疗计划的设计及照射剂量的计算。
综上所述,本研究初步表明MRI和CT定位图像上勾画的GTV长度、体积和GTV下界距肛缘的距离差异有统计学意义。MRI定位勾画出的GTV范围更小,对于肿瘤的下界的确定也更为准确。因此,MRI定位的应用可能会通过提高靶区勾画的精确性来提高放射治疗的疗效,同时减少放疗不良反应的发生率。进一步的结论还需要扩大样本量,并进行前瞻性的随机对照研究来证实。
利益冲突 所有作者在进行该研究时,未因执行此研究而获得职务、金钱及其他不正当的财务利益作者贡献声明 张扬子负责靶区勾画、数据分析与论文撰写;耿建昊负责靶区勾画和数据整理;朱向高整理数据和数据分析;胡俏俏负责图像融合和论文修改;刘巍巍负责磁定位扫描;吴昊、王维虎指导论文修改;蔡勇负责靶区审核和论文修改;李永恒负责选题设计和论文定稿
| [1] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [2] |
Myerson RJ, Garofalo MC, EI Naqa I, et al. Elective clinical target volumes for conformal therapy in anorectal cancer:An RTOG consensus panel contouring atlas[J]. Int J Radiat Oncol Biol Phys, 2008, 74(3): 824-830. DOI:10.1016/j.ijrobp.2008.08.070 |
| [3] |
Grills IS, Yan D, Martinez AA, et al. Potential for reduced toxicity and dose escalation in the treatment of inoperable non-small-cell lung cancer:a comparison of intensity-modulated radiation therapy (IMRT), 3D conformal radiation, and elective nodal irradiation[J]. Int J Radiat Oncol Biol Phys, 2003, 57(3): 875-890. DOI:10.1016/S0360-3016(03)00743-0 |
| [4] |
MERCURY Study Group. Extramural depth of tumor invasion at thin-section MR in patients with rectal cancer:results of the MERCURY study[J]. Radiology, 2007, 243(1): 132-139. DOI:10.1148/radiol.2431051825 |
| [5] |
Tan J, Lim JD, Fitt G, et al. The utility of multimodality imaging with CT and MRI in defining rectal tumour volumes for radiotherapy treatment planning:a pilot study[J]. J Med Imaging Radiat Oncol, 2010, 54(6): 562-568. DOI:10.1111/j.1754-9485.2010.02212.x |
| [6] |
O'Neill BD, Salerno G, Thomas K, et al. MR vs. CT imaging:low rectal cancer tumour delineation for three-dimensional conformal radiotherapy[J]. Br J Radiol, 2009, 82(978): 509-513. DOI:10.1259/bjr/60198873 |
| [7] |
Rasch C, Barillot I, Remeijer P, et al. Definition of the prostate in CT and MRI:a multi-observer study[J]. Int J Radiat Oncol Biol Phys, 1999, 43(1): 57-66. DOI:10.1016/S0360-3016(98)00351-4 |
| [8] |
Wang L, Li ZY, Li ZW, et al. Efficacy and safety of neoadjuvant intensity-modulated radiotherapy with concurrent capecitabine for locally advanced rectal cancer[J]. Dis Colon Rectum, 2015, 58(2): 186-192. DOI:10.1097/DCR.0000000000000294 |
| [9] |
姚丽红, 王俊杰. MRI在放疗中的应用进展[J]. 癌症进展, 2016, 14(5): 397-399, 405. Yao LH, Wang JJ. The application of MRI in radiotherapy[J]. Oncol Prog J, 2016, 14(5): 397-399, 405. DOI:10.11877/j.issn.1672-1535.2016.14.05.01 |
| [10] |
Weavers PT, Shu Y, Tao S, et al. Technical Note:Compact three-tesla magnetic resonance imager with high-performance gradients passes ACR image quality and acoustic noise tests[J]. Med Phys, 2016, 43(3): 1259-1264. DOI:10.1118/1.4941362 |
| [11] |
张全彬, 张书旭, 林生趣. 磁共振成像技术应用于肿瘤放射治疗的进展[J]. 中华放射医学与防护杂志, 2016, 36(4): 316-320. Zhang QB, Zhang SX, Lin SQ. Progress of magnetic resonance imaging in radiotherapy for cancer[J]. Chin J Radiol Med Prot, 2016, 36(4): 316-320. DOI:10.3760/cma.j.issn.0254-5098.2016.04.018 |
 2018, Vol. 38
2018, Vol. 38


