宫颈癌是女性生殖系统最高发的恶性肿瘤。放射治疗是治疗宫颈癌主要方法之一,但是有30%~50%的宫颈癌患者在放疗结束后3~5年内会面临复发和转移[1]。治疗失败的主要原因是放疗抵抗。目前,产生放疗抗拒的机制不清。肿瘤干细胞理论认为肿瘤组织中有数量极少的细胞具备肿瘤干细胞的特性,表现为可以自我更新和多向分化潜能,以及表达干细胞表面标志物[2]。研究显示,宫颈癌中也存在肿瘤干细胞[3],但其表面标志物尚未明确。上皮间质转化(epithelial-mesenchymal transition,EMT)是指上皮表型与细胞黏附分子(E-cadherin, cytokeratin)表达的缺失,同时获得间质分子(N-cadherin, vimentin)、成纤维细胞或间充质细胞表型及迁移能力。研究显示,在肿瘤细胞放疗抵抗和获得EMT分子表型间存在关联[4]。
本研究检测了耐放疗的宫颈癌细胞是否表达肿瘤干细胞表面标志物,同时考察耐放疗的宫颈癌细胞和高表达干细胞标志物的宫颈癌细胞是否经历了上皮间质转化以及是否具备肿瘤干细胞特性。
材料与方法1.细胞及主要试剂、仪器:人宫颈鳞癌Siha细胞系由河北医科大学第四医院科研中心细胞库馈赠。NOD/SCID小鼠购自中国人民解放军军事医学科学院实验动物中心(合格证号:No.11400700051403)。胎牛血清白蛋白(美国BSA公司)、RPMI 1640干粉为美国Sigma公司产品。CD24、CD44单克隆抗体(美国EB公司);RNA提取试剂TRIzol购自美国GIBCO公司, 兔抗人E-cadherin多克隆抗体、兔抗人vimentin多克隆抗体均购于美国Bioward公司;β-肌动蛋白抗体购于美国Santa Cruz公司;FACS-420型流式细胞仪(美国BD公司);直线加速器为美国Varian公司产品。
2.实验设计与分组:用含10%小牛血清的RPMI 1640培养基常规培养Siha细胞,置37℃、饱和湿度、5%CO2培养箱中培养。每周传代1~2次,当细胞进入对数生长期时进行实验。采用美国Varian直线加速器6 MV X射线为放射源,室温下照射对数生长期的Siha细胞,加1.0 cm补偿膜,源靶距100 cm,剂量率300 MU/min, 处理后置培养箱中继续培养。待细胞长满培养瓶壁70%~80%时,胰酶消化传代。细胞增殖进入对数生长期时,再次进行照射,如此反复达累计照射剂量50 Gy。分别将外照射50 Gy后获取的放射抵抗的宫颈鳞癌细胞和CD44+/CD24+宫颈鳞癌细胞设为实验组,亲代宫颈鳞癌细胞设为对照组。
3.流式细胞技术分选细胞:用流式细胞仪分选Siha CD44+/CD24+细胞,用0.25%胰酶和Accutase将实验组和对照组细胞制备成细胞悬液,计数后调整细胞数量为1×106/组,加入CD44-PE(0.625 μl)和CD24-FITC(0.25 μl)抗体后混匀,4℃避光孵育30 min,加2 ml流式染色液,洗涤,1 200×g,离心半径9.5 cm,离心5 min,弃上清,加流式染色液100~200 μl,上机检测,利用流式细胞仪分选得到Siha CD44+/CD24+细胞。
4.克隆形成实验和放射敏感性分析:选取对数生长期的CD44+/CD24+Siha细胞亚群、耐放疗Siha细胞及亲代Siha细胞,细胞培养于75 cm3培养瓶中,照射剂量分别为0、2、4、6、8和10 Gy。照射后用磷酸盐缓冲液(PBS)快速清洗两遍,0.25%胰蛋白酶消化后,1 200×g,离心半径9.5 cm,离心5 min,制备单细胞悬液后计数活细胞,按照不同照射剂量,加入适量培养基(10 ml)的6孔板中分别接种200、400、600、800、1 000和1 500细胞,每个照射剂量设3个孔,于37℃、5%CO2、饱和湿度的培养箱中培养。6孔板底部出现肉眼可见的克隆时,终止培养,弃培养液,PBS清洗2遍,甲醇固定15 min,倾去固定液,适量姬姆萨液染色15 min。40倍显微镜下计数>50个细胞的克隆数,取平均值。计算细胞克隆形成率及各实验组存活分数(surviving fraction,SF)和未照射细胞的克隆形成率即接种效率(plating efficiency,PE)。计算公式:PE=未照射组细胞形成的克隆数/细胞接种数×100%;SF=照射组细胞形成的克隆数/(接种细胞数×PE)。用GraphPad Prism 5.0软件以单击多靶模型拟合细胞存活曲线,并进行非线性回归分析。SF=1-[(1-exp(-kx)]N,Dq=D0ln(N),D0=1/k,计算出CD44+/CD24+Siha细胞组、亲代Siha细胞组、耐放射Siha细胞组的D0、Dq、N、SF2值。
5.小鼠体内致瘤实验:12只裸鼠随机数表法分为3组,每组4只。选取经流式细胞仪分选后CD44+/ CD24+ Siha细胞、耐放射的Siha细胞及亲代Siha细胞,制备单细胞悬液,1 200×g,离心半径9.5 cm,离心5 min,弃上清,PBS洗涤两次,含有基质胶的DMEM (含10%胎牛血清的DMEM培养基和Matrigel 1:2混合)培养基重悬细胞,计数并调整浓度为1×105/ml,消毒后用1 ml的无菌注射器抽取0.1 ml细胞悬液皮下注射于4周龄雌性NOD/SCID小鼠的右前肢背侧。观察动物的一般情况和瘤体生长情况。
6.Transwell小室侵袭实验:检测3组细胞的侵袭能力。将Matrigel胶铺于Transwell小室8 μm微孔聚碳酸酯膜上,放入24孔板中,置于37℃、5%CO2细胞培养箱中30 min,使胶固化。1 200×g, 离心半径9.5 cm,离心5 min,将3组单细胞悬液调整细胞密度为1×105/ml。吸取3组细胞悬液200 μl,均匀滴加在Transwell上室内,在24孔板中(下室)加入含有20%胎牛血清的培养基100 μl,将Transwell小室放入24孔板中。每组设3个复孔,37℃、5%CO2恒温培养箱中培养24 h。PBS洗2遍,用棉签拭去上室上层未迁移的细胞,PBS洗1次,95%乙醇中固定30 min,晾干,0.1%结晶紫染色20 min,PBS洗3次,小室底面朝上放置于载玻片上。高倍显微镜下计数穿膜细胞。
7.RT-PCR技术检测mRNA的表达情况:RT-PCR技术检测OCT-4、Survivin、ABCG2和bcl-2 mRNA在CD44+/CD24+Siha细胞、耐放射的Siha细胞和亲代Siha细胞的表达。收集各实验组细胞,按TRIzol试剂盒说明书抽提细胞总RNA,取总RNA 450 ng反转录成cDNA,以此cDNA为模板进行PCR扩增,采用20 μl反应体系:2×Ultra SYBR Mixture 10 μl,PCR上、下游引物各0.4 μl,cDNA模板2 μl,加入灭菌蒸馏水至20 μl。Survivin基因引物序列,上游:5′GAAGGCTGGGAGCCAGATGACG 3′,下游:5′GGAAAGCGCAACCGGACGAA 3′,扩增产物136 bp;Oct-4基因引物序列,上游:5′CAGAAGGGCAAGCGATCAAG 3′,下游:5′GGGCCAGAGGAAAGGACACT 3′,扩增产物100 bp;ABCG2上游引物:5′CCTTCTTCGTTATGATGTTTACCCTTAT 3′,下游引物:5′ATCATAAACACCAGATGGTCA 3′,拟扩增片段大小为133 bp;Bcl-2基因引物序列,上游:5′GCCTTCTTTGAGTTCGGTGGG 3′,下游:5′TGCCGGTTCAGGTACTCAGTCATC 3′,扩增产物107 bp;以GAPDH基因为内参照,引物序列,上游:5′CCTCTGACTTCAACAGCGACAC 3′,下游:5′TGGTCCAGGGGTCTTACTCC 3′,扩增产物174 bp。PCR反应条件为:95℃预变性15 s, 60℃ 20 s,45个循环。实验所获得的数据采用ΔCt(Ct目的-Ct内参)法进行相对定量分析,以2-ΔCt×104作为目的基因mRNA的相对表达量。
8.Western blot检测蛋白的表达情况:采用Western blot方法检测E-cadherin和vimentin蛋白在CD44+/CD24+Siha细胞、耐放射的Siha细胞和亲代Siha细胞中的表达情况。收集细胞,加入细胞裂解液,冰上放置15 min,1 200×g,离心半径9.5 cm,离心15 min,取上清,紫外分光光度计定量后置-80℃备用。灌制10% SDS-聚丙烯酰胺凝胶,常规电泳,转膜,封闭,兔抗人E-cadherin和vimentin多克隆抗体,用PBST稀释,稀释比为1:400,β-肌动蛋白抗体稀释比为1:5 000,4℃过夜;用PBST洗膜3次,二抗(1:2 000),室温孵育1 h,ECL显色。
9.统计学处理:每组实验重复3次,应用SPSS 11.5软件进行分析。实验数据满足正态分布,以x±s表示,计量资料两组间比较采用独立样本t检验。P < 0.05为差异有统计学意义。
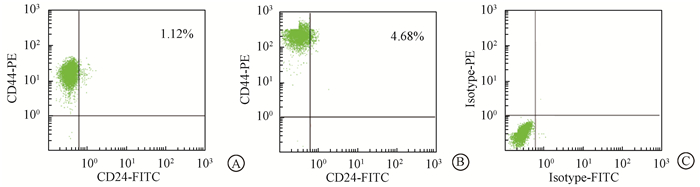
结果1.流式细胞仪分选细胞:分选放疗前后的Siha细胞中CD44+/CD24+ Siha细胞,结果发现,在亲代Siha细胞中,CD44+/CD24+ Siha细胞比例为1.12%,而经过多次分割照射获得的耐放射Siha细胞系中CD44+/CD24+ Siha细胞比例上升至4.68% (图 1)。
|
图 1 CD44和CD24在亲代Siha细胞和SihaR 50 Gy细胞中的表达 A. CD44+/CD24+ Siha细胞在亲代细胞中的比例;B.CD44+/CD24+ Siha细胞在耐放射细胞株中的比例;C.同型对照 Figure 1 CD44 and CD24 expressions in Siha and SihaR 50 Gy cells A. The percentage of CD44+/CD24+ cells in Siha cells; B. The percentage of CD44+/CD24+ cells in radioresistant siha cells; C. Isotype control |
2.克隆形成实验分析各组细胞的放射敏感性:Siha CD44+/CD24+细胞和耐放射Siha细胞在不同剂量照射后的生存分数(SF)明显高于亲代Siha细胞(表 1)。细胞生存曲线如图 2,Siha CD44+/CD24+细胞和耐放射的Siha细胞与亲代Siha细胞相比,D0分别为5.195±0.17、4.018±0.08和3.112±0.11,Dq分别为1.714±0.15、1.908±0.12和0.338 9±0.21,差异有统计学意义(t=79.28~489.56,P < 0.05)。说明Siha CD44+/CD24+细胞与耐放射的Siha细胞均比Siha细胞抗拒放射。
|
|
表 1 各组细胞的放疗敏感性参数 Table 1 The parameters of cell survival curves of each group |

|
图 2 多靶单击模型分析耐放射Siha细胞和SihaCD44+/CD24+细胞放射敏感性 Figure 2 Cell survival of Siha cells, radioresistant Siha cells and CD44+/CD24+ Siha parental cells fitted by the multi-target single-hit model |
3.小鼠体内致瘤实验观察各组细胞的致瘤能力:实验分别将Siha CD44+/CD24+细胞和耐放射Siha细胞以及亲代Siha细胞接种于裸鼠体内。结果显示,耐放射Siha细胞和Siha CD44+/CD24+细胞较亲代Siha细胞形成肿瘤早,并且肿瘤生长较快,在裸鼠体内表现出较高的肿瘤形成能力(t=398.89、420.25,P < 0.05,表 2)。
|
|
表 2 SihaR 50 Gy, Siha CD44+/CD24+和Siha细胞在裸鼠体内移植瘤形成能力(x±s) Table 2 Tumor formation ability of SihaR 50 Gy, Siha CD44+/CD24+ and Siha parental cells in nude mice (x±s) |
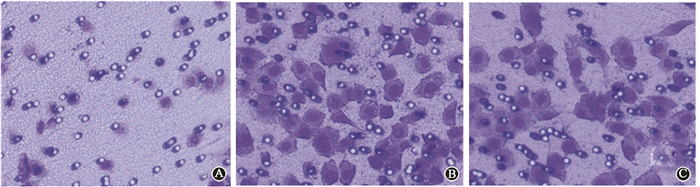
4. Transwell小室侵袭实验观察各组细胞的侵袭能力:实验分析了Siha CD44+/CD24+细胞和耐放射Siha细胞以及亲代Siha细胞的侵袭能力。结果发现Siha CD44+/CD24+细胞和耐放射Siha细胞较亲代Siha细胞表现出明显升高的侵袭能力,200倍放大的视野中选取3个不同区域计数,细胞数分别为125.60±10.321、112.30±15.018和31.50±9.65(t=198.45~213.23,P < 0.05),见图 3。
|
图 3 耐放射Siha细胞、Siha CD44+/CD24+细胞和亲代Siha细胞侵袭能力的比较 A.亲代Siha细胞组;B.耐放射Siha细胞组;C. Siha CD44+/CD24+细胞组 Figure 3 Resistant Siha cells and Siha CD44+/CD24+ cells had migration potential higher than that of their parental cells A. Penetrated cells of parental Siha cells; B. Penetrated cells of resistant Siha cells; C. Penetrated cells of Siha CD44+/CD24+ cells |
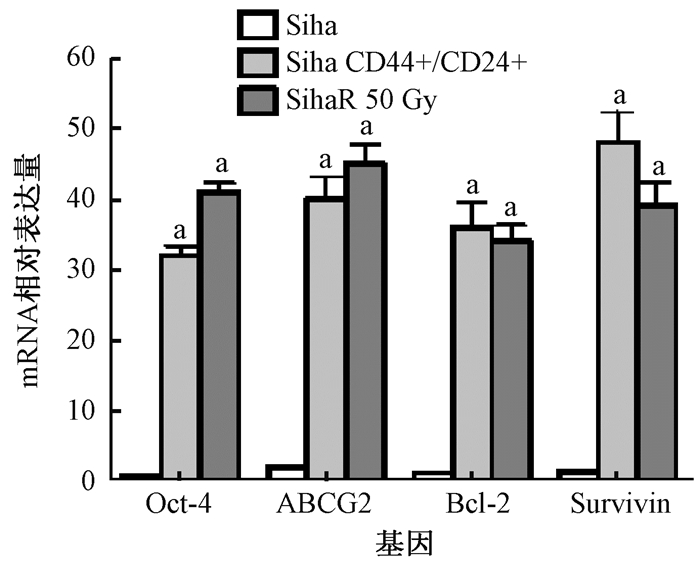
5. Real-time PCR实验检测mRNA的表达:分别从3种细胞中抽提RNA进行检测,结果显示,耐放射的Siha细胞和CD44+/CD24+Siha细胞中的OCT4、ABCG2、Bcl-2和survivin基因表达水平较亲代Siha细胞明显上调,差异有统计学意义(t=81.26~896.62,P < 0.05) (图 4)。
|
图 4 RT-PCR检测耐放射Siha、CD44+/CD24+ Siha和亲代Siha细胞中基因的表达 注:а与亲代Siha细胞组比较,t=81.26~896.62,P < 0.05 Expressions of mRNAs of Oct-4, ABCG2, Bcl-2 and survivin in resistant Siha and CD44+/CD24+ Siha and parental Siha cells detected by RT-PCR |
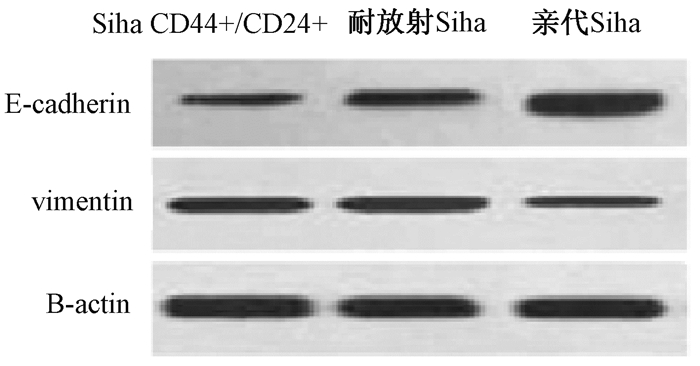
6.Western blot检测蛋白的表达:实验检测CD44+/CD24+Siha细胞、耐放射的Siha细胞和亲代Siha细胞中E-cadherin和vimentin蛋白的表达。结果表明,与对照组亲代Siha细胞相比,在CD44+/CD24+Siha细胞、耐放射的Siha细胞中E-cadherin蛋白的表达下调(t=3.98~5.12,P < 0.05),而vimentin蛋白的表达上调(t=6.35~9.48,P < 0.05, 图 5)。
|
图 5 Western blot检测耐放射Siha、CD44+/CD24+ Siha和亲代Siha细胞中蛋白的表达 Figure 5 Expressions of E-cadherin and vimentin proteins in resistant Siha, CD44+/CD24+ Siha and parental Siha cells by analyzed Western blot |
讨论
宫颈癌是发病率最高的妇科肿瘤,尽管治疗技术不断提高,但每年仍有27万余人死于宫颈癌,其主要原因是患者对放化疗的抵抗。许多研究表明,肿瘤干细胞不仅会抵抗放化疗,而且会引起肿瘤细胞的转移。然而,如何鉴定分离肿瘤干细胞尚无统一标准[5]。目前,鉴定肿瘤干细胞最权威的方法是确定肿瘤干细胞的特异细胞表面标志,并根据这些标志分离出肿瘤干细胞。研究发现CD44+和/或CD24+细胞存在于乳腺癌、前列腺癌、结肠癌、胰腺癌、肝癌和恶性黑色素瘤等诸多肿瘤中,其抗拒放疗的机制与该类细胞高表达膜转运蛋白ABCG2,抗凋亡蛋白Bcl-2和survivin、Oct-4基因和蛋白,而低表达促进凋亡的基因和蛋白有关,即CD44和CD24是肿瘤干细胞的表面标志物[6-10]。其中,Oct-4属于非特异性肿瘤干细胞的标志物,它对维持干细胞的自我更新和多潜能起着重要作用。肿瘤干细胞均表达高水平的Oct-4[11],Oct-4可对抗放疗、化疗及热休克所致的损伤。研究表明,在包括宫颈癌在内的多种实体肿瘤中,Survivin在抗拒放疗方面非常重要[12],Survivin与IAP蛋白家族成员的功能类似,通过阻断活化的Caspase-3和Caspase-7信号途径发挥抗拒凋亡的作用,Oct-4则通过STAT3/Survivin信号转导途径发挥作用[13]。
本研究发现,放射抵抗的宫颈癌细胞中CD44+/ CD24+宫颈癌细胞比例上调,放射抵抗的宫颈癌细胞和CD44+/CD24+宫颈癌细胞均高表达抗凋亡基因survivin、Oct-4和Bcl-2,这些放射抵抗的宫颈癌细胞表现出较强的克隆形成能力和裸鼠移植瘤形成能力,说明CD44+/CD24+宫颈癌细胞具备部分肿瘤干细胞的特性,该类肿瘤干细胞的存在是产生放疗抵抗的原因之一。研究还发现,放射抵抗的宫颈癌细胞和CD44+/CD24+宫颈癌细胞因为vimentin的表达上调和E-cadherin的表达下调而表现出分子和表型的变化,且更具侵袭性。这些表现与上皮细胞间质转换相关,说明这两种细胞具备肿瘤干细胞特性。Kawamoto等[14]、Zhang等[15]和Yan等[16]的研究发现,放射抵抗的结肠癌细胞、乳腺癌细胞以及宫颈癌细胞获得了EMT的分子及表型特征,说明在肿瘤干细胞与放疗诱导的癌细胞EMT变化之间存在着某种联系。根据本实验结果,推测放疗可诱导宫颈癌细胞EMT表型的出现,而CD44+/CD24+宫颈癌细胞本身具备EMT特征,在经历了多次分割照射的宫颈癌细胞系中,CD44+/CD24+宫颈癌细胞比例由放疗前的1.12%上升到放疗后的4.68%,用流式细胞仪分选出的CD44+/CD24+Siha细胞展现相似的较强的侵袭转移肿瘤干细胞特性,表明CD44+/CD24+很可能是宫颈癌肿瘤干细胞的表面标志物。类似结论在乳腺癌肿瘤干细胞的研究中也有报道[17]。上述发现说明肿瘤干细胞的EMT与正常干细胞间有一定的关联。本研究中宫颈癌干细胞在耐放射细胞株中的比例明显升高,该结果可以从以下两个方面解释:一是放射可以杀伤大部分对放射敏感的普通癌细胞,二是放射诱导的宫颈癌细胞发生EMT可以导致宫颈癌细胞中肿瘤干细胞增多,两种途径均可导致肿瘤干细胞增多。该结论与Kurrey等[18]的研究结果一致。
总之,上述研究是在细胞水平上开展的,初步揭示了宫颈癌放疗抵抗的原因,研究结果可为放疗抵抗的宫颈癌干细胞的靶向治疗提供有益参考,因此具有一定的理论意义和实际应用价值。然而,宫颈癌干细胞的表面标志物还可能有其他类型,今后研究重点将在进一步明确肿瘤干细胞的表面标志物以及体内实验方面展开,旨在提高宫颈癌干细胞靶向治疗的针对性。
利益冲突 无作者贡献声明 刘红负责课题的实施和论文的撰写;房朝晖、张倩影负责实验操作和数据采集;李魁秀负责课题的设计和指导论文修改
| [1] |
Barney BM, Petersen IA, Dowdy SC, et al. Intraoperative electron beam radiotherapy (IOERT) in the management of locally advanced or recurrent cervical cancer[J]. Radiat Oncol, 2013, 8: 80. DOI:10.1186/1748-717X-8-80 |
| [2] |
Weissman IL, Anderson DJ, Gage F. Stem and progenitor cells:origins, phenotypes, lineage commitments, and transdifferentiations[J]. Annu Rev Cell Dev Biol, 2001, 17: 387-403. DOI:10.1146/annurev.cellbio.17.1.387 |
| [3] |
Kao CL, Huang PI, Tsai PH, et al. Resveratrol-induced apoptosis and increased radiosensitivity in CD133-positive cells derived from atypical teratoid/rhabdoid tumor[J]. Int J Radiat Oncol Biol Phys, 2009, 74(1): 219-228. DOI:10.1016/j.ijrobp.2008.12.035 |
| [4] |
Gilbert CA, Ross AH. Cancer stem cells:cell culture, markers, and targets for new therapies[J]. J Cell Biochem, 2009, 108(5): 1031-1038. DOI:10.1002/jcb.22350 |
| [5] |
Kim RK, Kim MJ, Yoon CH, et al. A new 2-pyrone derivative, 5-bromo-3-(3-hydroxyprop-1-ynyl)-2H-pyran-2-one, suppresses stemness in glioma stem-like cells[J]. Mol Pharmacol, 2012, 82(3): 400-407. DOI:10.1124/mol.112.078402 |
| [6] |
Wicha MS, Liu S, Dontu G. Cancer stem cells:an old idea-a paradigm shift[J]. Cancer Res, 2006, 66(4): 1883-1890. DOI:10.1158/0008-5472.CAN-05-3153 |
| [7] |
Dalerba P, Cho RW, Clarke MF. Cancer stem cells:models and concepts[J]. Annu Rev Med, 2007, 58: 267-284. DOI:10.1146/annurev.med.58.062105.204854 |
| [8] |
Ke J, Wu X, Wu X, et al. A subpopulation of CD24+ cells in colon cancer cell lines possess stem cell characteristics[J]. Neoplasma, 2012, 59(3): 282-288. DOI:10.4149/neo_2012_036 |
| [9] |
Zhang Y, Wei J, Wang H, et al. Epithelial mesenchymal transition correlates with CD24+CD44+ and CD133+ cells in pancreatic cancer[J]. Oncol Rep, 2012, 27(5): 1599-1605. DOI:10.3892/or.2012.1681 |
| [10] |
Yu F, Yao H, Zhu P, et al. let-7 regulates self renewal and tumorigenicity of breast cancer cells[J]. Cell, 2007, 131(6): 1109-1123. DOI:10.1016/j.cell.2007.10.054 |
| [11] |
Zhang S, Balch C, Chan MW, et al. Identification and characterization of ovarian cancer-initiating cells from primary human tumors[J]. Cancer Res, 2008, 68(11): 4311-4320. DOI:10.1158/0008-5472.CAN-08-0364 |
| [12] |
Guo Y, Mantel C, Hromas RA. Broxmeyer HE:Oct-4 is critical for survival/antiapoptosis of murine embryonic stem cells subjected to stress:effects associated with Stat3/surviving[J]. Stem Cells, 2008, 26(1): 30-34. DOI:10.1634/stemcells.2007-0401 |
| [13] |
Chaopotong P, Kajita S, Hashimura M, et al. Nuclear survivin is associated with cell proliferative advantage in uterine cervical carcinomas during radiation therapy[J]. J Clin Pathol, 2012, 65(5): 424-430. DOI:10.1136/jclinpath-2011-200477 |
| [14] |
Kawamoto A, Yokoe T, Tanaka K, et al. Radiation induces epithelial-mesenchymal transition in colorectal cancer cells[J]. Oncol Rep, 2012, 27(1): 51-57. DOI:10.3892/or.2011.1485 |
| [15] |
Zhang X, Li X, Zhang N, et al. Low doses ionizing radiation enhances the invasiveness of breast cancer cells by inducing epithelial-mesenchymal transition[J]. Biochem Biophys Res Commun, 2011, 412(1): 188-192. DOI:10.1016/j.bbrc.2011.07.074 |
| [16] |
Yan S, Wang Y, Yang Q, et al. Low-dose radiation-induced epithelial-mesenchymal transition through NF-κB in cervical cancer cells[J]. Int J Oncol, 2013, 42(5): 1801-1806. DOI:10.3892/ijo.2013.1852 |
| [17] |
Mani SA, Guo W, Liao MJ, et al. The epithelial-mesenchymal transition generates cells with properties of stem cells[J]. Cell, 2008, 133(4): 704-715. DOI:10.1016/j.cell.2008.03.027 |
| [18] |
Kurrey NK, Jalgaonkar SP, Joglekar AV, et al. Snail and slug mediate radioresistance and chemoresistance by antagonizing p53-mediated apoptosis and acquiring a stem-like phenotype in ovarian cancer cells[J]. Stem Cells, 2009, 27(9): 2059-2068. DOI:10.1002/stem.154 |
 2018, Vol. 38
2018, Vol. 38


