2. 20030 上海, 复旦大学附属肿瘤医院肿瘤放疗科
2. Department of Radiation Oncology, Fudan University Shanghai Cancer Center, Shanghai 20030, China
近年来,同期放化疗在局部晚期食管癌的治疗中体现出优越性,与单纯放疗相比,其局部控制率以及长期生存得到了显著提高[1]。目前,氟尿嘧啶(5-Fu)联合顺铂(DDP)的同期放化疗(PF方案)是最常用的治疗方案[2],但是其局限性在于对患者生存改善有限,且并未体现出很好的耐受性。因此,为了提高患者生存并减轻不良反应,人们一直在寻找新的联合治疗方案。在1994年,紫杉醇(PTX)已经被美国学者证明是治疗食管癌的有效单药[3],并且基于其显著的放疗增敏作用,紫杉醇在多种肿瘤的同期放化疗中已得到大量运用。本研究设计将以紫杉醇为基础同期放化疗与传统的顺铂联合氟尿嘧啶方案治疗食管癌在疗效和不良反应方面做一全面比较。
资料与方法1.患者的选择及临床资料
(1) 纳入标准:2014年7月至2016年6月,在江南大学附属医院诊治的103例局部晚期食管癌患者入组本次研究。入组的患者必须满足以下条件:年龄18~75周岁,无性别限制,病理组织学诊断为食管鳞状细胞癌,并且入组前未接受手术或其他放化疗治疗,分期为局部晚期[T2-4N0-1M0-1A, TXN1M0-1A,TXNXM1A,基于美国癌症联合会(AJCC)2002分期]。采用随机数表法将入组的患者分为2组,以保证患者按1 :1比例随机分入研究组或对照组。研究组接受放疗联合紫杉醇和氟尿嘧啶为基础的同期放化疗方案进行治疗, 52例;对照组则接受经典的PF方案同期放化疗,51例。
(2) 排除标准:存在严重心功能、肝肾功能等不全的患者;未按时完成治疗或治疗期间用药不符合本次试验要求者;资料有缺项,疗效及不良反应评估不准确者。本次研究所选病例获得临床研究伦理委员会批准,参与研究的患者签署了知情同意书。
2.治疗方法
(1) 放射治疗:两组患者采用相同的放疗方式以及总剂量和分割放射。运用调强放射治疗,肿瘤靶区(GTV)定义为食管肿瘤病灶以及转移淋巴结,食管GTV四周外扩1 cm,上下扩4 cm为食管计划靶区(PTV),转移淋巴结各方向外扩1 cm为淋巴结计划靶区PTV。总的PTV=食管PTV+淋巴结PTV。分次剂量为1.8 Gy,5天/周,总剂量为61.2 Gy/34次。
(2) 化学治疗:研究组化疗方案:第1天以PTX 50 mg/m2静脉滴注,并予5-Fu 300 mg/m2微泵注射维持96 h,每周行化疗1次,放疗后继续行2周期化疗,具体为:PTX 135~175 mg/m2静脉滴注,5-Fu 1 800 mg/m2微泵注射维持72 h。对照组的治疗方案:第1~3天DDP 25 mg/m2静脉滴注,5-Fu 1 800 mg/m2微泵注射,维持72 h,每4周行1次化疗,即放疗期间和放疗完成后各行2周期化疗。各药物批准文号:紫杉醇:H20053001(泰州市扬子江药业集团有限公司);氟尿嘧啶:H12020959(天津金耀集团有限公司);顺铂:H20040813(济南市齐鲁制药有限公司)。
3.随访与评价:对两组患者的基线特征进行比较分析,包括性别、年龄、肿瘤位置、淋巴结状态和临床分期等变量。该研究的主要终点是总生存(OS)。局部控制(LC)、无进展生存(PFS)和不良反应为次要研究终点。对于治疗相关不良反应的统计分析,包括了血液学不良反应(白细胞减少、贫血、血小板减少)、急性肺炎和食管炎、胃肠反应(恶心呕吐、厌食),周围神经病变,肌肉痛和关节痛。血液学相关反应采用世界卫生组织(WHO)的分级标准评价,其余不良反应则在肿瘤放射治疗协作组/欧洲癌症治疗研究组织(RTOG/EORTC)标准上评定。
4.统计学处理:采用SPSS 20.0软件进行分析。采用卡方检验、Fisher精确检验对两组患者的临床特征进行比较。用Kaplan-Meier法计算生存率和局部控制率,并绘制生存曲线,Log-rank检验进行分层比较,Cox回归进行多变量分析。使用卡方检验对治疗相关不良反应进行比较分析。P<0.05为差异有统计学意义。
结果1.两组患者的构成分析:本试验总共入组103例患者,其中,TF组52例,占50.5%,PF组51例,占49.5%。TF组和PF组的患者在性别、年龄、肿瘤位置、淋巴结转移情况以及肿瘤临床分期等方面基本数据差异均无统计学意义(P>0.05,表 1),在比较生存及不良反应时具有可比性。
|
|
表 1 患者基本特征 Table 1 General characteristics of included patients |
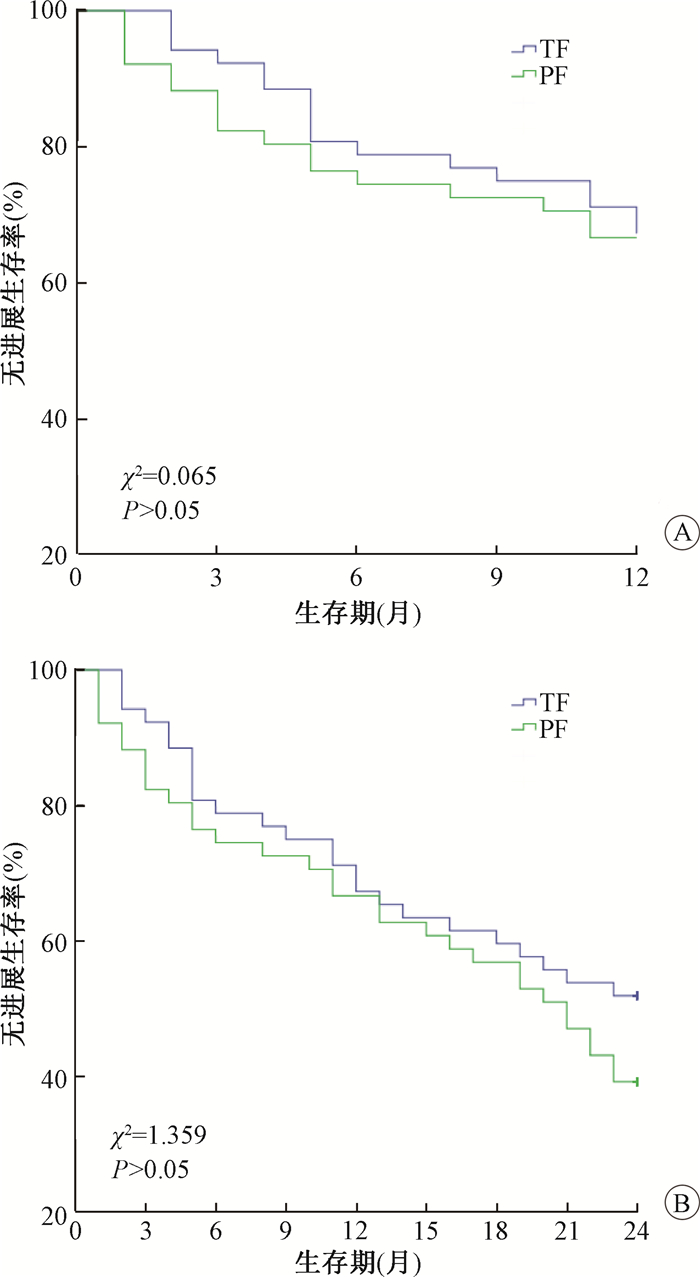
2.两组患者的疗效分析:中位随访时间为23.3个月(95%CI: 21.41~25.22个月)。经过2年随访,通过对两组患者的分析, 两种同期放化疗方案对OS的影响差异无统计学意义。TF组和PF组的患者中位生存期分别为20.0和19.3个月。TF组及PF组1年OS分别为76.9%及74.5%(P>0.05),TF组及PF组2年OS分别为和59.6%及56.9%(P>0.05)。紫杉醇加5-氟尿嘧啶联合放疗与顺铂加5-氟尿嘧啶方案相比,没有生存获益(HR =0.890, 95%CI: 0.489~1.618; P>0.05,图 1,2)。TF组1年和2年的PFS分别为63.5%和51.9%, PF组则为62.7%和39.2%。同样,两个组的PFS比较,差异无统计学意义(P>0.05,图 1,2)。在局部控制率方面,TF组及PF组1年LPFS分别为71.2%及66.7%(P>0.05);2年LPFS分别为61.5%及58.8%(P>0.05)。在2年随访期间,TF组有20例患者复查发现局部复发,5例出现远处转移。在PF组, 局部复发和远处转移患者分别为21和10例(表 2)。

|
图 1 Kaplan-Meier绘制的生存曲线A.1年生存曲线;B.2年生存曲线 Figure 1 Kaplan-Meier curves for OS for patients of both groups A 1-year overall survival; B. 2-year overall survival |
|
图 2 Kaplan-Meier绘制的生存曲线A.1年无进展生存率;B.2年无进展生存率 Figure 2 Kaplan-Meier curves for PFS for patients of both groups A 1-year Progress Free Survival; B. 2-year Progress Free Survival |
|
|
表 2 患者复发和转移数据 Table 2 Recurrence and metastasis data of patients |
3.不良反应的比较分析:3~4级白细胞减少的发生率TF组与PF组分别为36.5%和17.6%(χ2=4.642,P<0.05),两组3~4级急性放射性肺炎发生率分别为15.4%和3.9%(χ2=3.859,P < 0.05),PF组3~4级恶心呕吐反应发生率17.6%,高于TF组的1.9%,差异有统计学意义(χ2=7.262,P < 0.05),而在3~4级贫血、血小板减少、放射性食管炎、厌食症、肌肉关节痛及外周神经炎的发生率上,两组比较,差异无统计学意义(P>0.05,表 3)。
|
|
表 3 两组不良反应发生率比较(%) Table 3 Comparison of adverse effects between two groups(%) |
讨论
食管癌是我国常见的一种消化系统恶性肿瘤。随着医疗技术的进步和新治疗方法的应用,近年来我国食管癌死亡率有下降趋势,但在全部恶性肿瘤中仍高居第4位[4]。以手术为主的综合治疗一直是食管癌标准的治疗方法[5-6]。然而我国大部分患者在确诊时已属局部晚期,无法行根治手术。随着放疗技术进步,特别是三维适形放疗(3D-CRT)及调强放疗(IMRT)技术的发展,放射治疗成为这些患者的优选治疗策略。越来越多的研究结果显示,与单纯放疗或化疗相比,联合治疗能改善局部控制率和总生存[7-9]。放疗同期使用化疗药物,不仅可以降低远处转移率,而且可以提高放疗敏感性。
多年来顺铂联合氟尿嘧啶(PF)方案为经典的食管癌同期化疗方案。作为新型抗肿瘤药物的紫杉醇正在越来越多的被运用于治疗中。紫杉醇能诱导肿瘤细胞凋亡[10],并可将肿瘤细胞阻滞于细胞周期的G2/M期,干扰细胞的有丝分裂。G2/M期的细胞对放疗更为敏感,因此紫杉醇的这种机制有助于提高放射线杀灭肿瘤细胞的效率。早在2000年,Adelstein等[11]报告了一项基于紫杉醇和顺铂同步放化疗的回顾性研究,患者的中位生存期为15个月,但出现了严重的消化道反应和中性粒细胞减少。与氟尿嘧啶为基础的方案相比,并无明显优势。2001年,美国MD安德森癌症中心(MDACC)设计了氟尿嘧啶和紫杉醇联合化疗方案,对食管及胃食管结合部肿瘤患者进行同期放化疗,结果表明该化疗方案的耐受性良好[12]。Yang等[13]报道了以紫杉醇/洛铂为基础的治疗方案提高了患者治疗的有效率,并且降低了不良反应。紫杉醇/洛铂组和顺铂/5-氟尿嘧啶组的PFS分别为13.0和6.0个月,且前者对患者的消化系统和血液系统损伤更少。此外,Tamtai等[14]的研究报告以卡铂/紫杉醇(CP)为基础的方案与PF方案方案相比,疗效相当且不良反应更轻。CP组和PF组的中位生存期分别为21.3和16.3个月,但差异并无统计学意义(P=0.61),而两组的血液学不良反应相当。另外,与以PF方案为基础的RTOG 9405相比,以紫杉醇为基础的RTOG 01132 Ⅱ期随机对照研究提高了患者的1年总生存[15]。
本研究中,TF方案治疗的患者似乎在肿瘤控制率与总生存方面显示出一些优势,但2年随访数据的分析结果,两组的OS、PFS和LPFS,差异均无统计学意义。然而,患者的生存还是可接受的。在Polee等[16]报道的Ⅱ期研究中,患者接受紫杉醇180 mg/m2,顺铂60 mg/m2,每2周1次的化疗,1年生存率为43%。而在Nishimura等[17]所做的一项Ⅱ期研究中,患者随机分为两组,即低剂量长程输注或高剂量短程PF方案同期放化疗。两组的2年生存率分别为46%和44%。而为了提高患者的生存率,三药联合治疗也可作为尝试。在Satake等[18]所做的前瞻性研究中,33例患者接受多西紫杉醇、顺铂和氟尿嘧啶联合治疗为基础的放化疗。中位生存时间为26.0个月,并且无治疗相关死亡。此外,提高放疗剂量也是可选之策。在Nayan等[19]的前瞻性随机研究中,高剂量放射治疗联合化疗可能比标准剂量的方案更有效(治疗反应率71%比64%,P=0.38),并且不良反应可以耐受。在另一项日本的研究表明,质子束治疗似乎是可行的,得益于独特布拉格峰和更理想的剂量分布,Ⅰ、Ⅱ、Ⅲ期肿瘤的控制率分别达到88%、89%和56%[20]。
不良反应也是本研究重点关注的一个方面。相对于其他传统抗肿瘤药物,紫杉醇对血液学系统的损害更明显[21]。在本研究中,TF治疗方案的患者3~4级白细胞减少的发生率达到36.5%,明显高于PF组的17.6%,差异有统计学意义。在Xia等[22]报道的Ⅱ期研究中,使用TF方案化疗的患者只有24.5%出现了3~4级中性粒细胞减少症。入组患者的ECOG评分可能是重要原因。本研究对入组患者要求的ECOG评分为0~2。而Xia等[22]的研究中,入组患者的ECOG评分为0~1。放射性肺炎是胸部肿瘤患者同步放化疗期间常见的不良反应。本研究中TF组患3~4级肺炎的比例(15.4%)高于PF组(3.9%)。差异有统计学意义,且观察到有出现时间更早的趋势。同样,放射性食管炎由于可引起食管穿孔、出血等严重事件,也被重点关注。本研究总共5例患者出现了3~4级食管炎。两组之间没有很大差别。恶心呕吐是使用顺铂时常见的消化道反应,本研究中PF组17.6%的患者出现了3~4级呕吐,明显高于TF组的1.9%,差异有统计意义(P=0.007)。
综上所述,TF化疗方案虽然趋向于更高肿瘤控制率和更低的远处转移率,但本研究并未获得差异具有统计学意义的结果。这可能与本研究的一些局限性与不足相关:首先,本研究样本量偏小,随访时间还不够长。扩大样本量和延长随访时间可能会有更明确的结果。其次,本研究入组的患者临床分期从T2N0M0到TxNxM1a,较为宽广,进一步的亚组分析,可能会对紫杉醇为基础的同期放化疗方案对具体哪一组分期的患者带来获益提供更多的数据和结论。此外,食管癌常用的紫杉醇联合化疗方案还包括紫杉醇联合顺铂,紫杉醇联合卡铂等,是否其他基于紫杉醇的联合化疗方案能获得比紫杉醇联合氟尿嘧啶方案更好的生存结果,目前也不得而知。因此,进一步的分层分析和设计更多的临床试验可能会帮助获得更多更精确的结论。在不良反应方面,选择PF方案治疗的患者更易产生严重呕吐反应,而选择TF方案治疗的患者,其白细胞减低和放射性肺炎的发生率更高,故需分别根据不良反应的不同特点给予合理的防治措施,从而提高患者的治疗耐受性,确保治疗顺利完成。
利益冲突 本研究接受无锡市医院管理中心面上项目(YGZXM14033)资助,所有作者以及基金无任何利益冲突作者贡献声明 鲍而文收集数据并起草论文,统计分析;周嘉梁设计研究方案、收集统计数据并修改论文;吴刚负责论文数据收集及统计分析;赵于天、张云霞、车俊负责临床病例入组、管理、随访和记录;王震吾和张福正负责研究方案中同期放化疗质量控制;赵快乐对整个研究方案设计指导,并监督试验进行
| [1] |
al-Sarraf M, Martz K, Herskovic A, et al. Progress report of combined chemoradiotherapy versus radiotherapy alone in patients with esophageal cancer:an intergroup study[J]. J Clin Oncol, 1997, 15(1): 277-284. DOI:10.1200/jco.1997.15.1.277 |
| [2] |
Seitz JF, Giovannini M, Padaut-Cesana J, et al. Inoperable nonmetastatic squamous cell carcinoma of the esophagus managed by concomitant chemotherapy (5-fluorouracil and cisplatin) and radiation therapy[J]. Cancer, 1990, 66(2): 214-219. DOI:10.1002/1097-0142 |
| [3] |
Ajani JA, Ilson DH, Daugherty K, et al. Activity of taxol in patients with squamous cell carcinoma and adenocarcinoma of the esophagus[J]. Natl Cancer Inst, 1994, 86(14): 1086-1091. DOI:10.1093/jnci/86.14.1086 |
| [4] |
张思维, 郑荣寿, 左婷婷, 等. 中国食管癌死亡状况和生存分析[J]. 中华肿瘤杂志, 2016, 38(9): 709-715. Zhang SW, Zheng RS, Zuo TT, et al. Mortality and survival analysis of esophageal cancer in China[J]. Chin J Oncol, 2016, 38(9): 709-715. DOI:10.3760/cma.j.issn.0253-3766.2016.09.014 |
| [5] |
Vlacich G, Samson PP, Perkins SM, et al. Treatment utilization and outcomes in elderly patients with locally advanced esophageal carcinoma:a review of the National Cancer Database[J]. Cancer Med, 2017, 6(12): 2886-2896. DOI:10.1002/cam4.1250 |
| [6] |
Lin WC, Ding YF, Hsu HL, et al. Value and application of trimodality therapy or definitive concurrent chemoradiotherapy in thoracic esophageal squamous cell carcinoma[J]. Cancer, 2017, 123(20): 3904-3915. DOI:10.1002/cncr.30823 |
| [7] |
Chen FJ, Luo H, Xing LG, et al. Feasibility and efficiency of concurrent chemoradiotherapy with capecitabine and cisplatin versus radiotherapy alone for elderly patients with locally advanced esophageal squamous cell carcinoma:Experience of two centers[J]. Thorac Cancer, 2018, 9(1): 59-65. DOI:10.1111/1759-7714.12536 |
| [8] |
Cooper JS, Guo MD, Herskovic A, et al. Chemoradiotherapy of locally advanced esophageal cancer:long-term follow-up of a prospective randomized trial (RTOG 85-01)[J]. JAMA, 1999, 281(17): 1623-1627. DOI:10.1001/jama.281.17.1623 |
| [9] |
Ge XL, Yang X, Lu XH, et al. Long-term clinical outcome of intensity-modulated radiation therapy for locally advanced esophageal squamous cell carcinoma[J]. Tumori, 2015, 101(2): 168-173. DOI:10.5301/tj.5000234 |
| [10] |
Milas L, Milas MM, Mason KA. Combination of taxanes with radiation:preclinical studies[J]. Semin Radiat Oncol, 1999, 9(2 Suppl 1): 12-26. |
| [11] |
Adelstein DJ, Rice TW, Rybicki LA, et al. Does paclitaxel improve the chemoradiotherapy of locoregionally advanced esophageal cancer? A nonrandomized comparison with fluorouracil-based therapy[J]. J Clin Oncol, 2000, 18(10): 2032-2039. DOI:10.1200/JCO.2000.18.10.2032 |
| [12] |
Schnirer Ⅱ, Komaki R, Yao JC, et al. Pilot study of concurrent 5-fluorouracil/paclitaxel plus radiotherapy in patients with carcinoma of the esophagus and gastroesophageal junction[J]. Am J Clin Oncol, 2001, 24(1): 91-95. DOI:10.1097/00000421-200102000-00018 |
| [13] |
Yang JS, Wang T, Qiu MQ, et al. Comparison of efficacy and toxicity profiles between paclitaxel/lobapoatin-and cisplatin/5-fluorouracil-based concurrent chemoradiotherapy of advanced inoperable oesophageal cancer[J]. Intern Med J, 2015, 45(7): 757-761. DOI:10.1111/imj.12773 |
| [14] |
Tamtai A, Jiarpinitnun, C, Hiranyatheb, P, et al. Tolerability and efficacy of concurrent chemoradiotherapy comparing carboplatin/paclitaxel versus platinum/5-FU regimen for locally advanced esophageal and esophagogastric junction cancers[J]. Med Oncol, 2017, 34(9): 157. DOI:10.1007/s12032-017-1017-z |
| [15] |
Ajani JA, Winter K, Komaki R, et al. Phase Ⅱ randomized trial of two nonoperative regimens of induction chemotherapy followed by chemoradiation in patients with localized carcinoma of the esophagus:RTOG 0113[J]. J Clin Oncol, 2008, 26(28): 4551-4556. DOI:10.1200/JCO.2008.16.6918 |
| [16] |
Polee MB, Eskens FA, van der Burg ME, et al. Phase Ⅱ study of bi-weekly administration of paclitaxel and cisplatin in patients with advanced oesophageal cancer[J]. Br J Cancer, 2002, 86(5): 669-673. DOI:10.1038/sj.bjc.6600166 |
| [17] |
Nishimura Y, Hiraoka M, Koike R, et al. Long-term follow-up of a randomized Phase Ⅱ study of cisplatin/5-FU concurrent chemoradiotherapy for esophageal cancer (KROSG0101/JROSG021)[J]. Jpn J Clin Oncol, 2012, 42(9): 807-812. DOI:10.1093/jjco/hys112 |
| [18] |
Satake H, Tahara M, Mochizuki S, et al. A prospective, multicenter phase Ⅰ/Ⅱ study of induction chemotherapy with docetaxel, cisplatin and fluorouracil (DCF) followed by chemoradiotherapy in patients with unresectable locally advanced esophageal carcinoma[J]. Cancer Chemother Pharmacol, 2016, 78(1): 91-99. DOI:10.1007/s00280-016-3062-2 |
| [19] |
Nayan N, Bhattacharyya M, Jagtap VK, et al. Standard-dose versus high-dose radiotherapy with concurrent chemotherapy in esophageal cancer:a prospective randomized study[J]. South Asian J Cancer, 2018, 7(1): 27-30. DOI:10.4103/sajc.sajc_178_17 |
| [20] |
Ishikawa H, Hashimoto T, Moriwaki T, et al. Proton beam therapy combined with concurrent chemotherapy for esophageal cancer[J]. Anticancer Res, 2015, 35(3): 1757-1762. |
| [21] |
Song T, Zhang X, Fang M, et al. Long-term results of definitive concurrent chemoradiotherapy using paclitaxel plus oxaliplatin in unresectable locally advanced esophageal cancer:a prospective phase Ⅱ trial[J]. Cancer Med, 2016, 5(12): 3371-3377. DOI:10.1002/cam4.897 |
| [22] |
Xia Y, Li YH, Chen Y, et al. A phase Ⅱ trial of concurrent chemoradiotherapy with weekly paclitaxel and carboplatin in advanced oesophageal carcinoma[J]. Int J Clin Oncol, 2018, 23(3): 458-465. DOI:10.1007/s10147-018-1240-4 |
 2018, Vol. 38
2018, Vol. 38


