2. 450003 郑州, 河南省人民医院放疗科
2. Department of Radiotherapy, Henan Provincial People's Hospital, Zhengzhou 450003, China
胃癌是一种恶性肿瘤,近年来其发病率和死亡率虽有所降低,但仍居恶性肿瘤的第2和第3位[1-2],严重损害我国人民的身体健康。随着手术治疗的规范化以及新型抗肿瘤药物的不断发展使胃癌的治疗效果得到显著提高,但对于大部分晚期的胃癌患者或者已发生转移的胃癌无法采取手术治疗,需要通过放化疗结合的手段进行治疗,但是胃癌放疗效率不高的问题一直困扰着人们。大量的研究表明,辐射后DNA损伤修复影响肿瘤细胞的放射敏感性[3]。因此,深入探究胃癌细胞放射敏感性的机制,寻找潜在的治疗靶点,成为基础和临床生物学领域研究的重点和热点。锌指结构E-box结合蛋白1(zinc finger E-box binding homeobox protein 1, ZEB1)是转录因子ZEB家族的成员之一,在细胞分化和组织特异性方面起重要的作用[4]。研究表明,ZEB1在肿瘤的发生、发展中发挥至关重要的作用。在本实验中,探究ZEB1对胃癌AGS细胞系放射敏感性的影响以及可能的作用机制,为提高胃癌的放疗效果提供理论依据。
材料与方法1.试剂和仪器:胃癌细胞系AGS购自美国ATCC细胞库,胎牛血清、RPMI 1640培养基购自美国GIBCO公司,Lipofectamine 2000购自美国赛默飞世尔公司,pcDNA 3.1-ZEB1、ZEB1干扰表达质粒以及阴性对照购自上海吉玛生物科技有限公司,凋亡检测试剂盒购自美国Sigma公司,ZEB1抗体、毛细血管扩张突变基因(ataxia telangiectasia-mutated gene, ATM)抗体、组蛋白H2A(Histone H2A, H2AX)抗体,磷酸化H2AX(γ-H2AX)抗体购自美国Abcam公司,β-肌动蛋白抗体购自美国Cellular Signaling Technology公司,辣根过氧化物酶标记二抗购自美国Protein Tech公司。流式细胞仪购自美国BD公司,凝胶成像系统购自上海GENE公司。
2.细胞的培养和照射:AGS细胞培养于含10%胎牛血清的RPMI 1640培养基,放入37℃、5%CO2的细胞培养箱中常规培养、传代。取生长状态良好的细胞,源靶距100 cm,照射野10 cm×10 cm,剂量率5 Gy/min,根据实验要求分别用不同剂量的X射线照射细胞。
3.细胞的转染:将细胞调整为2×105~3×105加入6孔板中,培养至细胞浓度80%~90%开始转染。在Lipofectamine 2000的介导下,将过表达ZEB1、ZEB1干扰表达质粒以及相应的对照质粒(pcDNA3.1)和阴性对照干扰质粒转染至AGS细胞中,分别记为过表达ZEB1组、沉默ZEB1组、对照组、阴性对照组。转染后0、24、48、72 h时利用蛋白质印迹法(Western blot)检测ZEB1和ATM蛋白的表达;转染后48 h并经一次性4 Gy剂量照射48 h后,Western blot检测细胞中γ-H2AX表达,流式细胞仪检测细胞凋亡。
4.Western blot检测:收集细胞,加入细胞裂解液,提取细胞中总蛋白,测定其浓度,加入上样缓冲液将蛋白样品调整为一致,100℃加热10 min;吸取50 μg总蛋白加入聚丙烯酰胺凝胶上样孔中,进行电泳,在350 mA恒流冰浴中转膜100 min;5%的脱脂奶粉溶液封闭1 h;根据说明书稀释一抗,ATM 1 :500,ZEB1 1 :1 000,γ-H2AX 1 :1 000,H2AX 1 :1 000,β-肌动蛋白1 :10 000,4℃孵育过夜,含Tween的Tris-HCl缓冲盐溶液(TBST)漂洗3次,每次10 min,加入二抗(1 :2 000),37℃孵育1 h,TBST漂洗3次,每次10 min,加入增强的化学发光(ECL)工作液,凝胶成像仪中曝光、拍照,计算ZEB1或ATM与β-肌动蛋白蛋白质灰度值的比值。
5.细胞克隆实验:收集过表达ZEB1组、沉默ZEB1组、对照组和阴性对照组细胞,分别给予0、2、4、6、8 Gy剂量的X射线照射,每个剂量设置3次重复,放入37℃、5%CO2的细胞培养箱中常规培养,当细胞克隆生长至一定大小,甲醇固定30 min,0.5%结晶紫染色15 min,计数>50的细胞克隆数,计算克隆形成率。根据GraphPad Prism 5软件单机多靶计算增敏比。细胞克隆形成率=克隆数/接种细胞数×100%,存活分数(SF)=受照射细胞克隆形成率/对照细胞克隆形成率×100%。
6.细胞凋亡实验:收集转染、照射后细胞,浓度调整为1×106/ml,每孔加入10 μl膜联蛋白V-FITC(Annexin V-FITC)和5 μl碘化丙啶(propidium iodide, PI),暗室染色15 min,流式细胞仪分析细胞的凋亡率。
7.统计学处理:采用SPSS 22.0软件进行分析。结果以x±s表示。两组间数据的比较经正态性检验符合正态分布采用t检验,多组数据间比较经方差齐性检验采用单因素方差分析,如需分层进行组内比较,采用双因素方差分析。P < 0.05为差异有统计学意义。
结果1.不同放射剂量对AGS细胞中ZEB1表达的影响:如图 1所示,Western blot检测不同放射剂量对AGS细胞中ZEB1蛋白水平的影响;不同放射剂量照射(0、2、4、6、8 Gy)AGS细胞中ZEB1蛋白水平分别为0.34±0.04、0.48±0.05、0.73±0.06、0.97±0.1、1.21±0.12;放射可剂量依赖地诱导细胞中ZEB1蛋白水平增加(F=58.57、P < 0.05),与0 Gy剂量组相比,2、4、6、8 Gy剂量组均显著增加,差异有统计学意义(t=3.79、9.37、10.13、11.91,P < 0.05)。

|
图 1 放射呈剂量依赖诱导AGS细胞中ZEB1表达 Figure 1 Radiation induced ZEB1 expression in AGS cells in a dose-dependent manner |
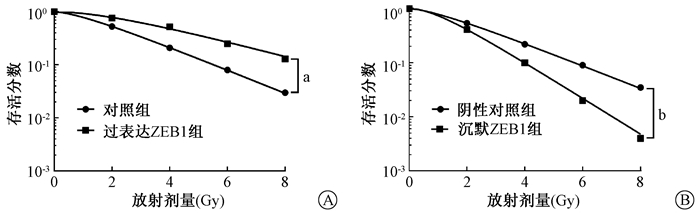
2. ZEB1对AGS细胞放射敏感性的影响:与对照组(0.34±0.03)相比,转染过表达载体后显著增加AGS细胞中ZEB1蛋白的表达量(1.21±0.12),差异有统计学意义(t=12.18,P < 0.05);过表达ZEB1较对照组显著降低AGS细胞的放射敏感性(图 2A,表 1)。与阴性对照(1.13±0.11)相比,慢病毒转染降低AGS细胞中ZEB1表达量(0.28±0.03),差异有统计学意义(t=12.91,P < 0.05);沉默ZEB1较阴性对照组显著增加AGS细胞的放射敏感性(图 2B,表 1)。
|
图 2 ZEB1对AGS细胞放射敏感性的影响A.过表达ZEB1对AGS细胞放射敏感性的影响;B.沉默ZEB1对AGS细胞放射敏感性的影响 注:a两组相比,F=39.93,P < 0.05;b两组相比,F=214.10,P < 0.05 Figure 2 The effect of ZEB1 on radiosensitivity of AGS cells A.Effect of overexpressing ZEB1 on radiosensitivity of AGS cells; B.Effect of silencing ZEB1 on radiosensitivity of AGS cells |
|
|
表 1 ZEB1对AGS细胞辐射敏感性相关参数的影响 Table 1 The effect of ZEB1 on the parameters related to radiosensitivity of AGS cells |
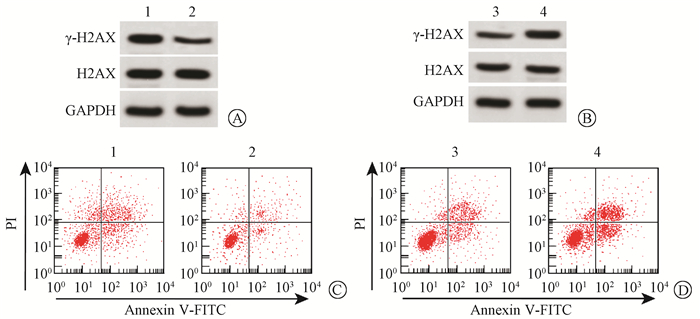
3. ZEB1对放射诱导细胞DNA损伤和凋亡的影响:与对照组(1.21±0.12)相比,过表达ZEB1抑制γ-H2AX表达(0.34±0.03),表明细胞损伤程度降低,差异有统计学意义(t=12.18,P < 0.05,图 3A);过表达ZEB1较对照组AGS细胞凋亡明显降低[(8.32±0.68) vs. (18.14±2.24)],差异有统计学意义(t=7.27,P < 0.05,图 3C)。与阴性对照组相比(0.32±0.03),沉默ZEB1增加γ-H2AX表达(1.24±0.12),表明细胞损伤程度增加,差异有统计学意义(t=12.88,P < 0.05,图 3B);沉默ZEB1较阴性对照组AGS细胞凋亡明显增加[(42.16±4.62) vs. (18.03±1.91)],差异有统计学意义(t=8.36,P < 0.05,图 3D)。
|
图 3 ZEB1对放射照射诱导的DNA损伤和细胞凋亡的影响A~B. Western blot检测过表达和沉默ZEB1对4 Gy放射照射诱导的DNA损伤相关蛋白γ-H2AX表达的影响;C~D.流式细胞术检测过表达和沉默ZEB1对4 Gy放射照射后细胞凋亡的影响 注:1.对照组;2.过表达ZEB1组;3.阴性对照组;4.沉默ZEB1组 Figure 3 The effect of ZEB1 on DNA damage and apoptosis induced by irradiation A-B. Western blot was used to detect the effects of overexpressing and silencing ZEB1 on the expression of DNA damage associated protein γ-H2AX induced by 4 Gy irradiation. C-D. Flow cytometry was used to measure the effects of overexpressing and silencing ZEB1 on cell apoptosis induced by 4 Gy irradiation |
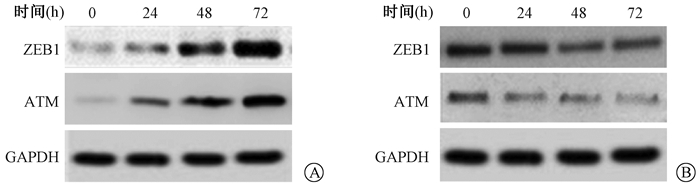
4. ZEB1对AGS细胞中ATM表达量的影响:Western blot检测过表达或者沉默ZEB1对AGS细胞中ATM表达量的影响,过表达ZEB1后0、24、48、72 h时ATM蛋白表达量分别为0.09±0.01、0.23±0.02、0.52±0.05、1.12±0.12,与0 h相比,过表达ZEB1后24、48、72 h可增加AGS细胞中ATM表达量,差异有统计学意义(F=165.70,P < 0.05, 图 4A);而沉默ZEB1后0、24、48、72 h时ATM蛋白表达量分别为0.35±0.04、0.17±0.02、0.19±0.02、0.13±0.01,沉默ZEB1后24、48、72 h与0 h比较则可降低AGS细胞中ATM表达量,差异有统计学意义(F=44.80,P < 0.05, 图 4B)。
|
图 4 ZEB1上调AGS细胞中ATM表达A.过表达ZEB1随时间诱导AGS细胞中ATM表达;B.沉默ZEB1随时间抑制AGS细胞中ATM表达 Figure 4 ZEB1 up-regulates ATM expression in AGS cells A. Overexpression of ZEB1 induced ATM expression in AGS cells in a time-dependent manner; B. Silencing ZEB1 inhibited ATM expression in AGS cells in a time-dependent manner |
讨论
ZEB家族包括两个主要的成员:ZEB1和ZEB2,主要通过锌指结构域和相应的靶基因DNA结合从而发挥调控作用。近年来的研究表明,ZEB1在多种肿瘤组织中的表达量异常,如胰腺癌[5]、前列腺癌[6]、乳腺癌[7]等,且其在肿瘤放化疗治疗耐受性中的作用也逐渐被人们认识。在本研究中,通过不同剂量(0、2、4、6、8 Gy)照射胃癌AGS细胞,Western blot检测结果发现,ZEB1的表达量随着放射剂量的逐渐增加而增加,具有一定的剂量依赖性,表明ZEB1参与胃癌细胞放射敏感性的调节过程中。
对于胃癌的治疗来讲,多学科多手段联合治疗已成一种共识,其中放射是治疗肿瘤的一种重要手段[8]。但放射抵抗以及肿瘤周围危及器官耐受性低限制剂量增加等因素会降低放射治疗的效果,因此,如何克服放射抵抗和增加胃癌细胞放射敏感性,提高放射治疗效果,对于改善胃癌患者预后和生存治疗具有重要意义。有研究发现,在食管鳞癌中,ZEB1蛋白水平与放射敏感性呈负相关,其可为预测患者放射敏感性的潜在分子标志物[9]。在HER2阳性乳腺癌患者中,ZEB1是一种潜在的靶向蛋白,可作为放射敏感性的临床抑制剂[10]。但ZEB1在胃癌细胞的放射敏感性作用的相关研究尚不十分清楚。因此本研究以胃癌AGS细胞为模型,通过过表达和干扰ZEB1基因放入表达对放射的应答产生显著的影响。ZEB1过表达的AGS细胞经照射后存活率明显增加,γ-H2AX表达明显降低,表明细胞损伤减轻;凋亡实验表明,过表达ZEB1显著降低AGS细胞的凋亡率,沉默ZEB1表达则抑制AGS细胞的存活率,增加细胞损伤相关蛋白γ-H2AX的表达量,促进细胞凋亡,表明ZEB1抑制放射照射诱导的DNA损伤和细胞凋亡,促进增殖,从而降低胃癌AGS细胞的放射敏感性。
细胞照射后导致的DNA损伤修复是引起放射抵抗的主要原因[11-13]。其中,ATM是DNA损伤修复过程中的重要调控因子,其可以启动DNA损伤修复并激活下游靶基因,通过调控相关基因的信号通路从而对损伤的DNA进行修复[14-15]。研究表明,ATM可通过调控细胞周期检验点激酶1维持ZEB1的稳定性,从而激活DNA损伤修复过程以及促进放疗耐受性,表明ZEB1是ATM的调节因子[16]。在此基础上,本实验结果显示过表达ZEB1上调ATM蛋白的水平,沉默ZEB1表达量下调ATM蛋白水平,且具有一定的时间依赖性,表明ZEB1可调节AGS细胞中ATM表达,介导细胞的放射敏感性。
综上所述,ZEB1可通过调节AGS细胞中ATM表达,抑制放射照射诱导的DNA损伤和细胞凋亡,促进增殖,从而降低细胞放射敏感性,为胃癌的放疗提供潜在的分子靶点。
利益冲突 全体作者无利益冲突,排名无争议,未因进行该研究而接受任何不正当的职务和财务利益作者贡献声明 崔勇霞负责实验和论文撰写;吴广银、罗执芬负责数据统计;白冰、陈曦协助完成实验;王朝杰参与研究设计与指导,提出修改意见
| [1] |
Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [2] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
Willers H, Gheorghiu L, Liu Q, et al. DNA damage response assessments in human tumor samples provide functional biomarkers of radiosensitivity[J]. Semin Radiat Oncol, 2015, 25(4): 237-250. DOI:10.1016/j.semradonc.2015.05.007 |
| [4] |
Zhang P, Sun Y, Ma L. ZEB1:at the crossroads of epithelial-mesenchymal transition, metastasis and therapy resistance[J]. Cell Cycle, 2015, 14(4): 481-487. DOI:10.1080/15384101.2015.1006048 |
| [5] |
Krebs AM, Mitschke J, Lasierra LM, et al. The EMT-activator Zeb1 is a key factor for cell plasticity and promotes metastasis in pancreatic cancer[J]. Nat Cell Biol, 2017, 19(5): 518-529. DOI:10.1038/ncb3513 |
| [6] |
Selth LA, Das R, Townley SL, et al. A ZEB1-miR-375-YAP1 pathway regulates epithelial plasticity in prostate cancer[J]. Oncogene, 2017, 36(1): 24-34. DOI:10.1038/onc.2016.185 |
| [7] |
Preca BT, Bajdak K, Mock K, et al. A novel ZEB1/HAS2 positive feedback loop promotes EMT in breast cancer[J]. Oncotarget, 2017, 8(7): 11530-11543. DOI:10.18632/oncotarget.14563 |
| [8] |
朱旭升, 姚学权, 刘福坤. 胃癌放疗的研究进展[J]. 中国肿瘤外科杂志, 2014, 6(3): 177-179. Zhu XS, Yao XQ, Liu FK. Advances in radiotherapy for gastric cancer[J]. Chin J Surg Oncol, 2014, 6(3): 177-179. DOI:10.3969/j.issn.1674-4136.2014.03.012 |
| [9] |
邵艳, 马兆明, 张建国, 等. STAT3和ZEB1在食管鳞癌中的表达及其与放疗敏感性的关系[J]. 肿瘤学杂志, 2017, 23(12): 1055-1059. Shao Y, Ma ZM, Zhang JG, et al. STAT3 and ZEB1 expressions in esophageal squamous cell carcinoma and their relationship with radiosensitivity[J]. J Chin Oncol, 2017, 23(12): 1055-1059. DOI:10.11735/j.issn.1671-170X.2017.12.B002 |
| [10] |
Han F, Zhu H, Xu J, et al. ZEB1 is involved in regulating HER2-positive breast cancer radiosensitivity by controlling EMT[J]. Oncol Lett, 2018, 15(5): 6851-6856. DOI:10.3892/ol.2018.7906 |
| [11] |
Saki M, Makino H, Javvadi P, et al. EGFR mutations compromise hypoxia-associated radiation resistance through impaired replication fork-associated DNA damage repair[J]. Mol Cancer Res, 2017, 15(11): 1503-1516. DOI:10.1158/1541-7786.MCR-17-0136 |
| [12] |
An Z, Yu JR, Park WY. Rosiglitazone enhances radiosensitivity by inhibiting repair of DNA damage in cervical cancer cells[J]. Radiat Environ Biophys, 2017, 56(1): 89-98. DOI:10.1007/s00411-016-0679-9 |
| [13] |
Zou N, Xie G, Cui T, et al. DDB2 increases radioresistance of NSCLC cells by enhancing DNA damage responses[J]. Tumour Biol, 2016, 37(10): 14183-14191. DOI:10.1007/s13277-016-5203-y |
| [14] |
Cao LL, Wei F, Du Y, et al. ATM-mediated KDM2A phosphorylation is required for the DNA damage repair[J]. Oncogene, 2016, 35(3): 402. DOI:10.1038/onc.2015.311 |
| [15] |
Zhou Y, Lee JH, Jiang W, et al. Regulation of the DNA damage response by DNA-PKcs inhibitory phosphorylation of ATM[J]. Mol Cell, 2017, 65(1): 91-104. DOI:10.1016/j.molcel.2016.11.004 |
| [16] |
Zhang P, Wei Y, Wang L, et al. ATM-mediated stabilization of ZEB1 promotes DNA damage response and radioresistance through CHK1[J]. Nat Cell Biol, 2014, 16(9): 864-875. DOI:10.1038/ncb3013 |
 2018, Vol. 38
2018, Vol. 38


