2. 473000 南阳, 郑州大学附属南阳医院 南阳市中心医院放疗科;
3. 473000 南阳, 郑州大学附属南阳医院 南阳市中心医院肿瘤科;
4. 473000 南阳, 郑州大学附属南阳医院 南阳市中心医院重症医学科;
5. 430022 武汉, 华中科技大学同济医学院附属协和医院胰腺外科
2. Department of Radiotherapy, Nanyang City Central Hospital, Nanyang Hospital Affiliated to Zhengzhou University, Nanyang 473000, China;
3. Department of Oncology, Nanyang City Central Hospital, Nanyang Hospital Affiliated to Zhengzhou University, Nanyang 473000, China;
4. Department of Critical Care Medicine, Nanyang City Central Hospital, Nanyang Hospital Affiliated to Zhengzhou University, Nanyang 473000, China;
5. Department of Pancreatic Surgery, Wuhan Union Hospital Affiliated to Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430022, China
结直肠癌是常见的胃肠道恶性肿瘤之一,近年来其发病率呈现增加趋势[1]。目前,外科手术联合放疗能够改善结直肠癌的治疗效果[2],但由于其内在放射抗性,治疗效果仍不理想,因此,增加结直肠癌患者的放射敏感性成为迫切需要解决的问题[3]。FOXD1基因属于叉头框(forkhead box,FOX)家族的成员之一,FOX蛋白家族具有调控细胞周期、调控胚胎发育、调节免疫等多种生物学功能[4]。目前发现FOXD1在胶质瘤、肺癌和乳腺癌中异常表达[5],FOXD1通过p27促进乳腺癌增殖和化疗药物耐药性[6]。此外,敲低FOXD1可抑制结直肠癌SW480细胞增殖和细胞周期进程,诱导细胞凋亡,FOXD1过表达促进结肠癌HT29细胞增殖并抑制细胞凋亡[7]。然而,FOXD1是否对结直肠癌放射敏感性产生影响尚不清楚。本实验通过抑制FOXD1基因表达,研究其是否对结直肠癌细胞放射敏感性产生影响并探讨潜在作用机制。
材料与方法1.材料:收集郑州大学附属南阳市中心医院确诊的结直肠癌组织以及距病变位置约为10 cm的癌旁正常组织标本,标本的采集均经过患者和家属同意,所取标本均在液氮中保存备用。人结肠黏膜上皮细胞株NCM460、人结直肠癌细胞株LoVo、SW480、SW620、HCT116、HT29购于上海中国科学院细胞库。60只BALB/c-nu雄性裸鼠,6周龄,体重18~22 g,购于湖南景达斯莱克公司,动物许可证号:SCXK(湘)2016-0002。胎牛血清、RPMI 1640培养基、DMEM培养基、胰蛋白酶均购于美国Sigma公司;青霉素-链霉素双抗购于北京鼎国生物科技公司;Lipofectamine 2000转染试剂购于美国Invitrogen公司;RNA提取试剂盒、反转录试剂盒、Sigma TECT DNA-PK试剂盒购于美国Promega公司;实验所用引物均由上海生工公司合成;SYBR® Premix Ex Taq TM Ⅱ(TLi RNaseH Plus)试剂盒购于大连TaKaRa公司;FOXD1小干扰RNA(si-FOXD1)、siRNA阴性对照(si-NC)购于美国CST-Signal Silence公司;BCA蛋白定量试剂盒、ECL显色试剂盒购于南京碧云天生物公司;FOXD1抗体、β-肌动蛋白抗体和辣根过氧化物标记的二抗购于美国Abcam公司。NanoDrop2000分光光度计、全波长读数仪购自美国Thermo Scientific公司;实时荧光定量PCR仪(QuantStudio 6 Flex)购自美国Life Technology公司;化学发光成像系统(ChemiDocXRS+)、小型垂直电泳槽(Mini-PROTEAN® Tetra)购自美国Bio-Rad公司;2300/CD型双光子直线加速器购自美国瓦里安公司;液体闪烁计数器购自德国Beckman公司。
2.结直肠癌细胞培养:将冻存的人结直肠癌细胞株和结肠黏膜上皮细胞株NCM460细胞复苏后,置于37℃、含5% CO2的细胞培养箱中培养至细胞贴壁生长。人结直肠癌细胞株LoVo培养基采用含10%胎牛血清(FBS)的杜尔贝科改良伊格尔培养基(DMEM)完全培养液,结肠黏膜上皮细胞株NCM460和人结直肠癌细胞株SW480、SW620、HCT116、HT29培养液采用含10%FBS的RPMI 1640完全培养液,按照0.1 kU/ml加入青霉素-链霉素双抗。当细胞汇合度约为90%时,用0.25%的胰蛋白酶进行传代培养,取处于对数生长期的细胞用于后续实验。
3.qRT-PCR检测组织和细胞中FOXD1 mRNA的水平:将结直肠癌组织和癌旁组织从液氮中取出,用组织破碎仪进行破碎,按照RNA提取试剂盒说明书进行提取各组织中总RNA。取各对数生长期的结直肠癌细胞株,按照RNA提取试剂盒说明书提取各细胞株RNA。采用Nanodrop检测总RNA的浓度和纯度,检测吸光度(A)值:A260/A280=2.1,保证了RNA的完整性。用M-MLV反转录试剂盒合成cDNA,用SYBR® Premix Ex Taq TM Ⅱ(TLi RNaseH Plus)试剂盒进行荧光定量PCR,采用20 μl反应体系,反应条件是95℃预变性30 s,95℃变性5 s,60℃退火30 s,72℃延伸30 s,40个循环。以β-肌动蛋白为内参,用相对定量2-ΔΔCT计算FOXD1水平。引物:β-肌动蛋白正向:5′ AGATTACTGCCCTGGCTCCTAG 3′;反向:5′ TCATCGTACTCCTGCTTGCTG 3′;FOXD1正向:5′ ACAACTAAAGCCTTTTTGAGG 3′;反向:5′ AAAAGTACACCAGACAAGTG 3′。
4.Western blot检测组织和细胞中FOXD1蛋白的水平:将癌组织和癌旁组织从液氮中取出剪碎,加入RIPA裂解液,研磨成组织匀浆,参照提取组织蛋白说明书提取总蛋白。取各株细胞参照细胞提取蛋白说明书提取细胞总蛋白。采用BAC蛋白定量试剂盒对蛋白进行定量。每个泳道上样量为50 μg变性的蛋白样品,以5%的浓缩胶、12%的分离胶进行电泳,电泳结束后采用半干法转膜,以电压80 V,在4℃转膜90 min。转移至硝酸纤维素膜上后,以5%牛血清蛋白置于摇床上室温封闭60 min。加入一抗(1 :1 000倍稀释)在4℃下过夜反应,用含Tween 20的Tris-HCl缓冲盐溶液(TBST)洗涤后再与辣根过氧化物酶标记的二抗室温孵育2 h。采用增强的化学发光(ECL)法,拍照,分析FOXD1蛋白水平。
5.细胞转染和照射:取结直肠癌HCT116细胞种植于24孔板中,置于细胞培养箱中进行培养,待细胞汇合度为40%时,将培养基更换成无血清培养基,采用Lipofectamine 2000试剂进行转染。转染FOXD1 siRNA的结直肠癌细胞记为si-FOXD1,转染siRNA阴性对照的结直肠癌细胞记为si-NC。转染后的细胞汇合度达到90%时,用胰蛋白酶消化细胞制成细胞悬液,接种于24孔板中,置于细胞培养箱中培养24 h后,在室温下采用直线加速器6 MV 0、2、4、6和8 Gy的X射线垂直照射细胞,所用剂量率为3 Gy/min,照射结束后更换细胞培养基继续培养。
为了解X射线照射对抑制FOXD1的表达的结直肠癌细胞的放射敏感性是否产生影响,本实验对转染后12 h的结直肠癌细胞进行4 Gy剂量的X射线照射,分别记为si-NC+4 Gy组和si-FOXD1+4 Gy组。处理24 h后, 采用qRT-PCR和Western blot检测结直肠癌细胞中FOXD1 mRNA和蛋白的表达。
6.MTT测定结直肠癌细胞增殖:si-NC+4 Gy组和si-FOXD1+4 Gy组结直肠癌细胞处理后,在0、24、48和72 h不同时间点向每孔细胞中加入20 μl浓度为5 mg/ml的四甲基偶氮唑盐(MTT)溶液,37℃孵育4 h后去上清,加入150 μl二甲基亚砜(DMSO)终止反应,用酶标仪读取490 nm处每孔的吸光度值。以时间为横坐标,以测得的A值为纵坐标,绘制细胞增殖曲线。
7.细胞克隆形成测定:取转染后24 h的结直肠癌细胞,于0、2、4、6、8 Gy剂量的X射线照射后,种植到含10 ml培养液的培养皿中。置于37℃培养箱中孵育14 d以后,直至形成细胞克隆。将细胞用4%多聚甲醛固定15 min,并用结晶紫染色液染色20 min。计数含有超过50个细胞克隆数,计算克隆形成率,克隆形成率(%)=(形成的细胞克隆数/接种细胞数)×100%。以对照组细胞克隆形成率为对照,计算各组细胞存活率。
8.放射诱导的DNA依赖性蛋白激酶(DNA-PK)活性测定:各组细胞处理24 h后,用非变性核蛋白提取试剂盒收集核蛋白,使用Sigma TECT DNA-PK试剂盒检测收集到的核蛋白中DNA-PK活性,操作步骤参照试剂盒说明书。配置酶稀释缓冲液,分别混匀后在30℃下反应5 min,在每管中加入终止缓冲液,取10 μl样品加到自组装单分子层薄膜(SAM)上,以去离子水(含2%NaCl)洗膜4次,每次10 min,将未结合的γ-32P同位素及无生物素活性的蛋白质洗掉。将膜室温下晾干,置于液体闪烁计数器中检测放射活性。按照试剂盒说明书上的公式计算DNA-PK活性值。
9.裸鼠中成瘤实验:收集处于对数生长期且稳定转染的结直肠癌细胞,制成细胞悬液,将细胞浓度调整到5×107/ml,取200 μl细胞悬液接种于BALB/c-nu裸鼠右下肢足部皮下,采用随机数表法将裸鼠分为si-NC组、si-FOXD1组、si-NC+4 Gy组和si-FOXD1+4 Gy组共4组,每组6只裸鼠。其中,si-NC组接种转染siRNA阴性对照的细胞,si-FOXD1组接种转染FOXD1 siRNA的细胞,si-NC+4 Gy和si-FOXD1+4 Gy组在分别接种转染siRNA阴性对照和转染FOXD1 siRNA的细胞后,待肿瘤生长至约为100 mm3时,进行X射线照射,照射剂量为4 Gy/次,隔日照射,每5天用卡尺测量肿瘤结节的最短径(a)和最长径(b),根据体积公式计算肿瘤体积,体积=1/6π(a2b),照射20 d后处死裸鼠,切除移植瘤并称重。
10.统计学处理:实验数据用 x±s表示。采用SPSS 21.0软件进行分析。两组数据比较经正态性检验符合正态分布,以独立样本t检验分析;多组之间差异比较经方差齐性检验,用单因素方差分析,组间比较用SNK-q检验。P<0.05为差异具有统计学意义。
结果1. FOXD1的表达在结直肠癌组织和细胞中显著上调:qRT-PCR和Western blot检测结果显示,FOXD1 mRNA(3.20±1.47)和蛋白(2.37±1.34)在结直肠癌组织中的表达量明显高于癌旁正常组织中FOXD1 mRNA(1.41±0.73)和蛋白表达(0.96±0.72),差异有统计学意义(t=5.579、4.816,P < 0.05),见图 1A。FOXD1 mRNA和蛋白在不同结直肠癌细胞HCT116(2.65±0.14、0.65±0.06)、SW480(2.85±0.32、0.74±0.07)、SW620(2.42±0.41、0.59±0.06)、LoVo(3.20±0.21、0.77±0.08)、HT29(2.91±0.30、0.68±0.07)中的表达均明显高于结肠黏膜上皮细胞NCM460 FOXD1 mRNA(1.01±0.08)和蛋白表达(0.26±0.02),差异有统计学意义(mRNA:t=17.62、9.66、5.85、16.88、10.54,蛋白:t=10.68、11.42、9.04、10.71、9.99,P < 0.05),见图 1B。结直肠癌组织和细胞中FOXD1转录和表达水平显著升高,在结直肠癌细胞HCT116中表达量最高,选择结直肠癌细胞HCT116用于后续实验。

|
图 1 FOXD1在结直肠癌组织和细胞中的表达水平A. Western blot检测结直肠癌组织和癌旁正常组织中FOXD1的表达;B. Western blot检测不同结直肠癌细胞系和结肠黏膜上皮细胞NCM460中FOXD1的表达 注:1.癌旁正常组织;2.结直肠癌组织;3.NCM460; 4.HCT116; 5.SW480; 6.SW620; 7.LoVo; 8.HT29 Figure 1 Expression of FOXD1 protein in tissues and cells of colorectal cancer measured by Western blot A. FOXD1 expression in colorectal cancer tissues and adjacent normal tissues; B. FOXD1 expression in different colorectal cancer cell lines and colonic mucosal epithelial cells NCM460 |
2. FOXD1的表达随着X射线照射剂量的增加而升高:对结直肠癌细胞HCT116给予不同剂量的X射线照射后,检测细胞中FOXD1 mRNA和蛋白的表达结果列于图 2。由图 2可见,与0 Gy剂量X射线照射的细胞相比,经不同剂量的X射线照射后的细胞中FOXD1 mRNA和蛋白的表达明显升高,差异有统计学意义(t=9.13、29.39、44.15、13.94、40.42、21.84,P < 0.05)。随着照射剂量的增加,结直肠癌细胞中mRNA和蛋白的表达水平逐渐升高,表明FOXD1的表达与X射线照射呈现出明显的剂量依赖性。
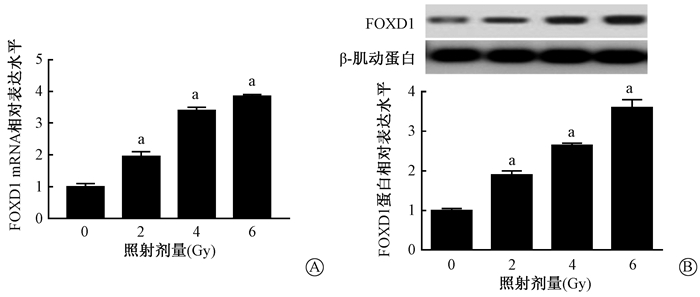
|
图 2 不同剂量X射线照射(0、2、4、6 Gy)对结直肠癌细胞HCT116中FOXD1表达的影响A. qRT-PCR检测结直肠癌细胞中FOXD1 mRNA的水平;B. Western blot检测结直肠癌细胞中FOXD1蛋白水平 注:a与0 Gy组比较,t=9.13、29.39、44.15、13.94、40.42、21.84,P < 0.05 Figure 2 Effect of irradiation on FOXD1 expression in colorectal cancer HCT116 cells irradiated with different doses of X-rays (0, 2, 4, 6 Gy) A. FOXD1 mRNA levels were detected by qRT-PCR; B. FOXD1 protein levels were detected by Western blot |
3.抑制FOXD1的表达提高了结直肠癌细胞的放射敏感性:检测结果列于图 3。由图 3可见,与si-NC组相比,si-FOXD1组结直肠癌细胞中FOXD1蛋白表达明显降低,si-NC+4 Gy组结直肠癌细胞中FOXD1蛋白表达明显增加,差异有统计学意义(t=10.51、8.28,P < 0.05);与si-NC+4 Gy组相比,si-FOXD1+4 Gy组结直肠癌细胞中FOXD1蛋白表达明显降低,差异有统计学意义(t=15.40,P < 0.05)。MTT检测检测结果显示,与si-NC组相比,si-FOXD1组和si-NC+4 Gy组结直肠癌细胞增殖活性在72 h时明显受到抑制,与si-NC+4 Gy组相比,si-FOXD1+4 Gy组细胞增殖活性明显受到抑制,差异有统计学意义(t=10.41、10.56、4.89,P < 0.05)。细胞存活率曲线显示,在不同剂量的X射线照射下,抑制FOXD1的表达显著降低结直肠癌细胞的存活率,与si-NC组相比,差异有统计学意义(t=3.31、4.50、5.45、4.85,P < 0.05),其放射增敏比为1.797。以上结果表明,转染si-FOXD1在有无放射的条件下都能够有效抑制FOXD1的表达;抑制FOXD1的表达可以增强放射诱导的增殖抑制作用,提高结直肠癌细胞的放射敏感性。
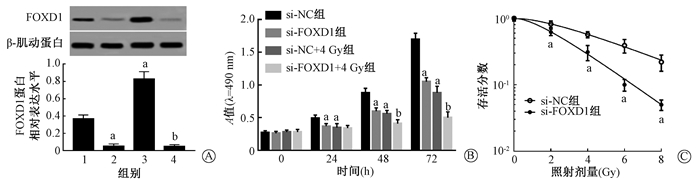
|
图 3 抑制FOXD1表达对结直肠癌细胞放射敏感性的影响A.各组结直肠癌细胞中FOXD1蛋白表达水平;B.MTT法检测各组结直肠癌细胞增殖活性;C.克隆形成实验检测在不同剂量的X射线照射转染处理的结直肠癌细胞的细胞存活分数 注:1.si-NC组;2.si-FOXD1组;3.si-NC+4 Gy组;4.si-FOXD1+4 Gy组。a与si-NC组比较,t=10.51、8.28、10.41、10.56、3.31、4.50、5.45、4.85,P<0.05;b与si-NC+4 Gy组比较,t=15.40、4.89,P < 0.05 Figure 3 Effect of inhibiting FOXD1 on radiosensitivity of colorectal cancer cells A. The expressions of FOXD1 protein in colorectal cancer cells of each group; B. MTT assay was used to detect the proliferation activity of colorectal cancer cells in each group; C. Cell survival fraction of colorectal cancer cells treated with different doses of X-ray irradiation was measured by colony formation assay |
4.抑制FOXD1的表达降低了放射诱导的DNA-PK的活性:DNA-PK活性检测结果列于图 4。由图 4可见,与si-NC组相比,si-NC+4 Gy组结直肠癌细胞中DNA-PK的活性显著升高,差异有统计学意义(t=9.23、10.88、9.06、12.75,P < 0.05)。与si-NC+4 Gy组相比,si-FOXD1+4 Gy组细胞中DNA-PK的活性显著降低,差异有统计学意义(t=4.72、5.25、4.88、6.20,P < 0.05)。说明放射处理显著增加DNA-PK的活性,而抑制FOXD1的表达能够显著降低放射诱导的DNA-PK活性。
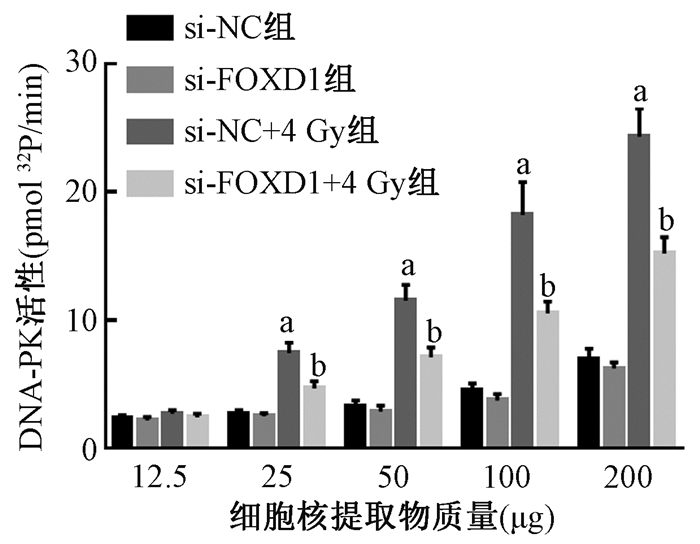
|
图 4 各组结直肠癌细胞中放射诱导的DNA-PK活性检测
注:a与si-NC组比较,t=9.23、10.88、9.06、12.75,P < 0.05; b与si-FOXD1+4 Gy组比较,t=4.72、5.25、4.88、6.20,P < 0.05 Figure 4 Radiation-induced DNA-PK activity in colorectal cancer cells |
5.抑制FOXD1的表达对裸鼠结直肠癌移植瘤的影响:如图 5所示,与si-NC组相比,照射20 d后si-FOXD1组和si-NC+4 Gy组肿瘤体积减小,差异有统计学意义(t=3.52、5.89,P < 0.05);与si-NC+4 Gy组相比,si-FOXD1+4 Gy组肿瘤体积减小,差异有统计学意义(t=11.29,P < 0.05)。照射20 d后处死小鼠并测量肿瘤重量,与si-NC组相比,si-FOXD1组和si-NC+4 Gy组肿瘤重量减轻,差异有统计学意义(t=4.31、6.83,P < 0.05);与si-NC+4 Gy组相比,si-FOXD1+4 Gy组肿瘤重量减轻,差异有统计学意义(t=3.69,P < 0.05)。结果表明,抑制FOXD1的表达提高了裸鼠结直肠癌种植瘤的放射敏感性,有效抑制了肿瘤的生长。
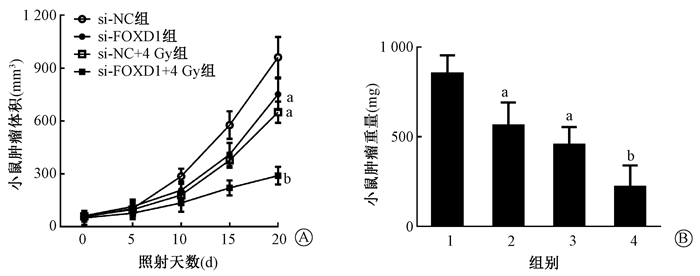
|
图 5 抑制FOXD1表达增加了体内结直肠癌细胞的放射敏感性A.照射后20 d内肿瘤体积的变化;B.照射20 d后处死小鼠并检测肿瘤重量
注:1.si-NC组;2.si-FOXD1组;3.si-NC+4Gy组;4.si-FOXD1+4 Gy组 a与si-NC组比较,t=3.52、5.89、4.31、6.83,P < 0.05;b与si-NC+4 Gy组比较,t=11.29、3.69,P < 0.05 Figure 5 Inhibition of FOXD1 increases radiosensitivity of colorectal cancer cells in vivo A. The tumor volume was measured within 20 d after irradiation; B. The mice were sacrificed and the tumor weight was detected at 20 days after irradiation |
讨论
随着人们生活环境、生活习惯的改变以及致癌因素的增加,近年来结直肠癌的发病率正逐年上升,严重影响着人们的生命及健康。结直肠癌的发生与抑癌基因的失活,原癌基因的活化及DNA损伤修复基因的异常密切相关[8-9]。FOXD1基因广泛存在于真核生物组织和细胞中,参与细胞周期调控、免疫调节等多种生物学功能[10]。在多种肿瘤组织中表达上调,相关研究显示,FOXD1基因是乳腺癌潜在的致癌基因,在乳腺癌组织中表达上调,敲低FOXD1的表达可抑制乳腺癌细胞的增殖活性[11]。本研究对FOXD1在结直肠癌中的表达进行检测,发现FOXD1在结直肠癌组织和细胞中的表达均上调,与以上研究类似。
由于大多数结直肠癌早期症状不明显,在临床诊断时已是中晚期,因此临床采用联合手术和放化疗的综合治疗方式来提高患者的生存率[12]。但是处于中晚期结直肠癌患者对放射治疗往往不敏感,影响放疗效果[13]。因此,提高结直肠癌患者对放射治疗的敏感性是提升治疗结直肠癌效果关键。相关研究表明,基因调控的细胞增殖活性、细胞周期、DNA损伤修复及细胞凋亡等过程与放射敏感性差异密切相关,其本质是与这些生物学过程相关的基因与放射敏感性相关,基因多态性、基因变异等都与放射敏感性差异相关[14-16]。随着基因组学的发展,与肿瘤放射敏感性相关的基因逐渐发掘[17]。FOXD1影响两种关键炎症转录因子NF-AT和NF-κB的活性,FOXD1通过直接调节NF-AT途径的抗炎调节因子,并通过FOXJ1协调对NF-κB途径的抑制来调节炎症反应和自身免疫[18]。最近研究发现,FOXD1的过表达可增强乳腺癌MCF-7细胞的细胞增殖活性,和对化疗药物的耐药性[6]。FOXD1被miR-30a-5p和miR-200a-5p靶向,并通过不依赖p53的方式促进p21表达来抑制人卵巢癌细胞的增殖[19]。本实验的结果显示,结直肠癌细胞在X射线照射后,FOXD1的表达显著升高,且呈现出照射剂量依赖性,结直肠癌细胞增殖活性受到抑制,抑制FOXD1的表达后,对结直肠癌细胞进行不同剂量的照射,结直肠癌细胞增殖活性进一步受到抑制。提示抑制FOXD1的表达可提高结直肠癌细胞的放射敏感性。
目前对肿瘤放疗敏感性的研究中,DNA修复蛋白中DNA依赖的蛋白激酶(DNA-dependent protein kinase,DNA-PK)参与了细胞中DNA非同源末端连接过程,修复由放射所致的DNA双链断裂(DNA double-strand break,DSB)引起的细胞损伤[20-21]。研究认为,细胞中DSB修复缺陷对放射敏感性增加,细胞中DSB修复蛋白表达量升高对放射敏感性比较耐受,说明了DSB修复与放射敏感性的相关性,因此DNA-PK活性显示了DNA损伤修复的能力,最终反映了细胞对放疗的敏感性[22-23]。对于大多数癌细胞,高剂量的电离辐射可能导致DNA断裂和细胞增殖抑制[24]。本实验结果显示,X射线照射抑制了结直肠癌细胞的增殖,降低了DNA-PK活性,与之前的研究一致。抑制FOXD1的表达促进了由X射线照射诱导的DNA-PK活性的降低。由于DNA-PK是DSB修复机制的关键组成部分,表明抑制FOXD1的表达减缓了DSB的修复。由此说明通过转染抑制结直肠癌细胞中FOXD1的表达,可通过抑制DNA DSB修复来抑制细胞增殖,最终增加放射敏感性。
通过体外实验发现,抑制FOXD1的表达可提高结直肠癌细胞的放射敏感性,为进一步验证本实验在裸鼠体内采用皮下种植瘤的方法,建立体内结直肠癌裸鼠模型,检测抑制FOXD1的表达后对裸鼠结直肠癌放射治疗的效果。结果发现,抑制FOXD1的表达经放射治疗后,对裸鼠种植瘤有明显的抑制作用,种植瘤的体积和体重明显降低。说明抑制FOXD1的表达提高了裸鼠结直肠癌对放射的敏感性,有良好的放射治疗效果。
综上,抑制FOXD1基因的表达提高了体外结直肠癌细胞和体内裸鼠结直肠癌的放射敏感性,表明抑制FOXD1基因的表达可能成为提高放射治疗结直肠癌患者疗效的潜在治疗靶点。
利益冲突 全体作者无利益冲突,排名无争议,未因进行该研究而接受任何不正当的职务和财务利益作者贡献声明 倪猛负责实验和论文撰写;殷涛、王旸负责数据统计;王博、郑喜胜协助完成实验;樊宏伟参与研究设计与指导,提出修改意见
| [1] |
Arnold M, Sierra MS, Laversanne M, et al. Global patterns and trends in colorectal cancer incidence and mortality[J]. Gut, 2017, 66(4): 683-691. DOI:10.1136/gutjnl-2015-310912 |
| [2] |
Xu J, Qin X, Wang J, et al. Chinese guidelines for the diagnosis and comprehensive treatment of hepatic metastasis of colorectal cancer[J]. J Cancer Res Clin Oncol, 2011, 137(9): 1379-1396. DOI:10.1007/s00432-011-0999-8 |
| [3] |
许聪, 曹科, 刘兰, 等. 结直肠癌放疗敏感性相关分子生物学标记研究进展[J]. 转化医学电子杂志, 2017, 4(9): 84-87. Xu C, Cao K, Liu L, et al. Advances in sensitive biomarkers of radio-therapy in colorectal cancer patients[J]. E-J Translat Med, 2017, 4(9): 84-87. DOI:10.3969/j.issn.2095-6894.2017.09.020 |
| [4] |
Katoh M, Katoh M. Human FOX gene family (review)[J]. Int J Oncol, 2004, 25(5): 1495-1500. DOI:10.3892/ijo.25.5.1495 |
| [5] |
雒伟伟, 邢沈阳, 赵志辉, 等. 转录因子FOXD1在乳腺癌组织中的表达及意义[J]. 吉林大学学报(医学版), 2010, 36(4): 703-707. Luo WW, Xing SY, Zhao ZH, et al. Expression of FOXD1 in human breast cancer tissues and significance[J]. J Jilin Univ (Med Edit), 2010, 36(4): 703-707. DOI:10.13481/j.1671-587x.2010.04.059 |
| [6] |
Zhao YF, Zhao JY, Yue H, et al. FOXD1 promotes breast cancer proliferation and chemotherapeutic drug resistance by targeting p27[J]. Biochem Biophys Res Commun, 2015, 456(1): 232-237. DOI:10.1016/j.bbrc.2014.11.064 |
| [7] |
Han T, Lin J, Wang YN, et al. Forkhead box D1 promotes proliferation and suppresses apoptosis via regulating polo-like kinase 2 in colorectal cancer[J]. Biomed Pharmacother, 2018, 103(2): 1369-1375. DOI:10.1016/j.biopha.2018.04.190 |
| [8] |
Flohr T, Dai JC, Büttner J, et al. Detection of mutations in the DNA polymerase delta gene of human sporadic colorectal cancers and colon cancer cell lines[J]. Int J Cancer, 1999, 80(6): 919-929. DOI:10.1002/(ISSN)1097-0215 |
| [9] |
Lu Y, Zhou X, Zeng Q, et al. Differential expression profile analysis of DNA damage repair genes in CD133+/CD133-colorectal cancer cells[J]. Oncol Lett, 2017, 14(2): 2359-2368. DOI:10.3892/ol.2017.6415 |
| [10] |
Tokuhiro SI, Tokuoka M, Kobayashi K, et al. Differential gene expression along the animal-vegetal axis in the ascidian embryo is maintained by a dual functional protein Foxd[J]. PLoS Genet, 2017, 13(5): e1006741. DOI:10.1371/journal.pgen.1006741 |
| [11] |
Katoh M, Igarashi M, Fukuda H, et al. Cancer genetics and genomics of human FOX family genes[J]. Cancer Lett, 2013, 328(2): 198-206. DOI:10.1016/j.canlet.2012.09.017 |
| [12] |
Hines RB, Barrett A, Twumasi-Ankrah P, et al. Predictors of guideline treatment nonadherence and the impact on survival in patients with colorectal cancer[J]. J Natl Compr Canc Netw, 2015, 13(1): 51-60. DOI:10.6004/jnccn.2015.0008 |
| [13] |
Reyngold M, Niland J, Ter VA, et al. Trends in intensity modulated radiation therapy use for locally advanced rectal cancer at National Comprehensive Cancer Network centers[J]. Adv Radiat Oncol, 2018, 3(1): 34-41. DOI:10.1016/j.adro.2017.10.001 |
| [14] |
Yin Y, Dou X, Duan S, et al. Downregulation of cell division cycle 25 homolog C reduces the radiosensitivity and proliferation activity of esophageal squamous cell carcinoma[J]. Gene, 2016, 590(2): 244-249. DOI:10.1016/j.gene.2016.05.025 |
| [15] |
Sugase T, Takahashi T, Serada S, et al. SOCS1 gene therapy improves radiosensitivity and enhances irradiation-induced DNA damage in esophageal squamous cell carcinoma[J]. Cancer Res, 2017, 77(24): 6975-6986. DOI:10.1158/0008-5472.CAN-17-1525 |
| [16] |
张玉宇, 王利波, 赵钦, 等. 肿瘤微环境与肿瘤细胞放射敏感性关系的研究进展[J]. 吉林大学学报(医学版), 2016, 42(5): 1038-1044. Zhang YY, Wang LB, Zhao Q, et al. Advanced research on relationship between tumor microenvironment and radiosensitivity of tumor cells[J]. J Jilin Univ (Med Edit), 2016, 42(5): 1038-1044. DOI:10.13481/j.1671-587x.20160540 |
| [17] |
尹丽, 朱广迎. 肿瘤放射敏感性影响因素的研究进展[J]. 中华肿瘤防治杂志, 2012, 19(8): 629-633. Yin L, Zhu GY. Advances of study in affecting factors of tumor radiosensitivity[J]. Chin J Cancer Prev Treat, 2012, 19(8): 629-633. DOI:10.16073/j.cnki.cjcpt.2012.08.001 |
| [18] |
Lin L, Peng SL. Coordination of NF-kappaB and NFAT antagonism by the forkhead transcription factor Foxd1[J]. J Immunol, 2006, 176(8): 4793-4803. DOI:10.4049/jimmunol.176.8.4793 |
| [19] |
Wang Y, Qiu C, Lu N, et al. FOXD1 is targeted by miR-30a-5p and miR-200a-5p and suppresses the proliferation of human ovarian carcinoma cells by promoting p21 expression in a p53-independent manner[J]. Int J Oncol, 2018, 52(6): 2130-2142. DOI:10.3892/ijo.2018.4359 |
| [20] |
Niu Y, Zhang X, Zheng Y, et al. XRCC1 deficiency increased the DNA damage induced by γ-ray in HepG2 cell:Involvement of DSB repair and cell cycle arrest[J]. Environ Toxicol Pharmacol, 2013, 36(2): 311-319. DOI:10.1016/j.etap.2013.04.009 |
| [21] |
Koch B, Maser E, Hartwig A. Low concentrations of antimony impair DNA damage signaling and the repair of radiation-induced DSB in HeLa S3 cells[J]. Arch Toxicol, 2017, 91(12): 3823-3833. DOI:10.1007/s00204-017-2004-z |
| [22] |
Tomita M. Involvement of DNA-PK and ATM in radiation-and heat-induced DNA damage recognition and apoptotic cell death[J]. J Radiat Res, 2010, 51(5): 493-501. DOI:10.1269/jrr.10039 |
| [23] |
Blackford AN, Jackson SP. ATM, ATR, and DNA-PK:the trinity at the heart of the DNA damage response[J]. Mol Cell, 2017, 66(6): 801-817. DOI:10.1016/j.molcel.2017.05.015 |
| [24] |
Mladenov E, Magin S, Soni A, et al. DNA double-strand-break repair in higher eukaryotes and its role in genomic instability and cancer:cell cycle and proliferation-dependent regulation[J]. Semin Cancer Biol, 2016, 37-38: 51-64. DOI:10.1016/j.semcancer.2016.03.003 |
 2018, Vol. 38
2018, Vol. 38


