2. 201321 上海市质子重离子医院 辐射防护 办公室
2. Office of Radiation Protection, Shanghai Proton and Heavy Ion Center, Shanghai 201321, China
质子重离子放射治疗技术自1954年劳伦斯伯克利国家实验室首次应用于临床以来,因其优越的物理和生物特性,获得了放射肿瘤医生的认可[1-2]。目前全球范围内各医疗机构兴起了一股质子重离子临床应用的热潮[3];在这个大背景下,质子重离子治疗的从业者包括放射肿瘤医生、物理师、治疗师、工程师、护师正在不断增多。治疗师须要在治疗结束后约1 min进入机房解除患者固定装置、搀扶患者;由于高能粒子与物质相互作用的物理特性,在粒子路径上的空气、人体组织和肿瘤会被活化产生放射性[4],治疗师在此过程中不可避免地会受到感生放射性的照射。上海市质子重离子医院在2014年运用西门子粒子治疗设备进行了临床实验[5],做了少数病例的测量,结果显示质子和碳离子束流照射结束后1 min,距离患者肿瘤30 cm处的剂量率分别为0.96和0.30 μSv/h;除此之外,目前国内对于质子重离子放射治疗造成的职业照射研究尚属空白。日本放射医学研究所的相关研究结论显示医务工作者和患者陪护人员所受的照射剂量远低于国际放射防护委员会(ICRP)所推荐的限值[6]。本研究对该院治疗师在质子重离子临床实践中受到的职业照射进行了更加全面系统的研究并总结出了影响职业照射的因素,评估了该院治疗师所受的年平均剂量。
材料与方法1.设备与仪器:治疗设备为德国西门子粒子治疗设备(IONTRIS系统),具备点扫描技术,同步加速器,可加速碳离子到85~430 MeV/u,加速质子到50~250 MeV。测量仪器为美国华瑞科学仪器有限公司的Neutron RAE Ⅱ光子/中子辐射剂量仪,定期经中国计量科学研究院检定,其光子检测器为1 cm3的CsI,中子检测器为1 cm3的LiI;光子能量响应范围为0.06~3.0 MeV,中子能量响应范围为 < 14 MeV;光子灵敏度>30 align="center"ps·Sv-1·h-1, 中子灵敏度为1~2 cps/2.5个中子·s-1·cm-2。
2.临床资料:通过简单随机抽样方法选取2016年9—11月期间治疗的40例患者,其中质子和重离子治疗各20例。碳离子病例的等效处方剂量平均值为342 cGyE(cGy Equivalent),粒子数目为(20.43±19.42)×108,质子病例的等效处方剂量平均值为198 cGyE,粒子数目为(1 514.70±876.98)× 108。束流照射时间约为10 ~30 min,照射野数目在2到5个不等。照射部位涵盖了头颈、胸腹部、盆腔部、下肢。
3.测量方法:本研究的德国西门子粒子治疗设备采用了同步加速器笔形束电磁扫描技术从而无需使用多页准直器、准直器、修整器等器件,质子或重离子的能量近乎全部沉积在患者肿瘤处,因此将感生放射性较大的患者肿瘤作为辐射源。记录了治疗计划中每个患者的粒子类型、粒子总数、处方剂量。每个患者出束开始后开始监测控制室内光子/中子辐射剂量仪剂量率读数并记录一个稳定读数;为了测量到最大辐射值,在治疗结束治疗床移动至最低安全位置后(约治疗结束1 min),立即进入机房将测量仪器放于距肿瘤最近的皮肤处停留5 s, 待读数稳定记录剂量率读数;然后记录距离肿瘤约30 cm处(治疗师立位处)相对稳定的剂量率读数;最后记录患者的固定装置、床、机械臂、束流应用及监测系统(BAMS)窗口处的剂量率数值。
4.统计学处理:应用SPSS 19.0软件对数据进行处理。分别绘制质子和碳离子的粒子总数与距肿瘤最近的皮肤处剂量率的散点图,采用Pearson法分析粒子总数与距肿瘤最近的皮肤处剂量率的相关性。P < 0.05为差异有统计学意义
结果1.碳离子和质子的处方剂量、粒子总数、剂量率对比情况:由表 1、2可知,40例患者所使用质子的平均粒子总数是碳离子平均粒子总数的74.14倍,而平均处方剂量却只是碳离子平均处方剂量的0.58倍;同时质子治疗后的距肿瘤最近皮肤处的平均剂量率是碳离子的13.88倍。结果说明,为了达到相同的等效处方剂量需要的质子数目比碳离子数目更多,造成的距肿瘤最近皮肤处的感生辐射比碳离子也更大。
|
|
表 1 用于治疗40例患者的处方剂量、粒子总数及对应患者各测量点位的剂量率(μSv/h) Table 1 Particle type, total particle number, prescribed doses, dose rates at measurement points for 40 patianets (μSv/h) |
|
|
表 2 碳离子和质子病例的等效处方剂量、粒子总数、各点位处剂量率对比(μSv/h,x±s) Table 2 Comparison of prescription doses, total particle number and dose rates at measurement points between carbon and proton particles (μSv/h, x±s) |
2.距肿瘤最近的皮肤处与距肿瘤约30 cm处剂量率对比情况:距肿瘤最近的皮肤处剂量率为(20.68±21.91)μSv/h,是距肿瘤约30 cm处剂量率(2.03±2.84)μSv/h的10.19倍。结果说明了患者肿瘤接受质子或碳离子照射后形成的辐射场强度随与放射源的距离增加而减弱,因此,治疗师要注意采取适当的距离防护可以减少所受的职业照射。
3.肿瘤受照后的感生放射性水平与粒子总数的关系:肿瘤治疗结束1 min后,距肿瘤最近皮肤处的剂量率与所用的粒子总数呈显著正相关(r=0.828,P < 0.05,图 1,2)。考虑到为了减小测量患者治疗后感生辐射水平的随机误差,本研究突出测量了距肿瘤最近的皮肤处剂量率,并以此代表患者肿瘤治疗后的感生放射性水平,来探究与治疗用的粒子数目的关系。粒子数目越多,发生的核反应次数越多,核分裂产生的放射性同位素、正电子等越多,产生的感生放射性越大,因此导致距肿瘤最近的皮肤处剂量率越大。但由于不同患者的肿瘤深度不同、治疗时长不同以及测量方法和工具导致的随机性误差,出现了几个偏离拟合线较大的点。
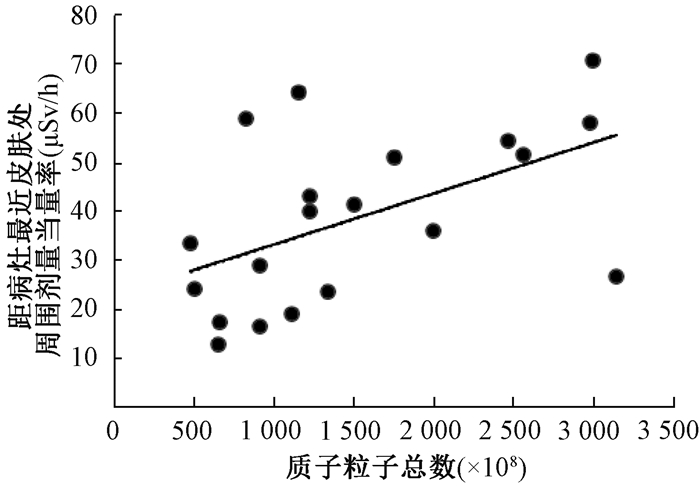
|
图 1 距肿瘤最近的皮肤处剂量率随质子总数变化 Figure 1 Variations in dose rates at skin closest to tumor with total proton number |
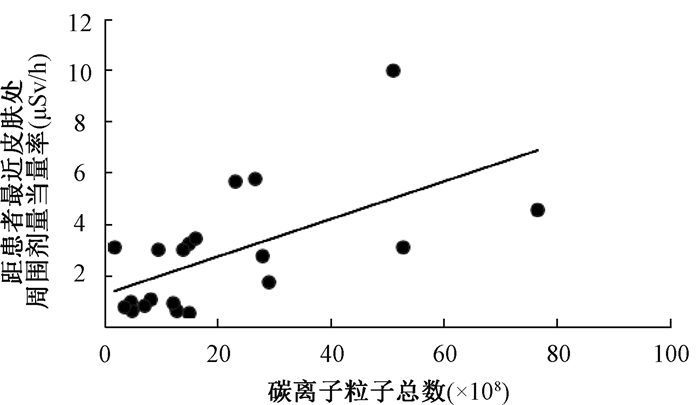
|
图 2 距肿瘤最近的皮肤处剂量率随碳离子总数变化 Figure 2 Variations in dose rates at skin closest to tumor with total carbon number |
4.其他点位剂量率和中子测量情况:测量中未检测到中子;测得控制室内剂量率为(0.08±0.01)μSv/h,患者的固定装置、床、机械臂、BAMS窗口处剂量率为(0.09±0.01)μSv/h。
5.年平均剂量:治疗师的工作位置距肿瘤约为30 cm,此处的平均剂量率为2.031 μSv/h。治疗结束约1 min后,治疗师进入机房解除固定装置陪护患者的时间约3 min,并且为了估算出较大的剂量,忽略了放射性核素衰减。每个治疗师按照最大工作负荷计算,每天接触20个治疗后的患者,每年约有250个工作日,可得年平均剂量约为0.508 mSv。
讨论本研究发现患者治疗后的感生辐射水平与粒子数目密切相关,由于碳离子的等效剂量是质子的2~3倍,要达到相同的剂量所需要的碳离子数目远远小于质子数目;造成了质子治疗后的患者感生辐射水平明显高于碳离子治疗后的患者。目前该院的质子治疗人次占比不高,而且以后会着重发展重离子治疗的优势,因此本研究中选取了相同的质子和碳离子病例数目,所得到治疗师受到的平均剂量率应该比实际值高。质子或重离子路径上的空气和人体正常组织也会被活化,但由于质子或重离子束的布拉格峰(Bragg peak)型的剂量分布并且该院质子重离子设备可将布拉格峰调制到肿瘤处,空气和正常组织的活化对治疗师的职业照射贡献很小。该院的西门子粒子治疗设备采用先进的点扫描技术,既提高了束流利用率,又在不使用患者补偿器和准直器的情况下实现了调制束流;同时采用同步加速器,实现了主动能量调制而不需要调制器、过滤器、降能器等会使粒子产生散射和能散变宽的器件[7],减少了中子和放射性核素的产生。本研究的局限和不足之处在于:①只研究了治疗师的外照射,实际上,在患者的治疗计划验证和设备质量保证(QA)以及维修保养过程中物理师和工程师也会受到职业照射,今后可以研究物理师、工程师的感生放射性所致职业照射水平。②为了不影响治疗师工作和方便测量,采用了便携式的测量仪器,该仪器在精确度和灵敏度上可能比其他仪器存在劣势;同样受仪器限制,本文没有研究治疗师的皮肤吸收剂量,这可以作为以后的研究方向。③本研究中,病例数目偏少,测量点位可能不全面,今后可以增加更多特殊病例和点位的测量。
利益冲突 无作者贡献声明 刘珠磊负责收集资料、撰写论文;王孝娃负责指导论文修改;任炜负责摘要翻译、指导研究思路
| [1] |
Hirohiko T. History of charged particle radiotherapy[M]. London: Springer, 2014.
|
| [2] |
Ando K, Kase Y. Biological characteristics of carbon-ion therapy[J]. Int J Radiat Biol, 2009, 85(9): 715-728. DOI:10.1080/09553000903072470 |
| [3] |
蒋国梁. 质子和重离子放疗在中国[J]. 中华放射医学与防护杂志, 2016, 36(8): 561-563. Jiang GL. Proton and heavy ion radiotherapy in China[J]. Chin J Radiol Med Prot, 2016, 36(8): 561-563. DOI:10.3760/cma.j.issn.0254-5098.2016.08.001 |
| [4] |
Yonekura Y, Tsujii H, Hopewell JW, et al. Radiological protection in ion beam radiotherapy:practical guidance for clinical use of new technology[J]. Annals of the ICRP, 2016, 45(1_suppl). DOI:10.1177/0146645316630708 |
| [5] |
周丹, 傅深, 李萍, 等. 前列腺癌质子碳离子治疗设备成像系统应用研究[J]. 中华放射肿瘤学杂志, 2016, 25(2): 164-167. Zhou D, Fu S, Li P, et al. The application of the proton and carbon ion treatment equipment imaging system in prostate cancer therapy[J]. Chin J Radiat Oncol, 2016, 25(2): 164-167. DOI:10.3760/cma.j.issn.1004-4221.2016.02.017 |
| [6] |
Tujii H, Akagi T, Akahane K, et al. Research on radiation protection in the application of new technologies for proton and heavy ion radiotherapy[J]. Igaku Butsuri, 2012, 19(5): 172-206. DOI:10.11323/jjmp2000.28.4_172 |
| [7] |
刘世耀. 质子和重离子治疗及其装置[M]. 北京: 科学出版社, 2016: 169-170. Liu SY. Proton and heavy ion therapy and its device[M]. Beijing: Science Press, 2016: 169-170. |
 2018, Vol. 38
2018, Vol. 38


