我国是世界上食管癌高发地区之一,每年平均约15万人死于该病,其中90%为食管鳞癌。局部晚期食管癌5年生存率< 20%[1],首选根治性放化疗,放化疗联合治疗会明显地提高食管癌生存率[2-3],但是增加放疗剂量并不能达到满意的效果[4],因此有必要寻找低毒有效的放射增敏药物。Stattic是一种卟啉类非肽小分子,通过与STAT3蛋白的SH2功能区结合,抑制STAT3基因的表达、蛋白的活化、二聚体的形成及向细胞核内移动,从而抑制STAT3的核转运,是STAT3的特异性抑制剂[2]。前期已在细胞水平验证了Stattic通过抑制STAT3和缺氧诱导因子-1α(HIF-1α)途径增加食管癌细胞株的放射敏感性[5],本研究探讨了Stattic对食管癌裸鼠移植瘤的放射敏感性及其机制。
材料与方法1.细胞株:食管癌ECA109细胞株购于中国科学院上海细胞库,细胞置于含1%青霉素和链霉素、10%胎牛血清的RPMI 1640培养液中,37.5℃、5%CO2培养箱中培养,取对数生长期细胞进行实验。
2.动物:BALB/c裸鼠24只,体重14~16 g,4~5周龄,雄性,购于北京维通利华科技服务有限公司,动物合格证号为SYXK(苏)2008-0007,饲养于南京医科大学实验动物中心SPF级无菌饲养室,湿度60%~70%,室温21~26℃,饲料、饮水均经过无菌消毒。
3.试剂及药物:Stattic购于美国Sigma公司,二甲基亚砜(DMSO)购于南京医科大学,RPMI 1640培养基购于美国GIBCO公司。小牛血清购于杭州四季青生物工程材料有限公司。STAT3抗体和磷酸化STAT3(p-STAT3)抗体购自美国Cell Signaling Technology公司。缺氧诱导因子-1α(HIF-1α)抗体、血管内皮生长因子(VEGF)抗体和β-肌动蛋白抗体购自美国Santa Cruz公司。
4.照射条件:使用160-X射线治疗机,型号为:RS-2000 Pro Biological Irradiation,美国RAD-SOURCE公司。将裸鼠右腋下移植瘤部位置于照射野中,射野为2.0 cm×1.5 cm,其余部分用1 cm厚的铅块遮蔽,源皮距(SSD)为100 cm,吸收剂量为6 Gy,吸收剂量率为4.48 Gy/min。
5.模型建立及实验分组:取对数生长期ECA109细胞,调整细胞浓度为5×106/ml,在裸鼠右腋下皮下接种(0.1 ml/只),待移植瘤平均体积增至125 mm3,采用随机数表法将裸鼠分为4组:药物+照射组(25 mg/kg Stattic+6 Gy)、单纯药物组(25 mg/kg Stattic)、单纯照射组(6 Gy)及对照组。涉及到药物的裸鼠每天腹腔注射Stattic 25 mg/kg,隔天注射1次,3次注射后肿瘤体积约150 mm3,行6 Gy X射线照射,放射后继续给小鼠按隔天1次的频率注射两次Stattic。对照组和单纯照射组,隔天注射1次磷酸盐缓冲液(PBS),后各组均不予任何处理。观察肿瘤的生长速度和瘤体大小的变化,在第25天处死裸鼠,移植瘤标本通过Western blot或免疫组织化学法分析肿瘤中的p-STAT3、STAT3、HIF-1α和VEGF的含量。
6.抑瘤效应观察:用游标卡尺测量移植瘤最大长径(a)和最大短径(b),每2天测量1次,照射25 d后断颈处死裸鼠,移植瘤体积V=ab2/2,计算移植瘤体积抑制率。移植瘤体积抑制率(%)= (1-实验组平均瘤体积/对照组平均瘤体积)× 100%。
7.Western blot检测肿瘤内pSTAT3、STAT3、HIF-1α、VEGF蛋白的表达:将20 g移植瘤剪碎放入300 μl组织裂解液中裂解30 min,将其磨成细胞悬液,离心半径30 cm,1 400 r/min,离心5 min。用二喹啉甲酸(BCA)法测蛋白浓度。浓度相同的情况下,进行Western blot,电泳60/120 V,共约1.0 h,电泳后转膜恒流300 mA,转膜后牛奶封闭1 h(室温),TBST漂洗1遍,一抗孵育过夜(4℃),TBST清洗3次后,二抗室温孵育1 h,TBST漂洗3次,1-8然后用增强化学发光(ECL)试剂盒显影。
8.STAT3、HIF-1α及VEGF蛋白的表达:肿瘤组织经10%中性甲醛免疫组织化学法检测肿瘤内pSTAT3固定,梯度乙醇脱水,石蜡包埋,以10 μm厚度切片;每张切片经过对组织抗原进行相应的修复和阻断内源性过氧化物酶的活性后;各加入50 μl的抗pSTAT3及抗STAT3及抗HIF-1α及抗VEGF的单克隆抗体,室温下孵育60 min;每张切片加50 μl即用型MaxVisionTM试剂,室温下孵育15 min,再加入1 000 μl新鲜配置的增敏二氨基联苯胺(DAB)显色液,显微镜下观测3~5 min,冲洗,复染,脱水干燥,中性树胶封固。结果判定,以PBS代替一抗作为空白对照,以羊血清代替一抗作为阴性对照。HIF-1α阳性反应为黄色到棕褐色,定位于细胞核,亦可见于胞质,未染色者为阴性。
9.统计学处理:采用Graph Pad 5.0软件分析食管癌ECA109细胞裸鼠抑制瘤。计量资料符合正态分布采用x±s表示。采用配对t检验进行比较。P < 0.05为差异有统计学意义。
结果1.Stattic及照射对食管癌ECA109细胞裸鼠移植瘤的影响:药物+照射组较对照组、单纯照射组明显抑制食管癌ECA109细胞裸鼠的移植瘤的生长;体积变化趋势发现药物+照射较其他各组明显抑制肿瘤的生长,由表 1可见,处理前各实验组裸鼠瘤体积无明显差异(P>0.05),处理后药物+照射组与单纯药物组、单纯照射组相比,瘤体大小差异具有统计学意义(t=14.14、4.35,P < 0.05)。
|
|
表 1 Stattic及电离辐射对食管癌ECA109细胞裸鼠抑制瘤的影响(x±s) Table 1 The radiosensitization effect of stattic on ECA109 xenograft in nude mice (x±s) |
2.Stattic及照射对食管癌ECA109细胞裸鼠移植瘤pSTAT3、STAT3、HIF-1α及VEGF蛋白表达的影响:Western blot显示,在移植瘤组织中,单纯药物组与对照组相比,pSTAT3、HIF-1α及VEGF蛋白水平降低。药物+照射组与单纯照射组相比,移植瘤中pSTAT3、HIF-1α及VEGF蛋白水平表达明显降低,并且较对照组和单纯药物组也降低,见图 1。
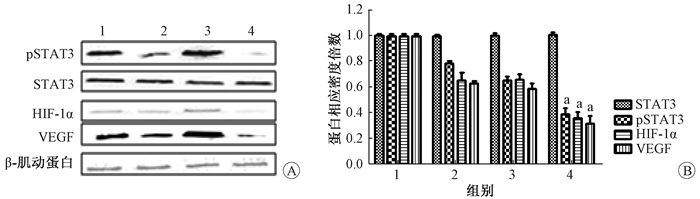
|
图 1 Western blot显示Stattic及照射对食管癌ECA109细胞裸鼠移植瘤pSTAT3、STAT3、HIF-1α及VEGF蛋白表达的影响 A.各处理组蛋白电泳图;B. STAT3、pSTAT3、HIF-1α、VEGF蛋白相对表达量 注:1.对照组;2.单纯药物组;3.单纯照射组;4.药物+照射组。a与同一蛋白单纯照射组比较,t=17.07、5.05、3.54,P < 0.05 Figure 1 Western blot analysis of p-STAT3, STAT3, HIF-1α, and VEGF levels in ECA109 xenografts dissected from nude mice exposed to IR and/or static A. Histone electropherogram of each treatment group; B. Relative expression of STAT3, pSTAT3, HIF-1α, and VEGF protein |
免疫组织化学显示,pSTAT3、HIF-1α及VEGF对照组移植瘤微血管密度高,各种管径的毛细血管形态多样,而药物+照射联合组肿瘤血管明显减少,且血管形态较一致,分支也少,见图 2。
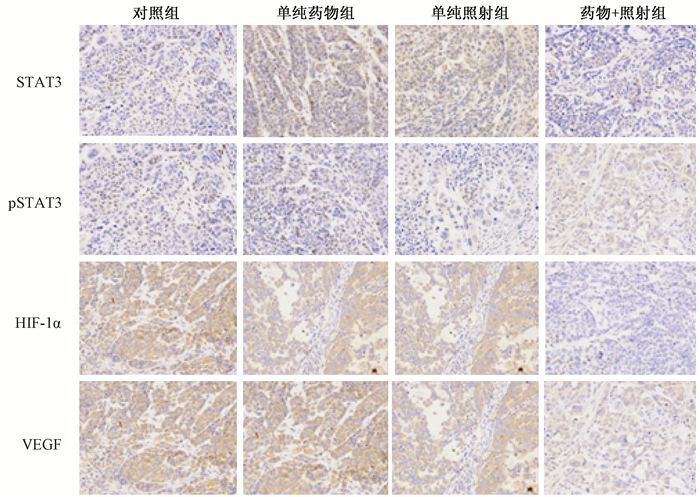
|
图 2 免疫组织化学法显示Stattic及照射对食管癌ECA109细胞裸鼠移植瘤pSTAT3、STAT3、HIF-1α及VEGF蛋白表达的影响 Figure 2 Immunohistochemistry analysis of STAT3, p-STAT3, HIF-1α, and VEGF protein levels in ECA109 xenografts dissected from nude mice exposed to IR and/or static. |
讨论
食管癌细胞的放射抗拒是导致5年生存率低的原因之一,因此,探寻与食管癌放射治疗相关的耐辐射基因及其作用机制,抑制耐辐射基因的表达,增加食管癌放射治疗敏感性,对提升食管癌生存率具有重要的临床意义。
目前已有研究表明Stattic与放射敏感性有关:GRIM-19通过抑制STAT3表达而促使鼻咽癌细胞放射增敏性[3],高表达STAT3能增加非小细胞型肺癌细胞及头颈部鳞状上皮癌细胞的抗辐射能力[6-7],阻断STAT3活性即可增强细胞放射敏感性[8]。STAT3作为肿瘤基因在肿瘤的发生、发展、转移和治疗中都起着重要的调节作用[9],而持续激活的STAT3直接参与了多种癌症的发生发展,通过上调缺氧诱导因子-1(HIF-1)、B淋巴细胞瘤-2基因(Bcl-2)、凋亡抑制基因(Bcl-xL)等表达,促进细胞的生长和生存。Stattic是STAT3的特异性抑制剂,已有文献表明通过体外与体内实验全面阐述了Stattic在头颈部鳞癌中的作用,并提出Stattic对头颈部鳞癌有放疗增敏作用,可以作为一种价值的治疗手段[10]。
前期实验已经证实Stattic对食管癌ECA109细胞已具有放射增敏作用[6],但离体实验有效的放射增敏剂有时在整体实验中不是都有效,因此,本实验在离体细胞实验的基础上,通过建立食管癌ECA109细胞裸鼠移植瘤模型,观察Stattic在动物体内的放射增敏效应。本实验表明,Stattic联合放射能明显抑制裸鼠肿瘤生长,并且依据肿瘤体积变化趋势可知,Stattic联合放射较其他组抑制肿瘤生长最为明显,同时发现Stattic联合放射治疗时,STAT3、HIF-1及VEGF蛋白表达量最低。而当HIF-1表达增加,促使细胞内的VEGF表达增多,从而使肿瘤血管再生,使处于S期的细胞再氧合,引起DNA的复制,从而使肿瘤的放射抗拒性增加,促进肿瘤的侵袭及转移[11]。由此可见,Stattic能抑制裸鼠肿瘤细胞内STAT3的表达,抑制HIF-1转录活性,降低下游VEGF水平,抑制血管再生,促进放射敏感性,即Stattic对食管癌ECA109细胞裸鼠移植瘤具有明显的放射增敏作用,其增敏作用与抑制STAT3、HIF-1及VEGF蛋白表达相关。这为Stattic在放疗增敏及个体化肿瘤治疗中的临床应用提供新的参考。
利益冲突 无作者贡献声明 张曲、张弛负责研究方案的设计、数据整理;徐姣珍负责论文撰写与修改;罗波负责数据分析;马建新负责文中图片分析及整理
| [1] |
Zhang Y. Epidemiology of esophageal cancer[J]. World J Gastroenterol, 2013, 19(34): 5598-5606. DOI:10.3748/wjg.v19.i34.5598 |
| [2] |
Uehara Y, Mochizuki M, Matsuno K, et al. Novel high-throughput screening system for identifying STAT3-SH2 antagonists[J]. Biochem Biophys Res Commun, 2009, 380(3): 627-631. DOI:10.1016/j.bbrc.2009.01.137 |
| [3] |
Ho Y, Tsao SW, Zeng M, et al. STAT3 as a therapeutic target for Epstein-Barr virus (EBV):associated nasopharyngeal carcinoma[J]. Cancer Lett, 2013, 330(2): 141-149. DOI:10.1016/j.canlet.2012.11.052 |
| [4] |
Aggarwal BB, Kunnumakkara AB, Harikumar KB, et al. Signal transducer and activator of transcription-3, inflammation, and cancer:how intimate is the relationship?[J]. Ann NY Acad Sci, 2009, 1171: 59-76. DOI:10.1111/j.1749-6632.2009.04911.x |
| [5] |
张曲, 张弛, 杨曦, 等. Stattic对乏氧食管癌细胞放射增敏作用机制的研究[J]. 中华放射医学与防护杂志, 2016, 36(7): 491-495. Zhang Q, Zhang C, Yang X, et al. Mechanism of radiosensitization effect of Stattic on human esophageal squamous cellcarcinoma in hypoxia[J]. Chin J Radiol Med Prot, 2016, 36(7): 491-495. DOI:10.3760/cma.j.issn.0254-5098.2016.07.003 |
| [6] |
Aggarwal BB, Kunnumakkara AB, Harikumar KB, et al. Signal transducer and activator of transcription-3, inflammation, and cancer:how intimate is the relationship?[J]. Ann NY Acad Sci, 2009, 1171: 59-76. DOI:10.1111/j.1749-6632.2009.04911.x |
| [7] |
Aggarwal BB, Sethi G, Ahn KS, et al. Targeting signal-transducer-and-activator -of-transcription-3 for prevention and therapy of cancer:modern target but ancient solution[J]. Ann NY Acad Sci, 2006, 1091: 151-169. DOI:10.1196/annals.1378.063 |
| [8] |
Wang X, Crowe PJ, Goldstein D, et al. STAT3 inhibition, a novel approach to enhancing targeted therapy in human cancers (review)[J]. Int J Oncol, 2012, 41(4): 1181-1191. DOI:10.3892/ijo.2012.1568 |
| [9] |
Marotta LL, Almendro V, Marusyk A, et al. The JAK2/STAT3 signaling pathway is required for growth of CD44+CD24- stem cell-like breast cancer cells in human tumors[J]. J Clin Invest, 2011, 121(7): 2723-2735. DOI:10.1172/JCI44745 |
| [10] |
Adachi M, Cui C, Dodge CT, et al. Targeting STAT3 inhibits growth and enhances radiosensitivity in head and neck squamous cell carcinoma[J]. Oral Oncol, 2012, 48(12): 1220-1226. DOI:10.1016/j.oraloncology.2012.06.006 |
| [11] |
Gregg L, Semenza. Hypoxia-inducible factors:mediators of cancer progression and targets for cancer progression and targets for cancer therapy[J]. Trends Pharmacol Sci, 2012, 33(4): 207-214. DOI:10.1016/j.tips.2012.01.005 |
 2018, Vol. 38
2018, Vol. 38


