2. 450000 郑州大学附属郑州中心医院病理科;
3. 710043 西安市华山中心医院妇产科
2. Department of Pathology, Zhengzhou Central Hospital Affiliated to Zhengzhou University, Zhengzhou 450000, China;
3. Department of Gynecology and Obstetrics, Huashan Central Hospital, Xi'an 710043, China
宫颈癌作为妇科最为常见的恶性肿瘤之一,目前,临床上治疗宫颈癌主要采用手术和放疗为主,化疗为辅的综合治疗方案,对于部分宫颈癌晚期病灶,放疗也成为其治疗的重要手段[1]。但是研究发现,30%的浸润性宫颈癌患者对放射治疗不敏感,放疗后预后不佳,易复发[2]。因此,研究宫颈癌放射治疗敏感性的影响因素对于提高患者生存率和治疗方案的选择,具有重要的临床意义。微小RNA(microRNA或miRNA)与肿瘤的关系是当前研究的热点,其不仅调控肿瘤细胞增殖、凋亡等生理病理活动,而且参与到肿瘤放疗敏感性[3]。有研究发现miRNA-95与肿瘤抗辐射性密切相关,在抗辐射的PC3肿瘤细胞中,miRNA-95呈上升趋势其促进前列腺癌、乳腺癌细胞生长并对辐射治疗产生抗性,并提示miRNA-95可能作为肿瘤细胞抗辐射治疗的参考指标[4-5]。但是,miRNA-95在宫颈癌的放疗敏感性中是否发挥作用及其作用方式和机制,尚无研究。因此,本课题检测放疗后宫颈癌患者肿瘤组织和细胞中miRNA-95表达水平,并通过转染辐射抵抗的人宫颈癌HeLa和SiHa细胞调控miRNA-95表达水平以揭示其如何影响宫颈癌的放疗敏感性。
材料和方法1.主要试剂:人宫颈癌细胞系Me180、HeLa、SiHa购自中国科学院上海生命科学研究院细胞资源中心;DMEM细胞培养基、胎牛血清、1%青霉素和链霉素双抗购自美国Hyclone公司;CCk-8试剂盒购自美国Thermo公司;LipofectamineTM2000转染试剂购自上海生工公司;microRNA快速提取试剂盒、TaqMan microRNA反转录试剂盒、荧光Real-time PCR试剂盒(日本TaKaRa公司);Annexin-V/PI细胞凋亡试剂盒购自北京博奥生公司;双荧光素酶活性实验检测试剂盒(美国Invitrogen公司)。
2.组织标本的采集:采取自2014年2月至2016年12月就诊于郑州大学附属郑州中心医院,已确诊并根据宫颈癌国际妇产科联盟(FIGO)分期为Ⅲ~Ⅳ期的鳞状细胞宫颈癌患者的宫颈癌组织标本40例。将组织标本放入液氮罐中保存备用。纳入本研究中患者标本标准为:患者接受标准的根治放射治疗,且未接受其他任何治疗;采用全盆腔45 Gy/25次,宫颈癌宫旁浸润较广需要宫旁加重的患者,宫旁加重10~15 Gy/5~7次,以192Ir宫腔内放疗,15~20 Gy/4~5次;宫颈癌患者放疗后肿瘤完全消退,并且治疗结束后在6个月内宫颈无可见肿瘤认为是放疗敏感的宫颈癌患者,列入放疗敏感患者组(20例),而放疗后宫颈内仍可见残留肿瘤或放疗结束后6个月宫颈癌活检证实为可见肿瘤认为是放疗不敏感宫颈癌患者,列入放疗耐受患者组(20例)。同时采集的肿瘤组织标本经HE染色后显微镜下观察肿瘤细胞>70%认为采集标本合格。本研究中分别收集的对放射治疗敏感和不敏感的宫颈鳞癌患者的年龄和临床病理分期差异无统计学意义。同时所有临床标本的采集和检测均征得患者的知情同意并签署同意书,及进行相应的完整治疗和随访。
3.细胞培养:根据文献[6],选择对辐射抵抗的人宫颈腺癌来源的HeLa细胞株和人宫颈鳞癌来源的SiHa细胞株来检测不同辐射敏感性的宫颈癌细胞株中miRNA-95的表达差异, 并以对辐射较为敏感的人宫颈表皮癌细胞Me180细胞株为对照。分别将HeLa、SiHa、Me180细胞培养于含10%胎牛血清的DMEM细胞培养基中,并置于37℃、5%CO2的细胞培养箱中培养。当各组细胞生长至70%以上,开始胰酶消化并传代扩大培养,应用于后续研究。
4.Real-time PCR检测不同放射敏感性宫颈癌组织和细胞中miRNA-95表达情况:分别将采集的放射敏感组和放射耐受组宫颈癌患者的肿瘤组织样品各取约10 mg,按照microRNA快速提取试剂盒方法提取各组宫颈癌组织中的总miRNA。使用TaqMan MicroRNA反转录试剂盒将提取的总miRNA反转录成cDNA。再按照GO Taq qPCR试剂盒的方法进行实时荧光定量PCR反应。qPCR反应中目的基因miRNA-95和内参U6基因的引物序列见表 1,由上海生工生物公司设计合成。利用IQ5TM Real-time PCR Detection Systerm系统检测分析各组样品中miRNA-95的相对表达量,用2-ΔΔCt表示。同时收集不同辐射敏感性的人宫颈癌HeLa、SiHa、Me180细胞,按照同样的方法检测不同放射敏感性宫颈癌细胞系中miRNA-95的相对表达量。
|
|
表 1 miRNA-95和U6基因的Real-time PCR反应引物序列 Table 1 The Real-time PCR primer sequences of miRNA-95 and U6 gene |
5.细胞转染及分组:选取对放射抵抗的人宫颈癌HeLa和SiHa为研究对象,分别将由上海生工生物公司设计合成并经过有效筛选的miRNA-95 mimics(miRNA-95模拟物)、miRNA-95 inhibition(miRNA-95抑制物)转染至HeLa、SiHa细胞。取对数生长期的HeLa和SiHa细胞,胰酶消化后收集细胞并用细胞培养基稀释成105个/ml,接种至6孔板中,当细胞贴壁生长至70%以上后,使用LipofectamineTM2000转染试剂盒分别将50 nmol/L的miRNA-95 mimics和miRNA-95 inhibition转染至宫颈癌细胞中,设定为miRNA-95 mimics组和miRNA inhibitions组。同时按照相同的方法转染无义的microRNA至相应宫颈癌细胞中作为阴性对照(miRNA NC组)。各组细胞转染48 h后,利用反转录Real-time PCR方法检测转染后miRNA-95表达情况。
6.CCK-8法检测各组宫颈癌细胞增殖率:按照细胞增殖计数(CCK-8)试剂盒方法检测各组转染后的宫颈癌HeLa、SiHa细胞增殖能力变化。在SiHa、HeLa细胞转染miRNA-95 mimics或miRNA-95 inhibition 24 h后,将胰酶消化细胞以离心半径40 cm, 800 r/min离心5 min浓缩收集细胞,用培养基稀释细胞为104个/ml,每孔180 μl接种至96孔板中。置于培养箱中生长至细胞贴壁后,分别用0、2、4、6、8和10 Gy的60Co γ射线照射。照射后的细胞继续培养24 h,每孔中加入20 μl的CCK-8试剂,孵育2 h后,酶标仪测定各孔在450 nm处的吸光度(A)值。各组细胞增殖率=(放疗后各组A值-空白组各组A值)/(未放疗各组A值-空白组各组A值)×100%。
7.细胞单克隆实验:将各组0、4 Gy γ射线照射后的宫颈癌HeLa、SiHa细胞用培养基稀释后分别接种于胶原包被的6孔细胞培养平板中,每孔中再加入10 ml的细胞培养基继续培养14 d。弃上清,加入1 ml的多聚甲醛固定20 min, 用5%的结晶紫染色15 min, 拍照观察并计数各组细胞单克隆形成率(100%)=(细胞单克隆形成数/板中种植细胞数)×100%。
8.流式细胞术检测细胞凋亡:将0、4 Gy γ射线照射后的各组宫颈癌HeLa、SiHa细胞继续培养24 h后,用胰酶消化后收集细胞,PBS洗涤1次后重悬细胞,分别用FITC标记的Annexin-V和碘化丙啶(PI)各5 μl,在室温下孵育30 min,再用PBS洗涤1次,经BDCalibur流式细胞仪检测各组细胞凋亡率变化。
9.双荧光素酶活性实验检测miRNA-95的靶向基因:利用TargetScan软件对miRNA-95在宫颈癌中的靶向基因进行预测筛选,预测了其诱导抗辐射作用的下游靶向基因鞘氨醇-1-磷酸磷酸酶1(SGPP1)。根据文献[7]和KOD-PLUS-Mutagenesis-Kit的操作说明设计SGPP1/3′UTR的结合位点,将结合位点“5′-AACGUUGAAA”突变成“5′-AAGGCAACAAA”,相关引物设计和载体构建由上海生工生物公司合成。将转染miRNA-95 mimics和miRNA-95 inhibition 24 h后的宫颈癌HeLa、SiHa细胞收集,分别将野生型WT-SGPP1/ 3′UTR表达载体(野生型WT组)和突变型MUT-SGPP1/3′UTR表达载体(突变型MUT组)以500 ng/ml浓度各转染其中,以5×103个/ml接种于96孔板中,每孔200 μl,每组细胞设置3个重复,在含5%CO2的细胞培养箱中继续培养48 h。培养结束后各组细胞中加入荧光素酶缓冲试剂盒酶反应底物,充分作用后,测定各组细胞中相对荧光强度。
10.裸鼠照射实验:取5周龄的BALB/c裸鼠60只(北京实验动物研究中心),于裸鼠右下肢根部外侧皮肤下分别注射miRNA-95 mimics、miRNA-95 inhibition及miRNA-NC转染的HeLa细胞(为HeLa细胞组共3组,每组10只)和SiHa细胞(为SiHa细胞组共3组,每组10只)。每只裸鼠注射107个100 μl的宫颈癌细胞。在继续饲养两周,确认裸鼠植入瘤成功。在接受0 Gy/次的γ射线照射时,每组裸鼠随机取5只处死称瘤重量。后每组剩余5只裸鼠以局部4 Gy/次的γ射线照射,照射1次/4 d,共进行3次后处死裸鼠,取瘤称重。
11.统计学处理:所有数据采用SPSS 13.0软件分析。符合正态分布的数据采用x±s表示,两组间的数据比较采用独立样本t检验,而多组间的数据比较采用单因素方差分析(one-way ANOVA),P<0.05为差异有统计学意义。
结果1.miRNA-95在不同放射敏感性的宫颈癌组织和细胞中的表达情况:利用Real-time PCR检测发现,miRNA-95在不同放疗敏感性的宫颈癌患者肿瘤组织和细胞株中表达存在显著差异。放疗耐受组宫颈癌患者肿瘤组织中miRNA-95的表达量显著高于放疗敏感组,差异有统计学意义(t=12.279,P < 0.05);而对辐射抵抗的人宫颈癌HeLa和SiHa细胞株中miRNA-95的表达量也显著高于辐射敏感的Me180细胞(t=5.162、7.114,P < 0.05),见表 2。
|
|
表 2 miRNA-95在不同放疗敏感性的人宫颈癌组织和细胞株中的表达(x±s) Table 2 Expression of miRNA-95 in human cervical cancer tissues and cell lines with different radiosensitivity(x±s) |
2.miRNA-95 mimics和miRNA-95 inhibition转染宫颈癌细胞后表达情况:分别向具有辐射抵抗性的宫颈癌HeLa、SiHa细胞株中转染miRNA-95 mimics和miRNA-95 inhibition后,Real-time PCR检测发现,与miRNA-NC组相比,miRNA-95 mimics转染组HeLa、SiHa细胞中miRNA-95表达均显著上升(t=13.745、15.556,P < 0.05);而miRNA-95 inhibition转染组HeLa、SiHa细胞中miRNA-95表达均显著下降(t=9.284、8.036,P < 0.05),见表 3。
|
|
表 3 miRNA-95在miRNA-95 mimics和miRNA-95 inhibition转染细胞株中的表达(x±s) Table 3 The expression of miRNA-95 in cervical cancer cell lines transfected with miRNA-95 mimics and miRNA-95 inhibition(x±s) |
3.不同表达水平的miRNA-95对辐射后宫颈癌细胞增殖率的影响:CCK-8法检测发现,在不同剂量射线照射下,miRNA-95 inhibition组能够增强人宫颈癌HeLa、SiHa细胞的放射敏感性,而miRNA-95 mimics组则提高HeLa、SiHa细胞放射抵抗性,见表 4。经过统计发现,与miRNA-NC组相比,当照射剂量达到4、6、8和10 Gy后,miRNA-95 inhibition组HeLa、SiHa细胞增殖率均显著下降(t=8.273、11.354、13.489、15.396和6.197、9.185、10.994、12.442,P < 0.05);而miRNA-95 mimics组中HeLa、SiHa细胞增殖率显著升高,(t=5.573、7.737、8.265、10.023和4.028、6.224、7.275、9.411,P < 0.05)。
|
|
表 4 各组不同表达水平的miRNA-95对不同剂量照射后宫颈癌细胞增殖率的影响(%,x±s) Table 4 Effects of miRNA-95 on cell proliferation after radiation(%, x±s) |
4.不同表达水平的miRNA-95对照射后宫颈癌细胞单克隆形成的影响:细胞平板单克隆实验检测发现在4 Gy照射后,miRNA-95 inhibition组宫颈癌HeLa、SiHa细胞的单克隆群数显著降低,而miRNA-95 mimics组细胞单克隆群数显著增加,见图 1。经过统计发现,与miRNA-NC组相比,miRNA-95 inhibition组HeLa、SiHa细胞在4 Gy照射后单克隆形成率显著下降(t=8.378、7.931,P < 0.05);而miRNA-95 mimics组HeLa、SiHa细胞在4 Gy照射后单克隆形成率有上升趋势(t=5.255、4.379,P < 0.05),见表 5。
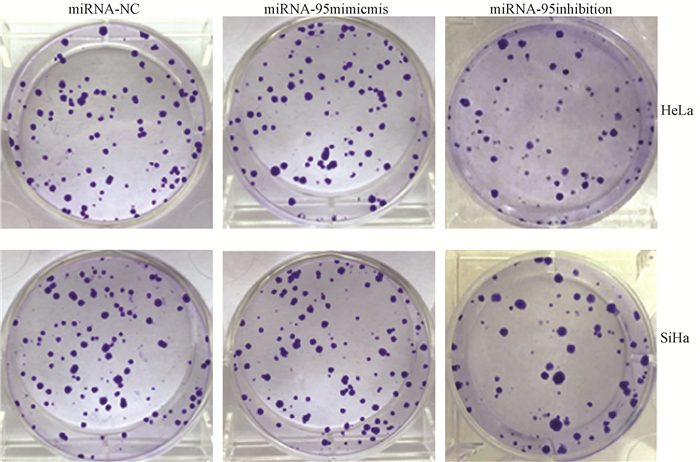
|
图 1 细胞平板单克隆实验检测各组宫颈癌细胞单克隆形成 Figure 1 Cell plate monoclonal assay was used to detect the formation of monoclonal in cervical cancer cells of each miRNA treatment group |
|
|
表 5 不同表达水平miRNA-95对宫颈癌细胞单克隆形成率和细胞凋亡率的影响(%,x±s) Table 5 Effect of miRNA-95 on the monoclonal formation rate and cell apoptosis rate of cervical cancer cells(%, x±s) |
5.不同表达水平的miRNA-95对辐射后宫颈癌细胞凋亡的影响:流式细胞术检测显示,在同样4 Gy照射后,与miRNA-NC组相比,miRNA-95 inhibition组HeLa、SiHa细胞凋亡率显著上升(t=10.265、8.386,P < 0.05);而miRNA-95 mimics组HeLa、SiHa细胞凋亡率显著下降(t=7.227、6.036,P < 0.05),见图 2。
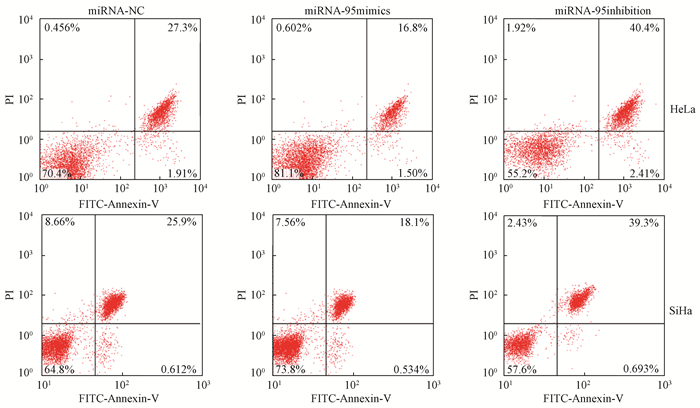
|
图 2 流式细胞术检测各组宫颈癌细胞凋亡 Figure 2 Apoptosis of cervical cancer cells was detected by flow cytometry |
6.miRNA-95在宫颈癌细胞中靶向SGPP1基因发挥作用:利用生物信息学方法,本组获得miRNA-95的潜在靶基因集合,并根据Targetscan、miRdb、miRanda筛选出与放射敏感性相关的SGPP1基因。在TargetScan软件中,获得miRNA-95和基因SGPP1的3′-UTR的结合位点,(SGPP1基因3′ UTR的1097-1 093位点CGUUGAA)。为进一步验证miRNA-95是否通过结合到人SGPP1基因的3′-UTR上特定的结合位点以调控SGPP1基因表达发挥作用,双荧光素酶活性实验检测发现SGPP1-3′-UTR野生型WT组中,与miRNA-NC组相比,miRNA-95 mimics组宫颈癌HeLa、SiHa细胞中荧光值显著降低(t=7.728、5.026,P < 0.05);而miRNA-95 inhibition组HeLa、SiHa细胞中荧光值明显上升(t=6.216、5.555,P < 0.05)。在SGPP1-3′-UTR突变型MUT组中,不同miRNA-95表达水平宫颈癌细胞HeLa、SiHa中荧光值无显著变化,证明宫颈癌细胞中miRNA-95通过靶向SGPP1基因发挥调控作用,见表 6。
|
|
表 6 不同表达水平的miRNA-95对照射后宫颈癌裸鼠成瘤重量的影响(g, x±s) Table 6 Double luciferase activity assay of the targeting effect of miRNA-95 on SGPP1 in cervical cancer cells(g, x±s) |
7.不同表达水平的miRNA-95对宫颈癌裸鼠照射后的影响:宫颈癌裸鼠成瘤的放疗实验检测发现,0 Gy照射时,各组裸鼠成宫颈癌肿瘤重量差异无统计学意义(P>0.05);4 Gy辐射后,HeLa和SiHa细胞中miRNA-NC组、miRNA-95 mimics组、miRNA-95 inhibition组裸鼠成瘤重量均显著降低(t=5.280、4.153、8.305和5.114、3.192、9.219,P < 0.05);同时在4 Gy照射后,与miRNA-NC组相比,HeLa和SiHa细胞中miRNA-95 mimics组裸鼠成瘤重量显著升高(t=7.266、5.315,P < 0.05),miRNA-95 inhibition组裸鼠成瘤重量显著降低(t=8.881、10.037,P < 0.05),见表 7。
|
|
表 7 照射后miRNA-95对宫颈癌裸鼠荷瘤重量的变化(g, x±s) Table 7 Effect of miRNA-95 on the weight of cervical tumor in nude mice post-irradiation(g, x±s) |
讨论
宫颈癌的致病因素较多,据流行病学研究发现HPV感染,初产年龄过小,多孕多产,疱疹病毒,吸烟等病理生理因素都可能增加宫颈癌的患病风险,而且在近年中,宫颈癌发病有渐年轻化趋势[8]。宫颈癌患者除采用手术治疗外,放射治疗也是重要的手段,如在不能或不愿意进行手术的宫颈癌患者中可以采用根治性放疗,但约有30%的患者因为放疗抵抗性而复发,因此,宫颈癌放疗敏感性的判断及如何有效提高宫颈癌患者放疗敏感性是当前临床急需解决的难点[9]。越来越多的研究发现,miRNA与肿瘤放疗敏感性相关,Weidhaas等[10]及Pelletier和Weidhaas[11]研究利用miRNA芯片筛选放疗前后的miRNA表达谱变化,发现let-7、miRNA-34等均与肿瘤放射敏感性相关。Du等[12]对102位宫颈癌患者进行标准化放疗后,RT-PCR检测发现miRNA-9、miRNA-221、miRNA-218等均与宫颈癌放疗敏感性显著相关。有研究发现,miRNA-95能够影响乳腺癌、前列腺癌放射抵抗性,并在C33 A、HeLa宫颈癌细胞系中高表达,但关于其是否影响宫颈癌的放疗敏感性及其作用机制尚未见研究[13]。本研究收集了20例放疗敏感的宫颈癌患者和20例放疗抵抗的宫颈癌患者,利用Real-time PCR检测发现miRNA-95在不同放疗敏感性患者肿瘤组织中呈表达差异,并在放疗敏感性患者肿瘤组织中表达水平较低;同时在放疗敏感的宫颈癌Me180细胞系中表达水平也显著低于放疗抵抗的HeLa、SiHa细胞,再次说明miRNA-95能够影响宫颈癌的放疗敏感性,也提示可通过检测宫颈癌患者的miRNA-95表达水平来预测其接收放疗效果。
为了进一步验证miRNA-95对宫颈癌放疗敏感性发挥的调控作用,本课题构建了miRNA-95 mimics(上调表达)和miRNA-95 inhibition(下调表达)转染有放射抵抗性的人宫颈癌HeLa和SiHa细胞。本研究发现在放射治疗的剂量逐渐增加下,miRNA-95低表达组宫颈癌细胞的增值率下降更为显著,而miRNA-95高表达组则表现出明显的抵抗性,证明了miRNA-95低表达能够提高宫颈癌细胞放射敏感性。有研究表明,不同个体的宫颈癌等肿瘤患者对放射的抵抗性不同是因为其不同个体的肿瘤细胞在放疗中的克隆能力和凋亡水平有差异[14-15]。本研究单克隆实验也发现在4 Gy照射下,miRNA-95低表达的HeLa和SiHa细胞单克隆形成能力显著下降而凋亡水平显著上升,提示可通过抑制miRNA-95表达水平来提高宫颈癌患者的放射敏感性,进而提高放疗疗效。
相关研究已揭示,miRNA是通过直接靶向调控功能不同的基因而发挥各种生物学包括影响放射敏感性的功能,因此对miRNA靶基因的预测及验证是研究其分子作用机制和生物学功能的必要手段[16]。目前Targetsca、DIANA-microT、miRanda等[17-18]生物信息学软件均可以较准确的预测microRNA的靶基因,它们主要根据miRNA序列的5′端的第2~8个碱基核苷酸序列来靶向mRNA基因序列的3′-非翻译区(3′-UTR)。而目前关于miRNA-95在宫颈癌中的发挥生物学功能的靶向基因尚未见研究, 因此本课题采用荧光素酶双报告基因系统验证了miRNA-95在宫颈癌细胞中可以与靶基因SGPP1结合而发挥调控作用。Huang等[19]和Gao等[20]研究已发现SGPP1可作为胶质瘤细胞中miRNA-95的直接靶基因位点,诱导肿瘤细胞的抗辐射性发生,与本研究结果一致。但是关于靶基因SGPP1在受miRNA95调控后如何具体影响宫颈癌细胞的生物功能尚需要进一步进行研究。同时为了在体内水平验证miRNA-95抑制表达对宫颈癌放疗具有疗效,本课题将不同表达水平miRNA-95的宫颈癌HeLa、SiHa细胞分别植入到裸鼠体内,使瘤体接受4 Gy剂量的照射,结果发现,miRNA-95 inhibition组HeLa、SiHa细胞裸鼠成瘤照射后肿瘤重量下降更为明显,再次说明抑制miRNA-95表达,可提高宫颈癌肿瘤的放疗敏感性,提示miRNA-95可作为新的治疗靶点应用于宫颈癌放射治疗。
综上所述,miRNA-95在放疗敏感性的宫颈癌组织和细胞中呈低表达,而抑制miRNA-95表达水平能够显著提高宫颈癌细胞的放射敏感性,将为宫颈癌患者临床放疗敏感性预测和提高放疗疗效提供新的思路和方法。
利益冲突 无作者贡献声明 施凤涟负责实验规划和论文撰写;卫英负责临床标本的采集和检测;刘俊玲负责完成细胞、动物实验和数据统计分析
| [1] |
Lin Z, Bazzaro M, Wang MC, et al. Combination of proteasome and HDAC inhibitors for uterine cervical cancer treatment[J]. Clin Cancer Res, 2009, 15(2): 570-577. DOI:10.1158/1078-0432.CCR-08-1813 |
| [2] |
Liu SS, Leung RC, Chan KY, et al. p73 expression is associated with the cellular radiosensitivity in cervical cancer after radiotherapy[J]. Clin Cancer Res, 2004, 10(10): 3309-3316. DOI:10.1158/1078-0432.CCR-03-0119 |
| [3] |
Liu GF, Zhang SH, Li XF, et al. Overexpression of microRNA-132 enhances the radiosensitivity of cervical cancer cells by down-regulating Bmi-1[J]. Oncotarget, 2017, 8(46): 80757-80769. DOI:10.18632/oncotarget.20358 |
| [4] |
Huang Z, Huang S, Wang Q, et al. MicroRNA-95 promotes cell proliferation and targets sorting Nexin 1 in human colorectal carcinoma.[J]. Cancer Res, 2011, 71(7): 2582-2589. DOI:10.1158/0008-5472.CAN-10-3032 |
| [5] |
Li B, Xie S, Cai C, et al. MicroRNA-95 promotes myogenic differentiation by down-regulation of aminoacyl-tRNA synthase complex-interacting multifunctional protein 2[J]. Oncotarget, 2017, 8(67): 111356-111368. DOI:10.18632/oncotarget.22796 |
| [6] |
徐杨, 赵丽君, 王春. miR-145过表达对宫颈癌细胞辐射敏感性的影响[J]. 中国病理生理杂志, 2018, 34(4): 630-636. Xu Y, Zhao LY, Wang C. Effect of miR-145 over-expression on radiosensitivity of cervical cancer cells[J]. Chin J Pathophysiol, 2018, 34(4): 630-636. DOI:10.3969/j.issn.1000-4718.2018.04.009 |
| [7] |
Bao Y, Chen Z, Guo Y, et al. Tumor suppressor microRNA-27a in colorectal carcinogenesis and progression by targeting SGPP1 and Smad2[J]. PLoS One, 2014, 9(8): e105991. DOI:10.1371/journal.pone.0105991 |
| [8] |
Banáth JP, Macphail SH, Olive PL. Radiation sensitivity, H2AX phosphorylation, and kinetics of repair of DNA strand breaks in irradiated cervical cancer cell lines[J]. Cancer Res, 2004, 64(19): 7144-7149. DOI:10.1158/0008-5472.CAN-04-1433 |
| [9] |
An Z, Liu X, Song H, et al. Effect of troglitazone on radiation sensitivity in cervix cancer cells[J]. Radiat Oncol J, 2012, 30(2): 78-87. DOI:10.3857/roj.2012.30.2.78 |
| [10] |
Weidhaas JB, Eisenmann DM, Holub JM, et al. A conserved RAS/mitogen-activated protein kinase pathway regulates DNA damage-induced cell death postirradiation in Radelegans[J]. Cancer Res, 2006, 66(21): 10434-10438. DOI:10.1158/0008-5472.CAN-06-2182 |
| [11] |
Pelletier C, Weidhaas JB. MicroRNA binding site polymorphisms as biomarkers of cancer risk[J]. Expert Rev Mol Diagn, 2010, 10(6): 817-829. DOI:10.1586/erm.10.59 |
| [12] |
Du J, Wang L, Li C, et al. MicroRNA-221 targets PTEN to reduce the sensitivity of cervical cancer cells to gefitinib through the PI3K/Akt signaling pathway[J]. Tumour Biol, 2016, 37(3): 3939-3947. DOI:10.1007/s13277-015-4247-8 |
| [13] |
Cheng AM, Byrom MW, Shelton J, et al. Antisense inhibition of human miRNAs and indications for an involvement of miRNA in cell growth and apoptosis[J]. Nucleic Acids Res, 2005, 33(4): 1290-1297. DOI:10.1093/nar/gki200 |
| [14] |
Zhao S, Yao D, Chen J, et al. Circulating miRNA-20a and miRNA-203 for screening lymph node metastasis in early stage cervical cancer[J]. Genet Test Mol Biomarkers, 2013, 17(8): 631-636. DOI:10.1089/gtmb.2013.0085 |
| [15] |
Xiao Z, Ching CS, Han LC, et al. Role of microRNA-95 in the anticancer activity of Brucein D in hepatocellular carcinoma[J]. Eur J Pharmacol, 2014, 728: 141-150. DOI:10.1016/j.ejphar.2014.02.002 |
| [16] |
Li B, Xie S, Cai C, et al. MicroRNA-95 promotes myogenic differentiation by down-regulation of aminoacyl-tRNA synthase complex-interacting multifunctional protein 2[J]. Oncotarget, 2017, 8(67): 111356-111368. DOI:10.18632/oncotarget.22796 |
| [17] |
Chen W, Zhao W, Yang A, et al. Integrated analysis of microRNA and gene expression profiles reveals a functional regulatory module associated with liver fibrosis[J]. Gene, 2017, 636(12): 87-95. DOI:10.1016/j.gene.2017.09.027 |
| [18] |
Xia W, Cao G, Shao N. Progress in miRNA target prediction and identification[J]. Sci China C Life Sci, 2009, 52(12): 1123-1130. DOI:10.1007/s11427-009-0159-4 |
| [19] |
Huang X, Taeb S, Jahangiri S, et al. miRNA-95 mediates radioresistance in tumors by targeting the sphingolipid phosphatase SGPP1[J]. Cancer Res, 2013, 73(23): 6972-6986. DOI:10.1158/0008-5472.CAN-13-1657 |
| [20] |
Gao XY, Li L, Wang XH, et al. Inhibition of sphingosine-1-phosphate phosphatase 1 promotes cancer cells migration in gastric cancer:clinical implications[J]. Oncol Rep, 2015, 34(4): 1977-1987. DOI:10.3892/or.2015.4162 |
 2018, Vol. 38
2018, Vol. 38


