恶性胶质瘤被世界卫生组织(WHO)归类于Ⅲ级或Ⅳ级中枢神经系统肿瘤,具有高度侵袭性,手术难以完全切除,患者的平均生存期仅为9.5个月[1]。放射治疗是胶质瘤临床治疗的主要手段之一,但是由于胶质瘤具有一定的辐射抗性,临床疗效不佳,行放射治疗后容易复发,如何提高胶质瘤细胞的放射敏感性是提高疗效的关键[2-4]。近年来,有关纳米材料和纳米技术在肿瘤放疗中的研究日益增多,与传统放射增敏治疗方法相比,纳米材料和纳米技术具有更好的靶向性,可以在提高肿瘤放射敏感性的同时降低细胞毒性[5-6],本实验以人脑胶质瘤U251细胞为模型,观察修饰有核定位序列(nuclear localization sequence,NLS)的二氧化钛(titanium dioxide,TiO2)纳米颗粒在U251细胞中的分布,并进一步研究修饰的纳米颗粒对U251细胞放射敏感性的影响及其可能的作用机制,从而揭示该种纳米颗粒在胶质瘤放疗增敏领域的潜在应用价值。
材料与方法1.材料与仪器:TiO2纳米颗粒购自上海麦克林生化科技有限公司,NLS(氨基酸序列:CGGGPKKKRKVED,相对分子质量为1.401 7×103)由南京金斯瑞生物科技公司合成,牛血清蛋白(BSA)购自上海生工生物工程股份有限公司,FITC荧光染料购买于美国赛默飞世尔科技有限公司,胶质瘤U251细胞购自中国科学院上海细胞库,DMEM培养基购自美国Hyclone公司,γ-H2AX抗体购自美国Abcam公司,细胞凋亡及活性氧检测试剂盒购自上海碧云天公司。生物学X射线辐照仪购自美国Rad-source公司,型号为RS-2000 Pro,靶源距为45 cm,剂量率为1 Gy/min,照射剂量8 Gy。
2.TiO2-NLS纳米颗粒的合成及表征:准确称取10 mg BSA溶于5 ml磷酸盐缓冲液(PBS)中,充分溶解,再将5 mg TiO2纳米颗粒加入到该溶液中,超声处理10 min,5 000 r/min,离心半径10 cm,离心15 min弃掉上清液,用5 ml PBS重悬沉淀,再次5 000 r/min,离心半径10 cm,离心15 min,弃上清经真空冷冻干燥获得TiO2-BSA纳米颗粒粉末。5 mg TiO2-BSA纳米颗粒溶解于10 ml PBS中,超声处理15 min后加入5 mg NLS,用乙酸溶液将pH值调整到6.0,将混合溶液加入到透析袋中(截留相对分子质量为2.5×104),4℃透析48 h,去除多余的NLS、BSA和乙酸。最后真空冷冻干燥获得TiO2-NLS纳米颗粒。利用透射电镜(TEM)和动态光散射(dynamic light scattering,DLS)检测纳米颗粒的形态及在水溶液中的分布。
3.流式细胞仪检测细胞活性氧(ROS)的产生:取对数生长期的U251细胞制备成单细胞悬液,放入6孔板(2×106/孔)培养24 h,设置以下6组:空白对照组、TiO2-BSA处理组、TiO2-NLS处理组、单纯照射组、TiO2-BSA联合照射组、TiO2-NLS联合照射组。两种纳米颗粒的处理浓度均以TiO2为标准,均为150 μg/ml,X射线照射前预处理12 h。8 Gy X射线照射2 h后分别向各组中加入ROS检测试剂,放置于37℃培养箱中培养15 min,随后将细胞制成单细胞悬液,PBS洗涤2次,通过流式细胞仪检测细胞内ROS的产生量。
4.荧光标记的纳米颗粒在U251细胞内的分布:称取2 mgTiO2-BSA纳米颗粒溶解于pH=8.0的PBS中,超生处理15 min使其完全溶解,向溶液中加入含异硫氰酸荧光素(FITC)浓度为10 mg/ml的二甲基亚砜(DMSO)溶液10 μl,随后将混合溶液加入到透析袋中4℃透析72 h以除去多余成分,真空冷冻干燥获得FITC-TiO2-BSA纳米颗粒。FITC-TiO2-NLS纳米颗粒的制备同上,将含有FITC荧光染料修饰的TiO2-BSA和TiO2-NLS纳米颗粒处理U251细胞12 h,随后用无血清培养基清洗3次,去除未被细胞吸收的纳米颗粒,激光共聚焦显微镜观察FITC荧光标记的纳米颗粒在细胞中的分布。再收获细胞,PBS洗涤2次,通过流式细胞仪检测细胞内的FITC荧光强度,反映细胞内纳米颗粒的含量。
5.纳米颗粒对U251细胞凋亡率的影响:细胞分组设置同ROS检测,X射线处理后继续培养48 h,胰酶消化并制备单细胞悬液,调整细胞浓度为1×106/ml。取100 μl的细胞悬液,分别加入Annexin V-FITC和碘化丙啶,37℃恒温水浴锅中避光孵育15 min,通过流式细胞仪检测细胞凋亡情况。
6.DNA损伤修复实验:细胞分组设置同上,X射线处理后继续培养12 h,加入4%多聚甲醛固定细胞15 min,PBS洗涤3次后加入0.2%Triton X-100孵育5 min,再次洗涤后加入5% BSA封闭1 h,加入γ-H2AX抗体4℃孵育过夜。第2天用PBS洗涤3次后加入荧光二抗孵育1 h,再用4′, 6二脒基2-苯基吲哚(DAPI)染细胞核后在激光共聚焦显微镜下观察γ-H2AX焦点。
7.克隆存活实验:对数生长期的U251细胞经胰酶消化后,根据照射剂量的不同,分别将不同个数的细胞加入到6孔板中,过夜贴壁后加入150 μg/ml的TiO2-BSA或TiO2-NLS纳米颗粒,培养12 h后进行不同剂量的X射线处理,放入培养箱继续培养2周。甲醛固定后采用结晶紫染色,在显微镜下计数克隆数,以0 Gy处理组数据计算克隆形成率(PE,%)=克隆数/接种细胞数×100%,每组的存活分数(SF)=克隆数/接种细胞数×PE。
8.统计学处理:采用SPSS 13.0软件进行统计学分析,两组间比较经正态性检验符合正态分布后采用独立样本t检验。P<0.05为差异有统计学意义。
结果1.纳米颗粒的表征和在U251细胞内的分布:无BSA包裹的TiO2纳米颗粒在PBS中的平均粒径约为1 000 nm,分散性差,见图 1A,经过BSA包裹后的TiO2纳米颗粒在水溶液中分散性良好,TiO2-BSA和TiO2-NLS纳米颗粒的平均粒径均 < 50 nm。因NLS中含有带正电荷的精氨酸与赖氨酸,所以TiO2-NLS纳米颗粒的zeta电位比TiO2-BSA高,分别为(+5.32±1.85)和(-2.85±1.50)mV,未修饰的TiO2为(-25.24±2.30)mV。用FITC荧光染料标记的纳米颗粒处理U251细胞后,观察在其在细胞内的分布,结果显示TiO2-BSA纳米颗粒主要集中于细胞质中,TiO2-NLS纳米颗粒则主要分布在细胞核中(图 1B)。

|
图 1 TiO2-BSA及TiO2-NLS纳米颗粒的表征和细胞内的分布 A.纳米颗粒透射电镜照片;B.激光共聚焦显微镜观察纳米颗粒在细胞内的分布 Figure 1 Characterization of TiO2-BSA and TiO2-NLS nanoparticles and their intracellular distribution A.TEM images of nanoparticles; B.Representative images of the nanoparticles in U251 cells |
2.TiO2纳米颗粒促进电离辐射引起的ROS产生:U251细胞预处理TiO2-BSA或TiO2-NLS纳米颗粒后,细胞内ROS水平有所增加,但差异无统计学意义(P>0.05)。8 Gy X射线处理细胞2 h后,ROS水平的差异也没有统计学意义,见图 2A。TiO2-BSA或TiO2-NLS纳米颗粒联合照射组的ROS水平显著升高,与单纯照射组相比,差异有统计学意义(TiO2-BSA:t=10.18,P<0.05;TiO2-NLS:t=14.19,P<0.05)。进一步检测发现U251细胞内TiO2-NLS纳米颗粒比TiO2-BSA的总含量有所升高,但差异无统计学意义(P>0.05,图 2B),ROS水平经过纳米颗粒细胞内含量的标准化后差异也无统计学意义(P>0.05,图 2C),提示NLS修饰的TiO2纳米颗粒促进电离辐射诱导的ROS能力没有发生改变。
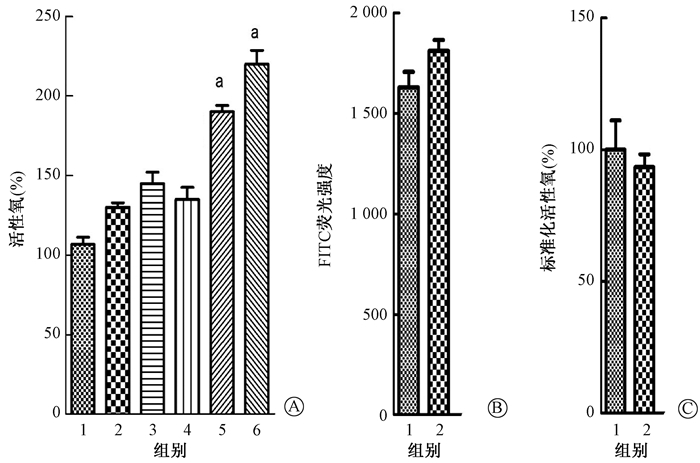
|
图 2 TiO2纳米颗粒联合X射线处理后U251细胞内活性氧的产生 A.流式细胞仪检测不同处理组活性氧的水平;B.细胞对TiO2纳米颗粒的摄取量;C.经细胞内含量标准化的活性氧水平 注:1.空白对照组;2.TiO2-BSA处理组;3.TiO2-NLS处理组;4.单纯照射组;5.TiO2-BSA联合照射组;6.TiO2-NLS联合处理组。a与单纯照射组比较,t=10.18、14.19,P<0.05 Figure 2 ROS production in U251 cells treated with TiO2 nanoparticles and X-ray radiation A. ROS production was analyzed by flow cytometer; B. The cellular uptake of TiO2-BSA and TiO2-NLS; C. ROS production normalized by intracellular amounts |
3.TiO2-NLS纳米颗粒增强U251细胞的放射敏感性:TiO2-NLS纳米颗粒进入细胞核后联合电离辐射处理产生的ROS可聚集在细胞核中,能促进电离辐射诱导的DNA损伤,X射线照射后12 h,TiO2-NLS处理组仍具有明显的γ-H2AX焦点(图 3A)。进一步的实验表明,TiO2-NLS联合照射后细胞的凋亡率明显提高,与X射线照射组相比,差异有统计学意义(t=9.35,P<0.05),与TiO2-BSA联合照射组比较,差异也有统计学意义(t=8.96,P<0.05),见图 3B。细胞克隆实验发现,TiO2-BSA处理组的放射增敏比为1.18,TiO2-NLS处理组的放射增敏比为1.29,两组比较,差异有统计学意义(t=14.92,P<0.05),结果表明具有细胞核靶向性的TiO2纳米颗粒对U251细胞具有放射增敏作用(图 3C,表 1)。
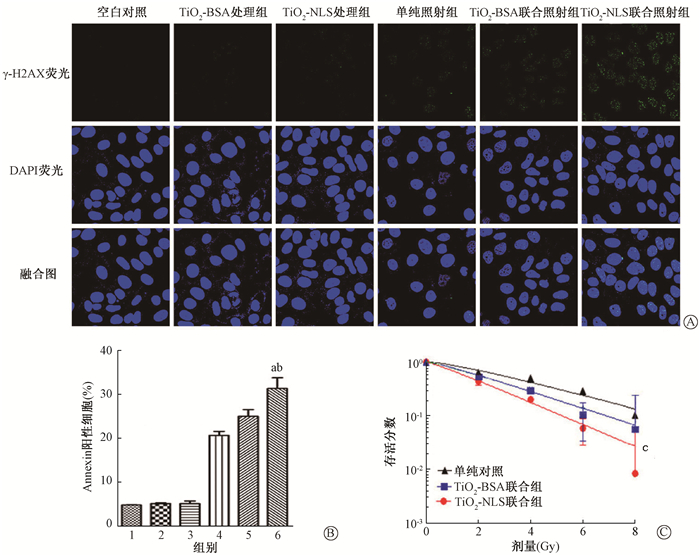
|
图 3 TiO2纳米颗粒对U251细胞放射敏感性的影响 A. U251细胞γ-H2AX焦点染色照片;B.流式细胞仪检测细胞凋亡率;C. U251细胞克隆存活拟合曲线及数据 注:1.空白对照组;2.TiO2-BSA处理组;3.TiO2-NLS处理组;4.单纯照射组;5.TiO2-BSA联合照射组;6.TiO2-NLS联合处理组。a与单纯照射组比较,t=9.35,P<0.05;b与TiO2-BSA联合照射组比较,t=8.96,P<0.05;c与TiO2-BSA联合照射组比较,t=14.72,P<0.05 Figure 3 Radiosensitization effect of TiO2-NLS on U251 cells A. Images of γ-H2AX foci staining of U251 cells; B. Cell apoptosis was quantified by flow cytometer; C. Clonogenic survival curves |
|
|
表 1 各组U215细胞存活曲线参数 Table 1 The main stimulation parameters of the survival curves of irradiated U215 cells |
讨论
X射线杀伤肿瘤细胞的主要途径之一是通过诱导产生ROS使生物大分子失活,特别是损伤细胞核内的DNA分子[7]。TiO2作为一种金属氧化物,具有吸收辐射能量并在水介质中生成ROS的能力[8],纳米尺寸的TiO2材料进入细胞后可联合电离辐射在细胞内产生大量的ROS,从而对肿瘤细胞造成杀伤作用,如TiO2纳米管可以在体内外增强SNB-19和U87MG胶质瘤细胞的放射敏感性[9]。此外通过对TiO2纳米颗粒的修饰和加工也可用于肿瘤放射增敏,如在TiO2纳米颗粒中加入高原子序数的稀土元素,可以促进TiO2纳米颗粒对X射线能量的吸收,进一步增加ROS的产量,可对肺癌细胞产生放射增敏作用[10]。
虽然TiO2纳米颗粒联合电离辐射促进了细胞内ROS的产生,但是由于纳米颗粒的粒径大于细胞核膜上的核孔复合体直径,TiO2纳米颗粒会被阻挡在细胞核外,难以进入细胞核内[11],其诱导产生的ROS可能只局限于细胞质中,不能对细胞核中的DNA造成损伤,限制了TiO2纳米颗粒的放射增敏效应。本实验结果也显示出没有核靶向的TiO2纳米颗粒没有明显的放射增敏作用。
为了克服这一局限性,本研究设计用NLS修饰TiO2纳米颗粒,NLS可通过与入核载体相互作用介导大分子蛋白进入细胞核内[12],研究数据表明粒径在40至50 nm的纳米颗粒在NLS修饰后可进入细胞核内[13-14]。本研究首先采用BSA包裹TiO2纳米颗粒以提高其在缓冲液中的分散性,动态光散射检测粒径均值为50 nm左右,符合NLS介导入核的粒径要求。实验数据表明NLS修饰的TiO2纳米颗粒处理U251细胞后,可通过核膜在细胞核内聚集,而未被修饰的TiO2纳米颗粒主要分布在细胞质中,但进入细胞内的TiO2纳米颗粒总量并没有因为NLS修饰而发生变化。
通过对细胞内ROS水平的定量分析发现TiO2纳米颗粒可联合X射线在U251细胞中诱导产生更高的ROS水平,由于细胞内TiO2纳米颗粒总量大致相同,所以细胞内总ROS水平在TiO2-BSA和TiO2-NLS纳米颗粒处理组中差异无统计学意义,但TiO2-NLS纳米颗粒联合X射线处理后的细胞凋亡率比TiO2-BSA纳米颗粒联合处理组更高,推测是由于细胞核内的ROS更接近DNA,可造成更多的DNA损伤。
γ-H2AX焦点染色观察是检测DNA损伤的敏感指标[15]。X射线处理12 h后,在TiO2-BSA纳米颗粒联合X射线处理组中,出现了少量的γ-H2AX焦点,提示大部分的DNA损伤在12 h以内已经被细胞修复,而在TiO2-NLS纳米颗粒联合X射线处理组中,出现较大数量的γ-H2AX焦点,提示DNA损伤没有被完全修复,这可能是TiO2-NLS纳米颗粒诱导产生的ROS集中在细胞核内,增加了DNA损伤并延缓了DNA的损伤修复。通过流式细胞仪分析发现TiO2-NLS纳米颗粒预处理显著促进了电离辐射诱导的U251细胞凋亡,这与其增加DNA损伤的结果相一致。细胞克隆实验进一步显示了TiO2-NLS纳米颗粒在体外对U251细胞具有放射增敏作用,而TiO2-BSA纳米颗粒不能提高细胞的放射敏感性。
综上所述,本研究合成了具有细胞核靶向性的TiO2-NLS纳米颗粒,数据显示该种纳米颗粒可增强X射线对胶质瘤U251细胞DNA的损伤,这可能与TiO2-NLS纳米颗粒在细胞核内产生过量的ROS有关,进一步实验显示了TiO2-NLS纳米颗粒增强了电离辐射对U251细胞的凋亡诱导效应,并提高了U251细胞的放射敏感性。下一步实验需要提高TiO2纳米颗粒的肿瘤靶向性,并在体内实验中检测TiO2-NLS纳米颗粒对胶质瘤细胞的放射增敏作用。
利益冲突 无作者贡献声明 商军、解婷、殷娜瑞和俞家华负责实验设计、操作和论文撰写;陈飞、杜杰和张昊文协助实验数据收集和统计分析;刘芬菊总体指导实验进行和修改论文
| [1] |
Scoccianti S, Magrini SM, Ricardi U, et al. Radiotherapy and temozolomide in anaplastic astrocytoma:a retrospective multicenter study by the Central Nervous System Study Group of AIRO (Italian Association of Radiation Oncology)[J]. Neuro Oncol, 2012, 14(6): 798-807. DOI:10.1093/neuonc/nos081 |
| [2] |
Stupp R, Dietrich PY, Ostermann KS, et al. Promising survival for patients with newly diagnosed glioblastoma multiforme treated with concomitant radiation plus temozolomide followed by adjuvant temozolomide[J]. J Clin Oncol, 2002, 20(5): 1375-1382. DOI:10.1200/JCO.2002.20.5.1375 |
| [3] |
Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90. DOI:10.3322/caac.20107 |
| [4] |
Tak JK, Lee JH, Park JW. Resveratrol and piperine enhance radiosensitivity of tumor cells[J]. BMB Rep, 2012, 45(4): 242-246. DOI:10.5483/BMBRep.2012.45.4.242 |
| [5] |
Werner ME, Copp JA, Karve S, et al. Folate-targeted polymeric nanoparticle formulation of docetaxel is an effective molecularly targeted radiosensitizer with efficacy dependent on the timing of radiotherapy[J]. ACS Nano, 2011, 5(11): 8990-8998. DOI:10.1021/nn203165z |
| [6] |
Mallick S, Sun IC, Kim K, et al. Silica coated gold nanorods for imaging and photo-thermal therapy of cancer cells[J]. J Nanosci Nanotechnol, 2013, 13(5): 3223-3229. DOI:10.1166/jnn.2013.7149 |
| [7] |
Azzam EI, Jay-Gerin JP, Pain D. Ionizing radiation-induced metabolic oxidative stress and prolonged cell injury[J]. Cancer Lett, 2012, 327(1-2): 48-60. DOI:10.1016/j.canlet.2011.12.012 |
| [8] |
Gupta SM, Tripathi M. A review of TiO2 nanoparticles[J]. Chin Sci Bull, 2011, 56(16): 1639-1657. DOI:10.1007/s11434-011-4476-1 |
| [9] |
Mirjolet C, Papa AL, Créhange G, et al. The radiosensitization effect of titanate nanotubes as a new tool in radiation therapy for glioblastoma:a proof-of-concept[J]. Radiother Oncol, 2013, 108(1): 136-142. DOI:10.1016/j.radonc.2013.04.004 |
| [10] |
Townley HE, Kim J, Dobson PJ. In vivo demonstration of enhanced radiotherapy using rare earth doped titania nanoparticles[J]. Nanoscale, 2012, 4(16): 5043-5050. DOI:10.1039/c2nr30769c |
| [11] |
Tammam SN, HME A, Lamprecht A. How successful is nuclear targeting by nanocarriers?[J]. J Control Release, 2016, 229: 140-153. DOI:10.1016/j.jconrel.2016.03.022 |
| [12] |
Pouton CW, Wagstaff KM, Roth DM, et al. Targeted delivery to the nucleus[J]. Adv Drug Deliv Rev, 2007, 59(8): 698-717. DOI:10.1016/j.addr.2007.06.010 |
| [13] |
Panté N, Kann M. Nuclear pore complex is able to transport macromolecules with diameters of about 39 nm[J]. Mol Biol Cell, 2002, 13(2): 425-434. DOI:10.1091/mbc.01-06-0308 |
| [14] |
Xu C, Xie J, Kohler N, et al. Monodisperse magnetite nanoparticles coupled with nuclear localization signal peptide for cell-nucleus targeting[J]. Chem Asian J, 2008, 3(3): 548-552. DOI:10.1002/asia.200700301 |
| [15] |
Redon CE, Nakamura AJ, Gouliaeva K, et al. Q(γ-H2AX), an analysis method for partial-body radiation exposure using γ-H2AX in nonhuman primate lymphocytes[J]. Radiat Meas, 2011, 46(9): 877-881. DOI:10.1016/j.radmeas.2011.02.017 |
 2018, Vol. 38
2018, Vol. 38


