2. 030000 太原, 山西大医院放疗科
2. Department of Radiation Oncology, Shanxi Dayi Hospital, Taiyuan 030000, China
近年来,结肠癌的发病率和死亡率呈现上升的趋势[1-2]。越来越多的研究证实,长链非编码RNA(long chain non-coding RNA, lncRNA)参与组织的癌变、转移、细胞的增殖等过程,不同肿瘤组织中具有不同的转录因子,在肿瘤的发生、发展中扮演重要的调控角色[3-5]。长链非编码RNA生长特异抑制物5(lncRNA of growth arrest-specific 5, lncRNA GAS5)最初发现于肿瘤抑制基因cDNA消减文库,可作为肿瘤潜在的抑制基因。lncRNA GAS5在胚胎和机体成熟组织中广泛表达,但在结肠癌中的作用以及分子机制尚不十分清楚。本研究通过检测lncRNA GAS5在结肠癌细胞中的表达量以及调控结肠癌细胞放射敏感性,研究lncRNA GAS5在结肠癌中的生物学作用以及相关作用机制,为降低结肠癌细胞辐射抵抗、改善临床结肠癌放疗效果提供可靠的理论基础。
材料与方法1.实验试剂及仪器:结肠癌SW480、SW620、LOVO、HT-29细胞购自中国科学院上海细胞生物研究所,DMEM培养基、DMEM/F12培养基、胎牛血清、反转录试剂盒购自美国Thermo公司;胰蛋白酶、青霉素、链霉素、磷酸盐缓冲液(PBS)购自上海碧云天生物技术研究所;姬姆萨染色液、甲醇购自美国Sigma公司;Lipofectamine 2000、TRIzol试剂购自北京天根生化科技有限公司;膜联蛋白V-FITC(Annexin V-FITC)细胞凋亡试剂盒购自南京凯基生物公司;碘化丙啶(PI)购自上海生工生物有限公司;双荧光素酶报告基因由上海翰宇生物科技有限公司合成;pRL-TK海肾萤光素酶报告基因载体购自美国Promega公司;pcDNA-GAS5、siRNA-GAS5、miR-223 mimics、anti-miR-223购自上海吉玛生物有限公司。细胞培养箱购自美国Thermo公司,流式细胞仪购自美国Beckman公司,7500荧光定量PCR仪(Applied Biosystems)购自美国ABI公司
2.细胞的培养:SW480、SW620、LOVO细胞培养于DMEM培养基中,HT-29培养于DMEM/F12培养基中,均加入10%胎牛血清和1%的青-链霉素,培养条件为37℃、5% CO2,显微镜下观察到细胞浓度达到80%左右,加入0.25%胰酶消化,采用完全培养基终止消化,1 000 r/min,离心半径10 cm, 离心2 min,弃去上清液,按照1 :3或1 :4的比例进行传代。
3.荧光定量PCR(qPCR):收集5×105结肠癌细胞,PBS冲洗3次,加入1 ml TRIzol冰上裂解5 min,提取细胞中总RNA,超纯水溶解RNA,-80℃保存。吸取2 μg总RNA,加入12 μl超纯水,70℃孵育5 min,冷却后置于冰上,加入1 μl(200 μ/μl)反转录酶,42℃孵育60 min,70℃加热10 min,保存于-20℃。基因引物由上海生工生物有限公司合成,lncRNA GAS5引物上游序列为5′ AAGCCATT GGCACACAGGCATTAG 3′,下游序列为5′ AGAACCATTAAGCTGGTCCAGGCA 3′;miR-223上游序列为5′ GGGGGTGTCAGTTTGTCAAAT 3′,下游序列为5′ CAGTGCAG GGTCCGAGGTAT 3′;GAPDH引物上游序列为5′ ACCAGCCCCAGCAAGAGCACAAG 3′,下游序列为5′ TTTGCTTGAAGTTTCACTGGCATC 3′。反应条件为95℃ 2 min,95℃ 30 s,55℃ 30 s,72℃ 1 min,72℃ 5 min,35个循环。实验重复3次,2-ΔΔCt法计算基因的相对表达量。
4.细胞的转染:结肠癌细胞常规培养于DMEM培养基中,细胞融合度达到50%~80%将pcDNA-GAS5、siRNA-GAS5、miR-223 mimics、anti-miR-223以及相应的阴性对照转染入细胞。将培养基更换为Opti-MEM,加入250 μl Opti-MEM分别稀释RNA序列和Lipofectamine 2000,室温孵育5 min后,将二者充分混合,室温下孵育20 min,形成转染复合物;吸取生长培养基,每孔细胞中加入上述转染复合物,十字形轻轻晃动混匀,37℃培养6 h,弃去转染液,更换为完全培养基继续培养。各转染片段序列如下所示:siRNA-GAS5: 5′ AGCTGGAAGTTGAAATGG 3′,5′ GTTCGGCTGAGAGGTATGG 3′;miR-223:5′ UGUCAGUUUGUCAAAUACCCCA 3′;anti-miR-223:5′ UGGGGUAUUUGACAAACUGACA 3′。
5.细胞克隆实验:取生长状态良好的细胞,根据不同的照射剂量(0、2、4、6、8 Gy),源靶距(SSD) 100 cm,照射野10 cm×10 cm,剂量率5 Gy/min,射野覆盖全细胞培养板,接种不同浓度细胞至6孔板中,加入培养基至3 ml,放入37℃、5%CO2的培养箱中培养。显微镜下每2天观察1次,7 d左右出现肉眼可见的克隆团,即可终止培养,加入PBS清洗3次,甲醇固定20 min,姬姆萨染色40 min,自来水清洗数分钟,显微镜下计算有效克隆数(≥50细胞数)。细胞的克隆形成率=有效克隆数/接种细胞数×100%。
6.细胞凋亡实验:取生长状态良好的细胞,调整其浓度为1×106/ml,培养24 h后,弃去培养基,制成单细胞悬液,每孔加入5 μl Annexin V-FITC和5 μl PI,混合均匀,避光静置10 min,流式细胞仪分析凋亡率。
7.靶基因的预测:使用生物信息学数据库starBase对靶基因进行预测,进行后续研究。
8.双荧光素酶报告基因法:将293T细胞接种于24孔板中,待细胞汇合度达到80%左右,将1 μg报告基因、50 ng内参pRL-TK共转染293T细胞,置于细胞培养箱中培养24 h,加入miR-223 mimics、anti-miR-223或者正常细胞对照转染细胞,24 h加入60 μl细胞裂解液,摇床中振荡20 min,加入底物,分析荧光素酶的活性。
9 统计学处理:采用SPSS 22.0软件进行分析。结果以x±s表示。两组间数据的比较经正态性检验符合正态分布采用t检验,P < 0.05为差异有统计学意义。
结果1. lncRNA GAS5在结直肠癌细胞内相对低表达:qPCR检测结果如图 1所示,与人正常结肠上皮细胞(NCM460)相比,lncRNA GAS5在结肠癌细胞系SW480、LOVO、HT-29、SW620中的表达量显著降低,差异有统计学意义(t=15.25、8.69、14.42、11.62,P < 0.05),其中lncRNA GAS5在结肠癌SW480表达量最低,因此选取SW480细胞进行后续实验。
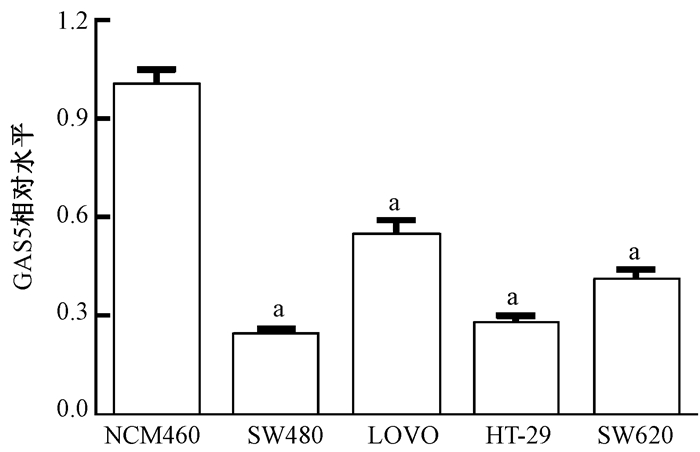
|
图 1 LncRNA GAS5在结肠癌细胞系中的表达水平 注:a与人正常结肠上皮细胞相比,t=15.25、8.69、14.42、11.62,P < 0.05 Figure 1 Expression levels of lncRNA GAS5 in different colon cancer cell lines |
2.过表达lncRNA GAS5增强结直肠癌细胞放射敏感性:结果如图 2A所示,结肠癌SW480细胞转染后,经qPCR检测结果显示,与转染携带无意序列的pcDNA相比,lncRNA GAS5在转染携带目的序列pcDNA的细胞中表达量显著增加,差异有统计学意义(t=12.23,P < 0.05);上调lncRNA GAS5在结肠癌SW480细胞中的表达量显著降低细胞的存活分数、促进凋亡,增加结肠癌细胞放疗敏感性(图 2B-F),其中lncRNA GAS5放射增敏比为2.155(表 1)。
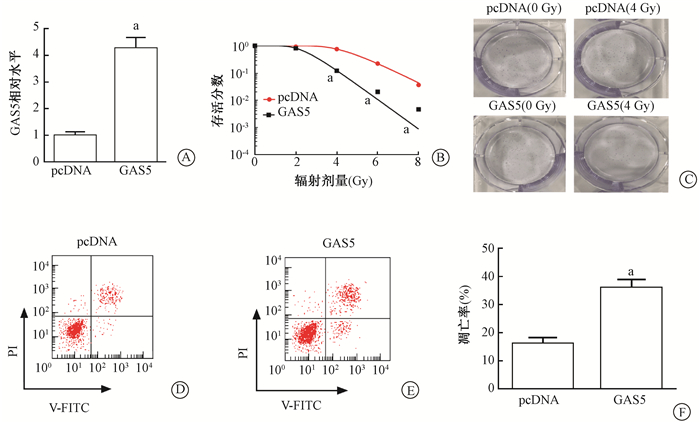
|
图 2 上调lncRNA GAS5对SW480细胞存活曲线、凋亡的影响A. qPCR检测转染pcDNA 3.1-GAS5后SW480细胞中lncRNA GAS5的表达量;B~C.细胞克隆实验检测过表达lncRNA GAS5对SW480细胞存活分数的影响;D~F.流式细胞术检测过表达lncRNA GAS5对SW480细胞凋亡的影响 注:a与pcDNA组相比,t=12.23、8.96、9.85、13.51、8.30,P < 0.05 Figure 2 Up-regulation of lncRNA GAS5 on survival and apoptosis induction of SW480 cells A. qPCR was used to detect the expression of lncRNA GAS5 in SW480 cells transfected with pcDNA 3.1-GAS5; B-C. Cell clone assay was used to detect the effect of overexpression of lncRNA GAS5 on the survival fraction of SW480 cells; D-F. Flow cytometry was used to detect the effect of expression of lncRNA GAS5 on apoptosis of SW480 cells |
|
|
表 1 过表达lncRNA GAS5对细胞存活率及其单击多靶模型拟合参数的影响 Table 1 Influences of overexpression of lncRNA GAS5 on cell survival curve and the fitting parameters using the single-hit multi-target model |
3. lncRNA GAS5与miR-223的靶向验证:经过starBase软件预测结果显示(图 3A),lncRNA GAS5和miR-223之间有相似的结合位点,推测lncRNA GAS5可能对miR-223有一定的调控作用。双荧光素酶报告基因法检测结果显示(图 3B、C),当上调miR-223表达量,野生型的lncRNA GAS5 3′UTR报告基因的相对荧光素酶活性显著受到抑制(t=26.36,P < 0.05),相比之下,突变型lncRNA GAS5 3′UTR报告基因的相对荧光素酶活性无显著变化(P>0.05);下调miR-223表达量时,野生型的lncRNA GAS5 3′UTR报告基因的相对荧光素酶活性显著升高(t=15.09,P < 0.05),突变型lncRNA GAS5 3′UTR报告基因的相对荧光素酶活性仍无显著变化(P>0.05)。
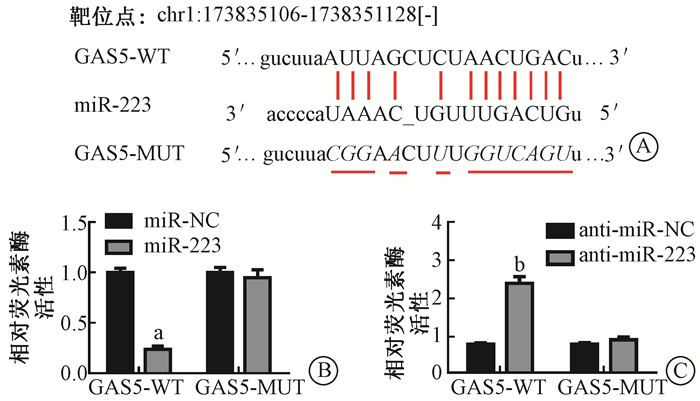
|
图 3 双荧光素酶实验检测lncRNA GAS5和miR-223之间的调控关系A. starBase软件预测lncRNA GAS5和miR-223 3′UTR的结合位点;B.双荧光素酶报告基因实验检测过表达miR-223对荧光素酶活性的影响;C.双荧光素酶报告基因实验检测抑制miR-223对荧光素酶活性的影响 注:a与miR-NC组相比,t=15.01,P < 0.05;b与anti-miR-NC组相比,t=12.93,P < 0.05 Figure 3 Dual luciferase reporter assay was used to detect the relationship of lncRNA GAS5 and miR-223. A. The binding sites predicted by starBase software for lncRNA GAS5 and miR-223 3′-UTR; B. Dual luciferase reporter assay was used to detect the influence of miR-223 on luciferase activity; C. Dual luciferase reporter assay was used to detect the influence of anti-miR-223 on luciferase activity |
4. anti-miR-223增强结直肠癌细胞放射敏感性:qPCR检测miR-223在结直肠癌各细胞系中的表达量,结果如图 4A 所示,与人正常结肠上皮细胞相比,miR-223在结肠癌SW480、LOVO、HT-29、SW620细胞系中的表达量显著增加,差异有统计学意义(t=10.35、7.56、7.67、6.76, P < 0.05),其中在SW480细胞中的表达量显著最高;转染anti-miR-223载体进入SW480细胞,显著降低细胞中miR-223的表达量(图 4B);下调miR-223的表达量显著抑制SW480细胞存活分数、促进凋亡,增加结肠癌细胞放疗敏感性(图 4C-G),其中anti-miR-223放射增敏比为2.345(表 2)。
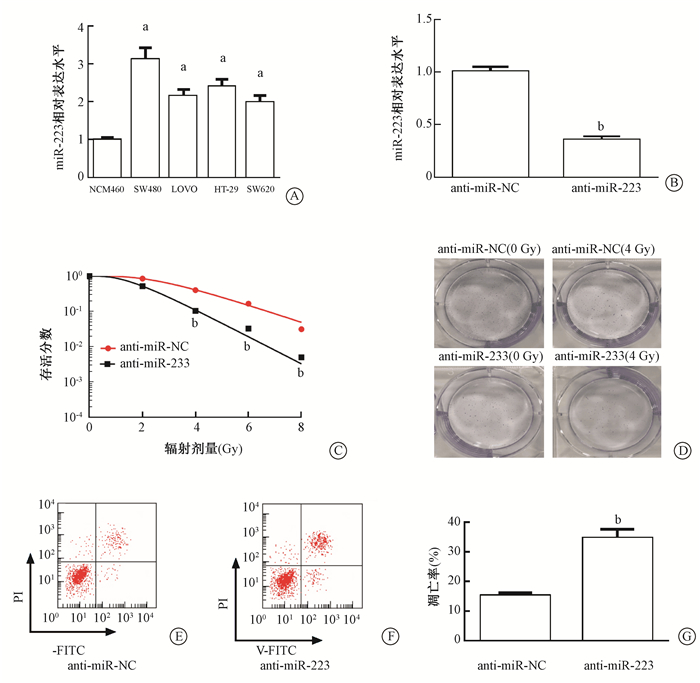
|
图 4 下调miR-223对SW480细胞存活曲线、凋亡的影响A.qPCR检测miR-223在结肠癌细胞系(SW480、LOVO、HT-29、SW620)中的表达量;B.qPCR检测转染anti-miR-223后SW480细胞中miR-223的表达量;C~D.细胞克隆实验检测抑制miR-223对SW480细胞存活分数的影响;E~G.流式细胞术检测抑制miR-223对SW480细胞凋亡率的影响 注:a与NCM460相比,t=12.07、9.41、11.68、8.07,P < 0.05;b与anti-miR-NC组相比,t=12.78、11.76、11.92、14.93、7.32,P < 0.05 Figure 4 Influence of downregulation of miR-223 on survival and apoptosis of SW480 cells. A. qPCR was used to detect miR-223 expression in colon cancer cell lines (SW480, LOVO, HT-29, SW620); B. qPCR was used to detect the expression of miR-223 in SW480 cells after anti-miR-223; C-D. Cell clone assay was used to detect the effect of miR-223 on the survival of SW480 cells; E-G. Flow cytometry was used to detect the effect of anti-miR-223 on apoptosis of SW480 cells |
|
|
表 2 Anti-miR-223对细胞存活率及单击多靶模型拟合参数的影响 Table 2 Influences of anti-miR-223 on cell survival curve and the fitting parameters using the single-hit multi-target model |
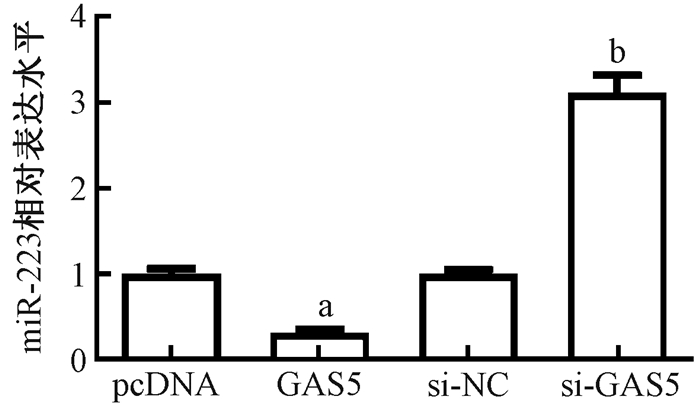
5. lncRNA GAS5调控miR-223的表达量:qPCR检测结果显示(图 5),过表达lncRNA GAS5显著降低miR-223的表达量,与对照组相比,差异具有统计学意义(t=8.35,P < 0.05);下调lncRNA GAS5的表达量促进SW480细胞中miR-223的表达量,与对照组相比,差异具有统计学意义(t=8.59,P < 0.05)。
|
图 5 lncRNA GAS5表达量对miR-223水平的调控作用 注:a与pcDNA组相比,t=8.35,P < 0.05;b与si-NC组相比,t=8.59,P < 0.05 Figure 5 Regulation of the overexpression of lncRNA GAS5 on the level of miR-223 |
讨论
研究发现,lncRNAs与多种肿瘤细胞的分化、增殖、凋亡和发展过程密切相关,为肿瘤的临床治疗提供了新的研究方向[6-7]。lncRNA在肿瘤组织中的表达量异常,对肿瘤的发生、发展起着抑制或者促进作用[8-10]。研究证实,lncRNA MALAT1可靶向调控胰腺癌细胞中miR-204的表达水平从而影响细胞的恶性生物学特性,对胰腺癌的进展起重要调控作用[11]。在结肠癌中,lncRNAs可通过抑制或促进肿瘤细胞的增殖、分化、侵袭等生物学特性参与结肠癌的进展。近年来的研究表明,lncRNAs与肿瘤的放射敏感性也具有显著相关性,如HOTAIR可显著抑制p21的表达量,从而降低宫颈癌HeLa细胞放射敏感性[12]。lncRNAs也可通过促进肿瘤细胞的凋亡率,从而增加放射敏感性,如lncRNA ANRIL显著促进鼻咽癌细胞的凋亡从而增加细胞的放射敏感性[13],提示可通过研究lncRNAs的在肿瘤中的作用机制,提高细胞的放射敏感性,增强放射治疗的效果。
lncRNA GAS5含有630个碱基,参与机体许多生命活动。研究表明,在肿瘤的发生、发展过程中,lncRNA GAS5可作为一种肿瘤抑制因子发挥重要作用。研究证实,lncRNA GAS5在多种肿瘤组织中的表达量显著降低,如乳腺癌[14]、胃癌[15]、非小细胞肺癌[16]以及前列腺癌[17],且与细胞的生长、凋亡密切相关。目前,lncRNA GAS5在结肠癌细胞的表达以及与细胞放射敏感性的相关研究较少。本研究通过qPCR实验检测lncRNA GAS5在多种结肠癌细胞系中的表达量,结果显示,与前人研究结果一致,lncRNA GAS5在结肠癌细胞系中的表达水平较正常结肠上皮细胞显著降低;过表达lncRNA GAS5显著抑制SW480细胞的存活分数,诱导细胞凋亡,增强SW480细胞的放射敏感性。
lncRNAs可通过多种途径参与肿瘤的发生、发展[18-19]。研究表明,miRNA可与lncRNAs相互作用从而发挥调控肿瘤细胞生物学行为、放射敏感性的作用,如miR-145的表达量与DNMT3具有负相关性,可通过负反馈影响前列腺癌细胞的放射敏感性[20]。众多研究表明,miR-223在结肠癌组织以及血清中的表达量异常,与结肠癌细胞的恶性生物学特性、肿瘤的转移以及预后密切相关[21-22]。为探明lncRNA GAS5在结肠癌中的相关作用机制,本研究通过starBase软件预测发现,lncRNA GAS5和miR-223之间部分碱基通过互补配对结合,推测lncRNA GAS5可能对miR-223有一定的调控作用;进一步通过双荧光素酶报告基因法检测发现,无论上调或下调miR-223的表达量,野生型的lncRNA GAS5 3′UTR报告基因的相对荧光素酶活性均发生相应变化,而突变型的lncRNA GAS5 3′UTR报告基因的相对荧光素酶活性均无明显变化,表明lncRNA GAS5可以结合miR-223的3′UTR处序列抑制其表达量;下调miR-223的表达量显著抑制SW480细胞的存活分数,诱导细胞凋亡,增强SW480细胞的放射敏感性,与过表达lncRNA GAS5结果相似;上调或下调lncRNA GAS5的表达显著调节SW480细胞中miR-223的表达量,表明miR-223和lncRNA GAS5形成一个负调控,并通过该负反馈通路调控结肠癌细胞的放射敏感性,以上均说明lncRNA GAS5可直接调控miR-223表达及活性影响结肠癌细胞的放射敏感性。
综上所述,本研究通过qPCR检测了lncRNA GAS5在结肠癌细胞系中的表达量以及对细胞放射敏感性的影响,结果发现lncRNA GAS5在多种结肠癌细胞系中的表达量下调,可能通过靶向作用与miR-223调控结肠癌细胞放射敏感性。但本研究只在体外探讨了lncRNA GAS5对结肠癌细胞放射敏感性的作用,并没有在体内进行验证,后续会在体内进行进一步探讨。
利益冲突 第一作者对全文负责,所有作者承诺实验、文章没有利益冲突作者贡献声明 李孝敏参与实验设计、数据整理、论文撰写;赵浩亮参与实验设计及数据的统计学处理;马鹏负责实验验收;王晋喜负责论文校对;郭修栋负责实验实施和数据统计
| [1] |
Talvinen K, Tuikkala J, Grönroos J, et al. Biochemical and clinical approaches in evaluating the prognosis of colon cancer[J]. Anticancer Res, 2006, 26(6C): 4745-4751. |
| [2] |
He K, Zheng X, Li M, et al. mTOR inhibitors induce apoptosis in colon cancer cells via CHOP-dependent DR5 induction on 4E-BP1 dephosphorylation[J]. Oncogene, 2016, 35(2): 148-157. DOI:10.1038/onc.2015.79 |
| [3] |
Dhamija S, Diederichs S. From junk to master regulators of invasion:lncRNA functions in migration, EMT and metastasis[J]. Int J Cancer, 2016, 139(2): 269-280. |
| [4] |
Hu X, Bao J, Wang Z, et al. The plasma lncRNA acting as fingerprint in non-small-cell lung cancer[J]. Tumour Biol, 2016, 37(3): 3497-3504. DOI:10.1007/s13277-015-4023-9 |
| [5] |
Peng WX, Koirala P, Mo YY. LncRNA-mediated regulation of cell signaling in cancer[J]. Oncogene, 2017, 36(41): 5661-5667. DOI:10.1038/onc.2017.184 |
| [6] |
Zang W, Tao W, Wang Y, et al. Knockdown of long non-coding RNA TP73-AS1 inhibits cell proliferation and induces apoptosis in esophageal squamous cell carcinoma[J]. Oncotarget, 2016, 7(15): 19960-19974. DOI:10.18632/oncotarget.6963 |
| [7] |
邓荣华, 黄进团, 谷欣. lncRNA MEG3对肝癌细胞增殖凋亡的影响及机制研究[J]. 临床和实验医学杂志, 2017, 16(14): 1363-1366. Deng RH, Huang JT, Gu X. Study on the mechanism of lncRNA MEG3 on cell proliferation and apoptosis of hepatocellular carcinoma[J]. J Clin Experiment Med, 2017, 16(14): 1363-1366. DOI:10.3969/j.issn.1671-4695.2017.14.004 |
| [8] |
Yang Y, Shao Y, Zhu M, et al. Using gastric juice lncRNA-ABHD11-AS1 as a novel type of biomarker in the screening of gastric cancer[J]. Tumour Biol, 2016, 37(1): 1-6. DOI:10.1007/s13277-015-3903-3 |
| [9] |
Jin Y, Cui Z, Li X, et al. Upregulation of long non-coding RNA PlncRNA-1 promotes proliferation and induces epithelial-mesenchymal transition in prostate cancer[J]. Oncotarget, 2017, 8(16): 26090-26099. DOI:10.18632/oncotarget.15318 |
| [10] |
Li J, Meng H, Bai Y, et al. Regulation of lncRNA and its role in cancer metastasis[J]. Oncol Res, 2016, 23(5): 205-217. DOI:10.3727/096504016X14549667334007 |
| [11] |
张小路, 杜梅红. lncRNA MALAT1调控miR-204表达影响胰腺癌细胞的生物学行为[J]. 中国肿瘤生物治疗杂志, 2018, 25(1): 79-84. Zhang XL, Du MH. Long chain non-coding MALAT1 affects biological behavior of pancreatic cancer cells by regulating miR-204 expression[J]. Chin J Cancer Biother, 2018, 25(1): 79-84. DOI:10.3872/j.issn.1007-385x.2018.01.014 |
| [12] |
Li J, Wang Y, Dong R, et al. HOTAIR enhanced aggressive biological behaviors and induced radio-resistance via inhibiting p21 in cervical cancer[J]. Tumour Biol, 2015, 36(5): 3611-3619. DOI:10.1007/s13277-014-2998-2 |
| [13] |
Hu X, Jiang H, Jiang X. Downregulation of lncRNA ANRIL inhibits proliferation, induces apoptosis, and enhances radiosensitivity in nasopharyngeal carcinoma cells through regulating miR-125a[J]. Cancer Biol Ther, 2017, 18(5): 331-338. DOI:10.1080/15384047.2017.1310348 |
| [14] |
Pickard MR, Williams GT. The hormone response element mimic sequence of GAS5 lncRNA is sufficient to induce apoptosis in breast cancer cells[J]. Oncotarget, 2016, 7(9): 10104-10116. DOI:10.18632/oncotarget.7173 |
| [15] |
Zhang N, Wang AY, Wang XK, et al. GAS5 is downregulated in gastric cancer cells by promoter hypermethylation and regulates adriamycin sensitivity[J]. Eur Rev Med Pharmacol Sci, 2016, 20(15): 3199-3205. |
| [16] |
Liang W, Lv T, Shi X, et al. Circulating long noncoding RNA GAS5 is a novel biomarker for the diagnosis of nonsmall cell lung cancer[J]. Medicine, 2016, 95(37): e4608. DOI:10.1097/MD.0000000000004608 |
| [17] |
Dong X, Zhou C, Hao L, et al. LncRNA GAS5 inhibits proliferation and progression of prostate cancer by targeting miR-103 through AKT/mTOR signaling pathway[J]. Tumour Biol, 2016, 37(12): 1-11. DOI:10.1007/s13277-016-5429-8 |
| [18] |
Xu CG, Yang MF, Ren YQ, et al. Exosomes mediated transfer of lncRNA UCA1 results in increased tamoxifen resistance in breast cancer cells[J]. Eur Rev Med Pharmacol Sci, 2016, 20(20): 4362-4368. |
| [19] |
Han P, Li JW, Zhang BM, et al. The lncRNA CRNDE promotes colorectal cancer cell proliferation and chemoresistance via miR-181a-5p-mediated regulation of Wnt/β-catenin signaling[J]. Mol Cancer, 2017, 16(1): 9. DOI:10.1186/s12943-017-0583-1 |
| [20] |
Xue G, Ren Z, Chen Y, et al. A feedback regulation between miR-145 and DNA methyltransferase 3b in prostate cancer cell and their responses to irradiation[J]. Cancer Lett, 2015, 361(1): 121-127. DOI:10.1016/j.canlet.2015.02.046 |
| [21] |
Liu L, Zhang C, Li X, et al. miR-223 promotes colon cancer by directly targeting p120 catenin[J]. Oncotarget, 2017, 8(38): 63764-63779. DOI:10.18632/oncotarget.19541 |
| [22] |
Li ZW, Yang YM, Du LT, et al. Overexpression of miR-223 correlates with tumor metastasis and poor prognosis in patients with colorectal cancer[J]. Med Oncol, 2014, 31(11): 256. DOI:10.1007/s12032-014-0256-5 |
 2018, Vol. 38
2018, Vol. 38
