放射治疗是癌症的主要治疗手段之一,但在治疗过程中常造成周围正常组织的损伤,严重影响患者疗效和生活质量。然而,目前对放射治疗引起的正常组织损伤的防治手段还很匮乏[1-2]。因此,研究放射治疗并发症的发生机制,寻找有效治疗靶点,探索更高效的治疗措施,是重要的研究课题。
缝隙连接是两个相邻细胞膜表面的跨膜通道,能够介导细胞间通讯、离子、电子、第二信使等,对细胞的新陈代谢、内环境稳定、增殖和凋亡等生理过程起着重要的调控作用[3]。缝隙连接由缝隙连接蛋白组成,根据蛋白分子量的不同分为Cx43、Cx37、Cx40等。目前研究显示,Cx43在内皮细胞增殖[4-6]、凋亡[7-8]、通透性[9-10]和炎症因子黏附[11-12]过程发挥重要作用。而Cx43在电离辐射致正常组织损伤中的作用鲜见报道,而且其作用机制不明确。本研究通过检测不同剂量X射线对Cx43表达的影响,以及Cx43沉默或者过表达对X射线导致的HUVEC细胞凋亡的影响,探讨Cx43表达变化对受照HUVEC细胞损伤的作用,为进一步研究X射线致HUVEC细胞损伤机制及防治方法提供重要的理论依据。
材料与方法1.试剂和仪器:胎牛血清(FBS)、RPMI 1640培养基均购自美国GIBCO公司;AnnexinV-FITC细胞凋亡检测试剂盒购自南京凯基生物科技有限公司;兔抗人Cx43抗体,cleaved caspase-3抗体,β-tublin抗体(#2146)购自美国Cell Signaling公司,Western blot蛋白提取裂解液购自美国Pierce公司、发光检测试剂盒购自美国Millipore公司,蛋白定量试剂盒、硝酸纤维素膜均购自北京普利莱公司,牛血清白蛋白购自美国Amresco公司,Cx43 siRNA、无意序列(Negative Control)siRNA购自美国Invitrogen公司,Cx43过表达质粒(pCMV-Cx43)及空载体(pCMV5)均购自北京Biovector NTCC公司,沉默转染试剂LipofectamineTM RNAiMAX和过表达转染试剂LipofectamineTM 3000均购自美国Invitrogen公司。发光检测成像系统ChemiDoc XRC+为美国Bio-rad公司产品,FACSCalibur型流式细胞仪购自美国BD公司。
2.细胞培养:实验采用正常人脐静脉内皮细胞(HUVEC),由本实验室保存。细胞在含10% FBS的RPMI 1640培养基,37℃,5%CO2、饱和湿度下培养。后续实验分为:空白对照组(con),照射对照组(IR),照射+无意序列组(沉默组阴性对照,IR-scr),照射+Cx43沉默组(IR-siCx43), 照射+质粒空载体组(IR-pCMV5), 照射+Cx43过表达组(IR-pCMV-Cx43)。
3.细胞照射条件:细胞实验采用火箭军总医院医用直线加速器Precise(瑞典Elekta公司), 剂量率为5 Gy/min,源靶距100 cm,吸收剂量为5、10、20 Gy,单次照射。
4.Cx43表达沉默及过表达:采用10 nmol/L Cx43 siRNA转染HUVEC细胞,无意序列(Negative Control)siRNA作为Cx43沉默组的阴性对照,转染试剂为LipofectamineTM RNAiMAX,根据试剂说明书进行操作。在相应时间点进行Western blot实验,明确Cx43表达沉默的实验条件。
采用购买的Cx43过表达质粒及空载体转染HUVEC细胞,转染试剂为LipofectamineTM 3000转染试剂,根据试剂说明书进行操作。在相应时间点进行Western blot实验,明确Cx43过表达的实验条件。
5. Western blot检测蛋白表达:提取细胞全蛋白并定量,与5×蛋白上样缓冲液混匀,置于沸水中加热5 min后,迅速放入冰中冷却。取各组等量蛋白行SDS-PAGE电泳,并采用硝酸纤维素膜转膜,5% BSA封闭后分别用Cx43,cleaved caspase-3和β-tublin一抗孵育,4℃过夜,二抗孵育,室温1 h,滴加发光液,用发光检测成像系统拍摄条带图像检测蛋白表达。
6.细胞凋亡检测:照射后收集细胞并用预冷的PBS洗2次(离心半径9.5 cm,转速2 000 r/min,5 min), 收集1×105~5×105细胞,将细胞重悬于500 μl Binding Buffer,加5 μl膜联蛋白V-FITC(Annexin V-FITC)和5 μl碘化丙啶(PI)于管中混匀,20~25℃避光反应15 min,1 h内用流式细胞仪于波长488 nm处检测。
7.统计学处理:所有实验重复3次,取均值。实验数据符合正态分布, 采用x±s表示,Graph pad统计软件对数据进行分析及作图。两组数据比较采用独立样本t检验,P<0.05为差异有统计学意义。Western blot图片灰度分析采用Image J图像处理软件进行分析。
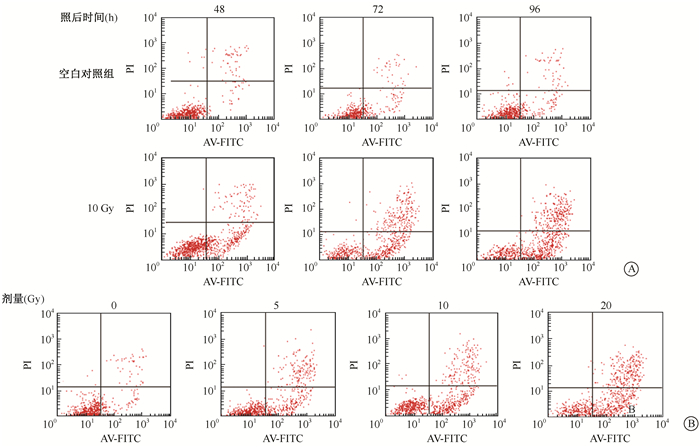
结果1.X射线对HUVEC细胞凋亡的影响:结果见图 1。10 Gy X射线照射后48~96 h,HUVEC细胞早期凋亡率明显上升,照射对照组与空白对照组分别为照后48 h(28.86±1.57)% vs.(4.58±0.73)%,照后72 h为(35.96±2.33)% vs.(11.05±1.20)%,照后96 h为(43.08±2.60)% vs.(11.33±1.16)%(t=27.96、16.45、19.32,P < 0.05)。不同剂量X射线照射后72 h,早期凋亡细胞随照射剂量的增加而增加,空白对照组、5、10、20 Gy照射组凋亡率分别为(11.05±1.20)%、(26.30±0.36)%、(35.96±2.33)%、(41.72±2.54)%,与空白对照组相比,差异均有统计学意义(t=21.03、16.45、18.93,P < 0.05)。
|
图 1 X射线对HUVEC细胞凋亡的影响A. HUVEC细胞受10 Gy照射后不同时间的凋亡流式检测图;B. HUVEC细胞不同剂量受照后72 h的凋亡流式检测图 Figure 1 The apoptosis of HUVEC cells after X-ray irradiation A. HUVEC apoptosis at different time after 10 Gy irradiation; B. HUVEC apoptosis at 72 h after different doses of irradiation |
2. X射线对Cx43及cleaved caspase-3蛋白表达的影响:结果见图 2。HUVEC细胞接受不同剂量X射线照射后72 h,与0 Gy相比,各剂量组Cx43表达均呈明显的下调趋势。5、10、20 Gy组Cx43表达量为0 Gy组的84.6%、69.8%、44.0%(t=3.44、6.42、18.65,P < 0.05)。而cleaved caspase-3的表达则随射线剂量的增加而增加,5、10、20 Gy组cleaved caspase-3表达量为0 Gy组的2.3、4.5、12.5倍(t=8.55、15.79、16.49,P < 0.05)。

|
图 2 不同剂量X射线对Cx43和cleaved caspase-3蛋白表达的影响A. Cx43蛋白表达;B. cleaved caspase-3蛋白表达 Figure 2 Expressions of Cx43 and cleaved caspase-3 in HUVEC cells irradiated with different doses of X-ray A. Cx43 protein expression; B. Cleaved caspase-3 protein expression |
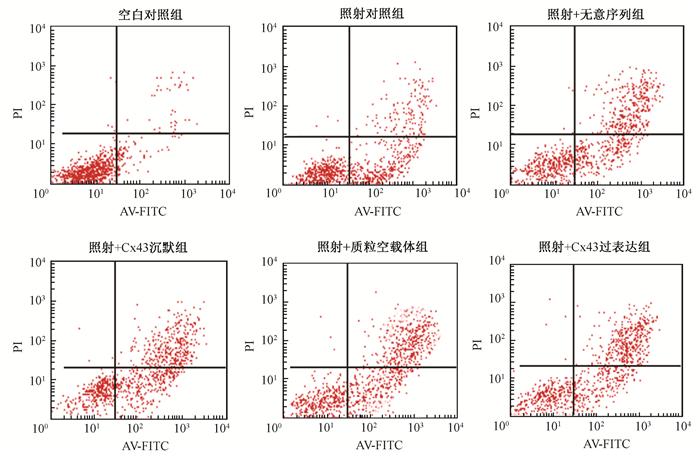
3. Cx43对X射线诱导的HUVEC细胞凋亡的作用:为进一步探讨Cx43对X射线诱导的HUVEC细胞凋亡的作用,对Cx43的表达进行沉默或过表达干预,检测受照后HUVEC细胞凋亡以及cleaved caspase-3的表达变化,结果见图 3,表 1。Cx43沉默增加受照HUVEC细胞早期凋亡以及凋亡死亡细胞百分比,而Cx43过表达可以明显降低受照HUVEC细胞早期凋亡以及凋亡死亡细胞百分比。
|
图 3 Cx43对X射线诱导的HUVEC细胞凋亡的影响 Figure 3 Effect of Cx43 on X-ray induced apoptosis in HUVEC |
|
|
表 1 不同处理组细胞早期凋亡及凋亡死亡细胞比例(x±s) Table 1 Percentages of early apoptosis and apoptosis combined dead cells in different treatment groups(x±s) |
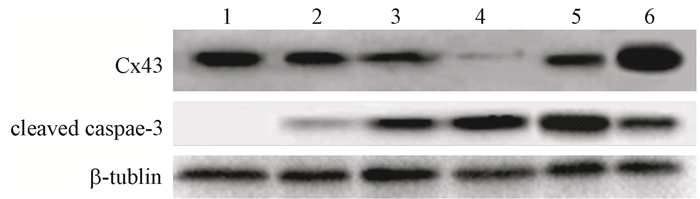
如图 4所示,首先对Cx43沉默及过表达效率进行检测,结果显示,IR-siCx43组Cx43表达量相比于IR-scr组下降约90%,IR-pCMV-Cx43组Cx43表达量为IR-pCMV5组的280%,满足实验所需条件;接下来检测Cx43沉默及过表达对cleaved caspase-3的影响,IR-siCx43组细胞中cleaved caspase-3蛋白表达量比IR-scr组提高了38.6%(t=4.68,P < 0.05),而IR-pCMV-Cx43组中cleaved caspase-3表达量降低为IR-pCMV5组的61.6%(t=4.35,P < 0.05)。说明Cx43通过影响cleaved caspase-3活化从而影响X射线诱发的HUVEC细胞凋亡。
|
图 4 不同处理组cleaved caspase-3蛋白表达情况 注:1.空白对照组;2.照射对照组;3.照射+无意序列组;4.照射+Cx43沉默组;5.照射+质粒空载体组;6.照射+Cx43过表达组 Figure 4 Expression of cleaved caspase-3 in different treatment groups |
讨论
放射治疗所致正常组织损伤多以炎症反应为起始,渗出和炎症细胞聚集黏附为主要特征,逐步发展恶化。而炎症以血管反应为核心,血管内皮细胞是介导炎症反应的关键细胞[13-14]。因此深入探讨放射所致血管内皮细胞损伤机制对放射治疗并发症防治方法的研究尤为重要。本研究采用的HUVEC细胞为目前公认的血管内皮细胞研究模型,采用医用直线加速器对细胞照射后,构建血管内皮细胞损伤模型,从而模拟临床放射治疗时血管内皮细胞的损伤过程。
许多研究表明,Cx43在细胞内环境稳定、生长、分化和死亡过程中起到重要作用,对多种损伤具有保护作用。有文献报道,衰老导致的Cx43表达下降,是骨细胞凋亡的重要原因[15]。Viczenczova等[16]研究发现单次5 MeV直线加速器25 Gy照射Wistar大鼠胸部使Cx43的表达和磷酸化水平增加,从而促进细胞间的信号传导,对心肌细胞产生保护作用;Puzzo等[17]报道指出Cx43在肿瘤细胞中表达量降低,而表达Cx43的肿瘤患者的预后优于不表达的患者。本研究发现,0~20 Gy X射线照射诱导HUVEC细胞内Cx43表达量降低,同时细胞凋亡增加。Cx43沉默后受照HUVEC细胞凋亡比无意序列组明显增加,而Cx43过表达的受照HUVEC细胞凋亡百分率低于空载体组降低。由此可以推测,X射线照射引起的Cx43蛋白表达下调可能是受照HUVEC细胞凋亡的重要原因。增强Cx43蛋白的表达水平可以对受照HUVEC细胞起到保护作用。
最近研究显示,Cx43调控凋亡过程的机制可能与线粒体膜上Cx43减少导致的线粒体内ROS增多、钙超载以及线粒体膜的去极化有关[18]。此外,Cx43除了可以作为通道以及半通道的组成成分发挥通道作用,还能够独立成为介导凋亡的信号分子[19]。在研究帕金森发病机制中,过表达Cx43能够降低凋亡信号分子Bax/Bcl2比例以及细胞色素C释放,调节线粒体凋亡途径,从而保护神经元细胞[20]。Caspase-3是细胞凋亡的主要执行分子,但在X射线诱导的凋亡过程中,Cx43对caspase-3的调控作用鲜见报道。本实验中发现,Cx43表达沉默可以增强caspase-3的活化,促进HUVEC细胞凋亡,Cx43过表达则可以抑制caspase-3的活化以及HUVEC细胞凋亡,说明Cx43通过调控caspase-3影响细胞凋亡。然而,也有文献表明,Cx43在灰黄霉素对人生殖细胞的凋亡[21]和氧化低密度脂蛋白(ox-LDL)致HUVEC细胞凋亡过程中具有促进细胞凋亡的作用[22]。这可能与不同病理过程中,组成通道的Cx43表达的不同,导致的通道性质不同,进而传递的信号不同有关[23]。因此,缝隙连接蛋白调控细胞凋亡的过程仍需要进一步深入研究。
放射治疗导致正常组织损伤是一个复杂的过程,但其发生机制尚未完全阐明。本研究对X射线对HUVEC细胞内Cx43表达的影响,Cx43在细胞凋亡中的作用以及调控机制进行了初步探索,这将为放射治疗所致的血管内皮损伤机制的深入研究奠定基础,也将为放射治疗并发症防治方法的研究提供理论支持。
利益冲突 无作者贡献声明 李辰负责实验设计、实验操作、收集分析数据和论文撰写;田梅、苟巧、刘建香、齐雪松、王春燕进行实验和论文修改指导;苏旭负责整体实验设计和指导
| [1] |
Hubenak JR, Zhang Q, Branch CD, et al. Mechanisms of injury to normal tissue after radiotherapy:a review[J]. Plast Reconstr Surg, 2014, 133(1): 49e-56e. DOI:10.1097/01.prs.0000440818.23647.0b |
| [2] |
Maier P, Wenz F, Herskind C. Radioprotection of normal tissue cells[J]. Strahlenther Onkol, 2014, 190(8): 745-752. DOI:10.1007/s00066-014-0637-x |
| [3] |
D'hondt C, Iyyathurai J, Himpens B, et al. Cx43-hemichannel function and regulation in physiology and pathophysiology:insights from the bovine corneal endothelial cell system and beyond[J]. Front Physiol, 2014, 5(Pt10): 348. DOI:10.3389/fphys.2014.00348 |
| [4] |
Yin G, Yang X, Li B, et al. Connexin43 siRNA promotes HUVEC proliferation and inhibits apoptosis induced by ox-LDL:an involvement of ERK signaling pathway[J]. Mol Cell Biochem, 2014, 394(1-2): 101-107. DOI:10.1007/s11010-014-2085-4 |
| [5] |
Li H, He J, Yu H, et al. Bioglass promotes wound healing by affecting gap junction connexin 43 mediated endothelial cell behavior[J]. Biomaterials, 2016, 84: 64-75. DOI:10.1016/j.biomaterials.2016.01.033 |
| [6] |
Bol M, Van Geyt C, Baert S, et al. Inhibiting connexin channels protects against cryopreservation-induced cell death in human blood vessels[J]. Eur J Vasc Endovasc Surg, 2013, 45(4): 382-390. DOI:10.1016/j.ejvs.2012.12.012 |
| [7] |
Kameritsch P, Khandoga N, Pohl U, et al. Gap junctional communication promotes apoptosis in a connexin-type-dependent manner[J]. Cell Death Dis, 2013, 4(4): e584. DOI:10.1038/cddis.2013.105 |
| [8] |
Li AF, Roy S. High glucose-induced downregulation of connexin 43 expression promotes apoptosis in microvascular endothelial cells[J]. Invest Ophthalmol Vis Sci, 2009, 50(3): 1400-1407. DOI:10.1167/iovs.07-1519 |
| [9] |
Parthasarathi K. Endothelial connexin43 mediates acid-induced increases in pulmonary microvascular permeability[J]. Am J Physiol Lung Cell Mol Physiol, 2012, 303(1): L33-42. DOI:10.1152/ajplung.00219.2011 |
| [10] |
Kandasamy K, Escue R, Manna J, et al. Changes in endothelial connexin 43 expression inversely correlate with microvessel permeability and VE-cadherin expression in endotoxin-challenged lungs[J]. Am J Physiol Lung Cell Mol Physiol, 2015, 309(6): L584-592. DOI:10.1152/ajplung.00211.2014 |
| [11] |
Yuan D, Wang Q, Wu D, et al. Monocyte-endothelial adhesion is modulated by Cx43-stimulated ATP release from monocytes[J]. Biochem Biophys Res Commun, 2012, 420(3): 536-541. DOI:10.1016/j.bbrc.2012.03.027 |
| [12] |
Machtaler S, Dang-Lawson M, Choi K, et al. The gap junction protein Cx43 regulates B-lymphocyte spreading and adhesion[J]. J Cell Sci, 2011, 124(Pt 15): 2611-2621. DOI:10.1242/jcs.089532 |
| [13] |
Schaue D, Micewicz ED, Ratikan JA, et al. Radiation and inflammation[J]. Semin Radiat Oncol, 2015, 25(1): 4-10. DOI:10.1016/j.semradonc.2014.07.007 |
| [14] |
Hekim N, Cetin Z, Nikitaki Z, et al. Radiation triggering immune response and inflammation[J]. Cancer Lett, 2015, 368(2): 156-163. DOI:10.1016/j.canlet.2015.04.016 |
| [15] |
Davis HM, Pacheco-Costa R, Atkinson EG, et al. Disruption of the Cx43/miR21 pathway leads to osteocyte apoptosis and increased osteoclastogenesis with aging[J]. Aging Cell, 2017, 16(3): 551-563. DOI:10.1111/acel.12586 |
| [16] |
Viczenczova C, Szeiffova BB, Egan BT, et al. Myocardial connexin-43 and PKC signalling are involved in adaptation of the heart to irradiation-induced injury:Implication of miR-1 and miR-21[J]. Gen Physiol Biophys, 2016, 35(2): 215-222. DOI:10.4149/gpb_2015038 |
| [17] |
Puzzo L, Caltabiano R, Parenti R, et al. Connexin 43(Cx43) expression in laryngeal squamous cell carcinomas:preliminary data on its possible prognostic role[J]. Head Neck Pathol, 2016, 10(3): 292-297. DOI:10.1007/s12105-016-0685-x |
| [18] |
Pecoraro M, Pinto A, Popolo A. Inhibition of Connexin 43 translocation on mitochondria accelerates CoCl2-induced apoptotic response in a chemical model of hypoxia[J]. Toxicol In Vitro, 2018, 47: 120-128. DOI:10.1016/j.tiv.2017.11.004 |
| [19] |
Carette D, Gilleron J, Chevallier D, et al. Connexin a check-point component of cell apoptosis in normal and physiopathological conditions[J]. Biochimie, 2014, 101(6): 1-9. DOI:10.1016/j.biochi.2013.11.015 |
| [20] |
Kim IS, Ganesan P, Choi DK. Cx43 mediates resistance against MPP+-induced apoptosis in SH-SY5Y neuroblastoma cells via modulating the mitochondrial apoptosis pathway[J]. Int J Mol Sci, 2016, 17(11): 1819. DOI:10.3390/ijms17111819 |
| [21] |
Mauro V, Carette D, Pontier-Bres R, et al. The anti-mitotic drug griseofulvin induces apoptosis of human germ cell tumor cells through a connexin 43-dependent molecular mechanism[J]. Apoptosis, 2013, 18(4): 480-491. DOI:10.1007/s10495-012-0800-8 |
| [22] |
Yin G, Yang X, Li B, et al. Connexin43 siRNA promotes HUVEC proliferation and inhibits apoptosis induced by ox-LDL:an involvement of ERK signaling pathway[J]. Mol Cell Biochem, 2014, 394(1-2): 101-107. DOI:10.1007/s11010-014-2085-4 |
| [23] |
Gilleron J, Carette D, Segretain D, et al. Multiple and complex influences of connexins and pannexins on cell death[J]. Biochim Biophys Acta, 2018, 1860(1): 182-191. DOI:10.1016/j.bbamem.2017.06.004 |
 2018, Vol. 38
2018, Vol. 38


