2. 750004 银川, 宁夏医科大学总医院附属肿瘤医院放疗科
2. Department of Radiotherapy, Cancer Hospital, General Hospital of Ningxia Medical University, Yinchuan 750004, China
放射治疗是结肠癌治疗的重要手段[1]。但结肠癌95%以上为腺癌[2],其对射线的敏感性差,尤其是高分化腺癌。另外由于小肠的限制,难以提高结肠癌放射治疗剂量,治疗增益比低。因此,寻找真正低毒有效的放疗增敏剂,成为肿瘤放射医学研究中最为活跃的课题之一。DNA的损伤修复是造成X射线抗拒的重要原因[3]。Rev1是跨损伤DNA合成通路中的关键基因,同时也是参与同源重组修复的关键基因[4]。其一方面可维持基因组的完整性,另一方面在双链断裂的修复中也发挥了重要作用。国外研究表明,在细胞水平,Rev1的失调直接导致突变的积累和细胞死亡的抑制[5]。国内研究表明,Rev1可逆转铂类耐药,能显著提高肿瘤细胞的化疗敏感性[6]。鉴于此,本研究选择人高分化结肠癌细胞THC8307为研究对象,尝试通过沉默Rev1基因,观察X射线对人高分化结肠癌细胞增殖、凋亡的影响,以期探寻干预结肠癌治疗的新思路。
材料与方法1.细胞与试剂:人高分化结肠癌细胞株THC8307(宁夏医科大学生育力保持教育部重点实验室保存),DMEM培养基(美国GIBCO公司),Rev1抗体、PCNA抗体、γ-H2AX抗体均购自美国Abcam公司,P53抗体、Bcl-2抗体、Bax抗体均购自美国Santa Cruz公司,GAPDH抗体(北京中杉金桥公司),四甲基偶氮唑盐(MTT)试剂盒(上海贝博公司),Annexin V-FITC/PI细胞凋亡检测试剂盒(上海贝博公司),辣根过氧化物酶(HRP)标记的山羊抗兔IgG(北京中杉金桥公司),Rev1干扰序列(上海吉玛基因),Rev1、GAPDH基因引物(上海生工生物工程有限公司),R4000 RNA转染试剂(北京英格恩生物科技有限公司),反转录试剂盒(日本TaKaRa公司)。
2.Rev1基因干扰siRNA的合成:Rev1 siRNA干扰序列由首都医科大学生命科学学院萧伟教授设计,正义链:5′ AUCGGUGGAAUCGGUUUGGAATT 3′,反义链:5′ UUCCAAACCGAUUCCACCGAUTT 3′。siRNA阴性干扰片段基因序列:5′ UUCUCCGAACGUGUCACGUTT 3′,反义链:5′ ACGUGACACGUUCGGAGAATT 3′。将Rev1和阴性干扰片段的基因序列信息,送至上海GenePharma公司,完成构建。
3.细胞照射:常规培养THC8307细胞,后分为3组(空白对照组、阴性对照组、Rev1 siRNA组)。用瑞典医科达直线加速器(6 MV X射线,剂量率为200 cGy/min,源靶距100 cm,射野面积30 cm×30 cm,组织补偿物1.5 cm,机架旋转180°)照射上述细胞,然后进行后续实验。
4.Real-time PCR检测细胞中Rev1基因的表达:常规培养THC8307,按照R4000 RNA转染试剂说明操作,将Rev1基因的干扰片段转入THC8307细胞, 其作为实验组(Rev1 siRNA组),转染阴性干扰片段的细胞为阴性对照组,不作任何处理的细胞为空白对照组。收集上述3组细胞并提取细胞中总的RNA,后反转录合成cDNA。按照Real-time PCR试剂盒说明进行操作,用7500 Fast检测Rev1基因的表达,重复3次实验,通过比较CT值法(2-△△Ct)进行相对定量分析。
5.Western blot检测细胞中Rev1蛋白的表达:收集各组细胞(空白对照组、阴性对照组、Rev1 siRNA组),冰上裂解细胞并提取细胞的总蛋白,二喹啉甲酸(BCA)蛋白定量试剂盒测定所提取的蛋白浓度。10% SDS-PAGE凝胶电泳80~120 V、3 h分离蛋白,350 mA湿转至0.2 μm聚偏二氟乙烯(PVDF)膜,用5%脱脂奶粉室温封闭1.5 h,一抗Rev1(1 :1 000),4℃摇床孵育过夜,磷酸缓冲盐溶液(PBS)洗膜3次后加入辣根过氧化物酶(HRP)标记的二抗(1 :10 000),室温孵育1.5 h,后PBS洗膜3次。用化学发光(ECL)试剂增强反应,机器曝光。每个样本至少重复3次。运用Image Lab图像分析软件计算条带灰度值。蛋白相对表达采用目的蛋白与GAPDH灰度比值来表示。
6.MTT法测定X射线对不同实验组细胞增殖的影响:取对数生长期的THC8307细胞,细胞分3组,即空白对照组、阴性对照组、Rev1 siRNA组,后进行相应处理,24 h后分别进行胰酶消化,调整细胞至104/孔(100 μl),接种到96孔细胞培养板中培养24 h。给予6 Gy X射线照射各组细胞,每组细胞设4个平行孔,同时设置4个空白孔(完全培养基加MTT,无细胞),照射后继续培养,酶联免疫检测仪上检测照射后的不同时段(0、24、48、72、96 h)的吸光度(A)值,取4个复孔的平均A值,每组重复3次,存活率(%)=(处理组A值/对照组A值)×100%。
7.Western blot检测细胞PCNA、γ-H2AX、P53、Bax、Bcl-2蛋白的表达:0、6 Gy处理各组细胞48 h后,收集各组细胞(空白对照组、阴性对照组、Rev1 siRNA组),冰上裂解细胞并提取总蛋白,BCA试剂盒测定其浓度。10% SDS-PAGE凝胶电泳80~120 V、1h分离蛋白质,350 mA湿转至0.2 μm PVDF膜,用5%脱脂奶粉室温封闭1.5 h,一抗γ-H2AX、P53、Bax、Bcl-2(1 :1 000),4℃摇床孵育过夜,PBS洗膜3次后,加入HRP标记的二抗(1 :10 000),室温孵育1.5 h,PBS洗膜3次。用ECL试剂增强反应,机器曝光。每个样本至少重复3次。运用Image Lab图像分析软件计算条带的灰度值。蛋白相对表达采用目的蛋白与GAPDH灰度比值来表示。
8.流式细胞术检测细胞的凋亡:0、6 Gy处理细胞(空白对照组、阴性对照组、Rev1 siRNA组),48 h后,收集各组细胞,并依据Annexin V-FITC/PI双染细胞凋亡检测试剂盒操作说明并进行染色,迅速用流式细胞仪进行凋亡率的检测,后对结果进行分析。
9.集落形成实验检测细胞存活率:取对数生长期的THC8307细胞,细胞分3组(空白对照组、阴性对照组、Rev1 siRNA组),24 h后分别进行胰酶消化,调整细胞至2 000/孔接种到6孔板中培养24 h。分别给予0、6 Gy X射线照射各组细胞,每组细胞设3个平行孔,照射后继续培养10~14 d,待肉眼可见克隆时终止培养,弃培养基,PBS洗3遍,甲醇固定30 min,吸去甲醇后晾干,加入0.1%结晶紫染液,染色1 h,后流水冲洗,晾干。将6孔板倒置并覆盖一张带网格的透明胶片,低倍镜下计数≥50个细胞的集落数。根据公式计数集落形成率和细胞存活率。集落形成率(PE,%)=(集落数/接种细胞数)×100%。存活分数(SF)=某剂量照射后的细胞集落数/(该组接种细胞数×PE)。
10.统计学处理:应用SPSS 20.0统计软件进行数据处理,符合正态分布的计量资料以x±s表示,所有实验独立重复≥3次。两组比较采用独立样本t检验。P<0.05为差异有统计学意义。
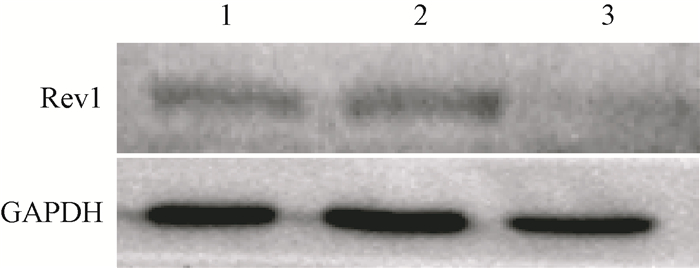
结果1.Real-time PCR和Western blot检测Rev1 mRNA及蛋白的表达:结果显示,Rev1干扰片段转染THC8307细胞后,Rev1 siRNA组细胞中Rev1基因mRNA的表达量和Rev1蛋白表达量明显低于空白对照组和阴性对照组(t=24.68、4.93,P < 0.05)。表明在mRNA和蛋白水平上Rev1基因成功被沉默(图 1,表 1)。
|
图 1 Western blot检测Rev1蛋白的表达 注:1.空白对照组;2.阴性对照组;3. Rev1 siRNA组 Figure 1 Expression of Rev1 protein detected by Western blot |
|
|
表 1 Real-time PCR和Western blot检测Rev1 mRNA及蛋白的相对表达量(x±s) Table 1 Relative expression levels of Rev1 mRNA and protein detected by Real-time PCR and Western blot, respectively(x±s) |
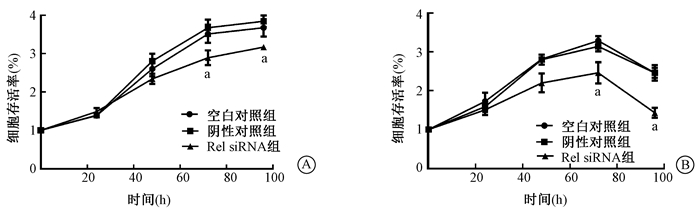
2.MTT检测不同处理组细胞的增殖情况:0、6 Gy X射线处理各组细胞后,MTT检测不同时段(0、24、48、72、96 h)细胞的增殖。结果显示,随着时间的增加,Rev1基因沉默组与空白对照组相比,THC8307细胞增殖的速率明显降低,尤其在72、96 h,与空白对照组和阴性对照组相比,差异具有统计学意义(t=3.55、3.63、4.82、7.53,P < 0.05,图 2)。
|
图 2 MTT检测THC8307在不同剂量射线照射后细胞的存活率A.0 Gy;B.6 Gy 注:a与同一时间空白对照组相比,t=3.55、3.63、4.82、7.53,P < 0.05 Figure 2 MTT assay of cell viability under different doses of irradiation A. 0 Gy; B. 6 Gy |
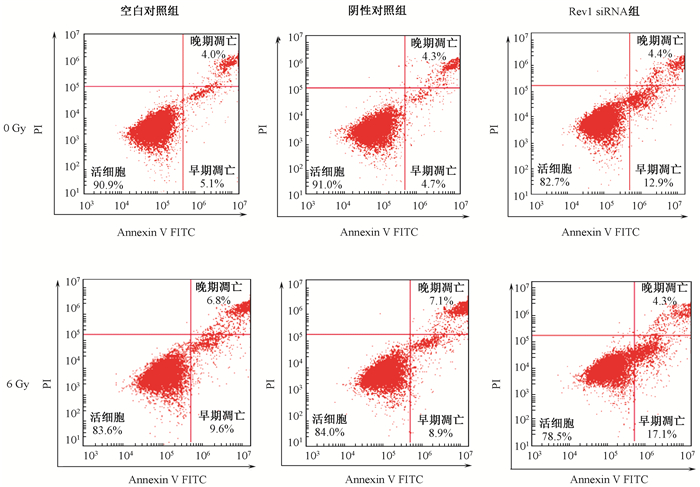
3.流式细胞仪分析不同处理组细胞的凋亡率:结果显示,在0、6 Gy X射线处理后,与空白对照组和阴性对照组相比,沉默Rev1组凋亡率明显增高。且6 Gy照射各组细胞凋亡率均明显高于0 Gy的相应各组(图 3,表 2)。
|
图 3 流式细胞仪分析不同剂量照射后3组细胞的凋亡率 Figure 3 The flow cytometry analysis of apoptosis rate of three groups of cells after different doses of irradiation |
|
|
表 2 流式细胞仪检测不同射线剂量处理THC8307后细胞的凋亡率(%,x±s) Table 2 The apoptosis rate of THC8307 cells after different doses of irradiation(%, x±s) |
4.集落形成实验检测细胞存活率:结果显示,在0、6 Gy X射线照射后,与空白对照组和阴性对照组相比,沉默Rev1组细胞存活分数明显降低。且6 Gy照射各组细胞存活分数均明显低于0 Gy的相应各组(表 3)。
|
|
表 3 0、6 Gy X射线照射下THC8307不同分组的集落形成率及细胞存活率(%,x±s) Table 3 The colony formation and cell survival fraction of different groups of THC8307 cells after 0 and 6 Gy of X-ray radiation(%, x±s) |
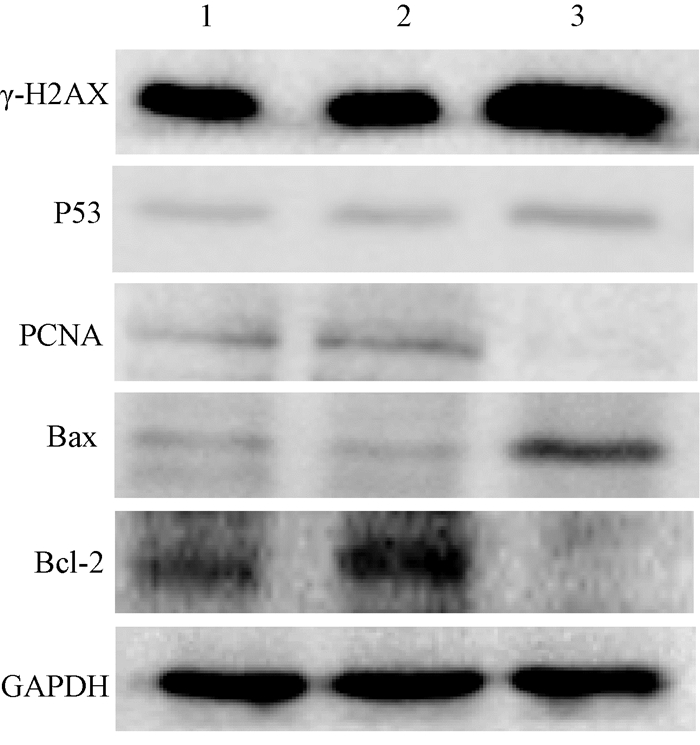
5.Western blot检测各组细胞γ-H2AX、P53、PCNA、Bax、和Bcl-2的蛋白表达:结果显示,6 Gy X射线处理下,沉默Rev1组细胞的γ-H2AX、P53、Bax蛋白表达水平较空白对照组和阴性对照组均升高,而PCNA、Bcl-2蛋白表达下降(表 4,图 4)。
|
|
表 4 6 Gy剂量照射后各组细胞中γ-H2AX、P53、PCNA、Bax和Bcl-2的蛋白相对表达量(x±s) Table 4 Relative expression levels of γ-H2AX, P53, PCNA, Bax and Bcl-2 in each group of cells after 6 Gy irradiation(x±s) |
|
图 4 3组细胞中γ-H2AX、P53、PCNA、Bax和Bcl-2的蛋白表达 注:1.空白对照组;2.阴性对照组;3. Rev1 siRNA组 Figure 4 The protein expressions of γ-H2AX, P53, PCNA, Bax and Bcl-2 in three groups of cells |
讨论
本研究采用RNAi技术,成功将人高分化结肠癌细胞系THC8307中Rev1基因沉默。不同时段MTT实验结果显示, 与空白对照组相比,Rev1 siRNA组增殖速率明显缓慢,尤其在48 h后,这种抑制效果更加明显。这也提示沉默Rev1基因可抑制人高分化结肠癌细胞THC8307的增殖。随后采用流式细胞术检测沉默Rev1基因对THC8307凋亡的影响。结果显示, 与对照组相比,Rev1 siRNA组细胞总凋亡率明显增高, 提示沉默Rev1基因可促进THC8307的凋亡。这与文献报道的沉默Rev3(参与跨损伤DNA合成修复的聚合酶)后,促进结肠癌细胞凋亡的结论一致[7]。采用6 Gy X射线照射3组细胞后, 不同时段MTT实验观察细胞增殖情况,结果显示, 3组细胞在0~72 h增殖速率的增加逐渐减慢,72 h后,增殖速率突然下降;与空白对照组相比,增殖速率增加明显减慢,下降速率明显加快。流式细胞术检测凋亡结果显示,与空白对照组相比,Rev1 siRNA组细胞总凋亡率明显增高。组间比较结果显示,3组细胞分别在0、6 Gy处理后,均表现为抑制增殖,促进凋亡。最后,通过集落形成实验,进一步检测不同射线处理后各组细胞的存活率,发现6 Gy射线处理后,Rev1 siRNA组细胞存活分数明显低于空白对照组。结合MTT实验结果,得出结论,沉默Rev1后,在X射线作用下,可以明显抑制THC8307细胞的短期增殖和长期增殖。以上结果提示,沉默Rev1联合X射线能对肿瘤细胞最大程度地杀伤,同时也说明,在相同剂量的X射线作用下,沉默Rev1可明显增加结肠癌细胞THC8307X的放射敏感性。
国内外研究表明,细胞内的30多亿的碱基对中,仅需几个DNA双链断裂即可激活共济失调-毛细血管扩张症突变基因(ATM)蛋白激酶信号通路[8]。电离辐射(如X射线)损伤DNA双链后,激活了ATM,激活后的ATM随即作用下游信号分子,如H2AX,促进其磷酸化,变为γ-H2AX[9]。此时的γ-H2AX在断裂的DNA双链处聚集,形成“核灶”,起到固定DNA双链断裂的作用,同时招募大量修复相关因子参与损伤修复。H2AX磷酸化的“核灶”几乎与DNA双链断裂是1:1的数量关系,这也让其成为检验DNA双链断裂的“金标准”[10]。本研究中,Western blot结果显示,6 Gy处理3组细胞后,沉默Rev1组比对照组的γ-H2AX表达量明显升高,提示Rev1基因沉默后,加剧了DNA双链断裂的积累。考虑到同源重组是修复DNA双链断裂的重要通路,Rev1蛋白又是参与同源重组修复的重要因子,所以认为在6 Gy X射线作用后,γ-H2AX的升高是由于沉默了Rev1,进而抑制了同源重组修复,使得修复DNA双链断裂的效率降低,断裂的DNA双链积累,造成了γ-H2AX的增加。
P53蛋白是一个众所周知的转录因子,与细胞的增殖、凋亡、周期等均有密切的关系[11]。本研究中Western blot结果显示, 6 Gy X射线照射下,沉默Rev1基因后,Rev1 siRNA组与对照组相比,P53表达升高。其下游促凋亡蛋白Bax表达升高,抑凋亡蛋白Bcl-2表达降低。同时增殖细胞核抗原(PCNA)表达降低。这提示P53可能在参与细胞凋亡中起到了关键作用。国外研究表明,Rev1是肿瘤抑制因子P53的新型结合伴侣并调节其活性。在饥饿状态下促进Rev1的类泛素化(SUMO)化,使得其与P53分离,减轻了P53反式激活的Rev1依赖性抑制[12]。由此推测,P53的增高可能来自以下两方面的因素。第一,X射线作用细胞DNA产生了DNA双链断裂,沉默Rev1抑制了同源重组修复,DNA双链断裂修复亦受到抑制,这种“致命”的双链断裂损伤持续存在,增加了复制压力,机体便启动P53依赖的细胞凋亡模式;第二,Rev1对P53的反式激活作用。以上两种情况增加了P53的表达,同时作用于其下游基因Bax、Bcl-2,使得细胞凋亡增加。在6 Gy X射线作用后,沉默Rev1使得PCNA的表达量下降,这与观察到的细胞增殖减慢的现象一致。
近年来,放射治疗在肿瘤治疗中的地位日益凸显,放射治疗的核心问题是肿瘤的放射敏感性[13]。因此,预测个体肿瘤放射敏感性被认为是放射治疗中的“圣杯”。本研究发现,通过沉默Rev1基因可以提高结肠癌细胞系THC8307对X射线的敏感性。这与国外研究沉默Rev1提高HeLa细胞紫外辐射敏感性的结果一致[14]。也有文献表明,不同组织中Rev1表达量不同,如在睾丸、乳房中高表达,在胸腺、小肠中低表达,但总体表达量很低[15]。近来研究发现,Rev1单核苷酸多态性与宫颈癌预后有关[16]。人脑胶质瘤中,也发现了Rev1的高表达。Rev1与放、化疗的增敏均有关联,这些重要信息都意味着Rev1是一种肿瘤治疗及肿瘤预测的理想靶标。本研究发现,沉默Rev1提高了结肠癌细胞THC8307对X射线的放射敏感性,对临床治疗结肠癌也有了新的提示。其机制可能是沉默Rev1后,抑制了同源重组修复,增加了复制压力,激活抑癌基因P53,P53通过激活促凋亡蛋白Bax、抑凋亡蛋白Bcl-2促进细胞凋亡。另外抑制了增殖细胞核抗原(PCNA)的表达,抑制了细胞的增殖。当然,沉默Rev1后促进结肠癌细胞凋亡的更加具体的机制需后续不断地深入研究。
利益冲突 本研究还接受宁夏高等学校一流学科建设资助项目(NXYLXK2017B07)和宁夏医科大学优势学科利群项目(XY201607)资助。所有作者均无相关利益冲突,排名无争议,亦不存在影响实验研究结果的财务关系以及经费利益关系,在此对研究的独立性和科学性予以保证作者贡献声明 孔飞飞负责实验设计、数据整理及论文撰写;李元杰、马璐、隋御、折虹参与实验指导、技术支持;徐方负责并参与实验设计,在论文写作及修改过程中给予指导
| [1] |
Krishnamurty DM, Hawkins AT, Wells KO, et al. Neoadjuvant radiation therapy in locally advanced colon cancer:a cohort analysis[J]. J Gastrointest Surg, 2018, 22(5): 906-912. DOI:10.1007/s11605-018-3676-2 |
| [2] |
Langman G, Loughrey M, Shepherd N, et al. Association of Coloproctology of Great Britain & Ireland (ACPGBI):Guidelines for the management of cancer of the colon, rectum and anus (2017)-pathology standards and datasets[J]. Colorectal Dis, 2017, 19(Suppl 1): 74-81. DOI:10.1111/codi.13708 |
| [3] |
Osipov AN, Grekhova A, Pustovalova M, et al. Activation of homologous recombination DNA repair in human skin fibroblasts continuously exposed to X-ray radiation[J]. Oncotarget, 2015, 6(29): 26876-26885. DOI:10.18632/oncotarget.4946 |
| [4] |
Sharma S, Hicks JK, Chute CL, et al. REV1 and polymerase ζ facilitate homologous recombination repair[J]. Nucleic Acids Res, 2012, 40(2): 682-691. DOI:10.1093/nar/gkr769 |
| [5] |
Sasatani M, Xi Y, Kajimura J, et al. Overexpression of Rev1 promotes the development of carcinogen-induced intestinal adenomas via accumulation of point mutation and suppression of apoptosis proportionally to the Rev1 expression level[J]. Carcinogenesis, 2017, 38(5): 570-578. DOI:10.1093/carcin/bgw208 |
| [6] |
金君, 李坚, 袁荣霞. 共抑制Rad8和Rev1基因显著增加顺铂对肺癌细胞的毒性[J]. 江苏大学学报(医学版), 2018, 26(2): 109-116. Jin J, Li J, Yuan RX. Co-suppression the gene of RAD18 and REV1 increased the toxicity of cisplatin on lung cancer cells significantly[J]. J Jiangsu Univ (Med Edit), 2018, 26(2): 109-116. DOI:10.13312/j.issn.1671-7783.y170320 |
| [7] |
Li LJ, Sui Y, Zhong X, et al. Reversion of oxaliplatin resistance of colon carcinoma cells by REV3L gene interfering[J]. Basic Clin Med, 2012, 33(5): 542-547. DOI:10.1007/s11434-015-0788-x |
| [8] |
Khoronenkova SV, Dianov GL. ATM prevents DSB formation by coordinating SSB repair and cell cycle progression[J]. Proc Natl Acad Sci USA, 2015, 112(13): 3997-4002. DOI:10.1073/pnas.1416031112 |
| [9] |
Zhao H, Halicka HD, Garcia J, et al. ATM activation and H2AX phosphorylation induced by genotoxic agents assessed by flow-and laser scanning cytometry[J]. Methods Mol Biol, 2017, 1599: 183-196. DOI:10.1007/978-1-4939-6955-5_14 |
| [10] |
Sak A, Stuschke M. Use of γ-H2AX and other biomarkers of double-strand breaks during radiotherapy[J]. Semin Radiat Oncol, 2010, 20(4): 223-231. DOI:10.1016/j.semradonc.2010.05.004 |
| [11] |
Horn HF, Vousden KH. Coping with stress:multiple ways to activate p53[J]. Oncogene, 2007, 26(9): 1306-1316. DOI:10.1038/sj.onc.1210263 |
| [12] |
Shim HS, Wei M, Brandhorst S, et al. Starvation promotes REV1 SUMOylation and p53-dependent sensitization of melanoma and breast cancer cells[J]. Cancer Res, 2015, 75(6): 1056-1067. DOI:10.1158/0008-5472.CAN-14-2249 |
| [13] |
Pavlopoulou A, Bagos PG, Koutsandrea V, et al. Molecular determinants of radiosensitivity in normal and tumor tissue:A bioinformatic approach[J]. Cancer Lett, 2017, 403: 37-47. DOI:10.1016/j.canlet.2017.05.023 |
| [14] |
Yang Y, Liu Z, Wang F, et al. FANCD2 and REV1 cooperate in the protection of nascent DNA strands in response to replication stress[J]. Nucleic Acids Res, 2015, 43(17): 8325-8339. DOI:10.1093/nar/gkv737 |
| [15] |
Sasatani M, Xi Y, Kajimura J, et al. Overexpression of Rev1 promotes the development of carcinogen-induced intestinal adenomas via accumulation of point mutation and suppression of apoptosis proportionally to the Rev1 expression level[J]. Carcinogenesis, 2017, 38(5): 570-578. DOI:10.1093/carcin/bgw208 |
| [16] |
He X, Ye F, Zhang J, et al. REV1 genetic variants associated with the risk of cervical carcinoma[J]. Eur J Epidemiol, 2008, 23(6): 403-409. DOI:10.1007/s10654-008-9251-5 |
 2018, Vol. 38
2018, Vol. 38


