氡是由放射性元素镭衰变产生的自然界中唯一的天然放射性惰性气体,无色无味。氡及其子体已成为仅次于吸烟的第二大肺癌相关的致癌因子,国际癌症研究机构已将氡及其子体划归为Ι类致癌因素。氡主要通过吸入在肺部沉积对机体产生持续性、累积性作用,对人体健康的影响主要是其短寿命子体α粒子内照射对机体的损伤作用。氡经呼吸作用进入血液循环扩散至全身,对机体形成内照射。虽然外周血中淋巴细胞大部分处于高度分化和不增殖状态,但对电离辐射极其敏感,且部分淋巴细胞在受抗原刺激时可母细胞化,而获得增殖功能。近年来,温泉洗浴过程中的氡暴露对人体健康的影响受到越来越多的关注。为了进一步探索居民氡暴露对人体健康的影响,本研究对氡温泉周围居民外周血淋巴细胞周期变化和周期调控蛋白的表达情况进行检测分析。
资料与方法1.研究地区背景:平山温泉位于河北省平山县温塘镇,温泉水中氡离子浓度为(102±11.4)Bq/L,室内(非温泉洗浴房间)氡离子浓度6个月均值为(41.9±18.6)Bq/m3,平衡因子的典型值为0.61。当打开淋浴喷头后,室内氡浓度由平时的本底值( < 50 Bq/m3)急速增高至200 Bq/m3以上,超过我国室内氡浓度指导行动水平(200 Bq/m3)和世界卫生组织(WHO)建议的室内氡浓度限值(100 Bq/m3),约经过3 h后,房间内的氡浓度逐渐恢复到本底水平,所造成的附加年有效剂量约为0.09 mSv。氡子体浓度的变化与氡浓度的变化一致[1]。对照地区室内氡浓度的本底值参照石家庄室内年均值42.4 Bq/m3[2],两地区室内氡浓度的本底值基本一致。
2.研究对象:本研究选择平山县温塘镇经常温泉洗浴的现住居民作为氡温泉组选择对象,选取生活习惯相似,但未接触氡温泉的平山县回舍镇现住居民作为对照组选择对象。纳入标准为本村镇居住15年以上且期间无迁徙史,近期无病毒、细菌感染史,无恶性肿瘤、严重慢性病、急性感染性疾病史,无严重烟草依赖、过度饮酒史,半年内未接受X射线暴露。氡温泉组采用简单随机抽样方法抽取氡温泉周边居民46人,其中男性20人,女性26人,平均年龄为(44.1±8.7)岁。同样方法抽取对照组居民39人,其中男性18人,女性21人,平均年龄为(51.1±10.3)岁。本研究通过了伦理审查委员会审查,全部研究对象均签署知情同意书。
3.主要仪器和试剂:FACS Aria流式细胞仪为美国BD公司产品,Milli-Q纯水仪和超纯水净化系统为美国Millipore公司产品。破膜固定液试剂盒购自美国BD公司,淋巴细胞分离液购自美国GE Healthcare公司,4%多聚甲醛购自北京索莱宝公司,Cdk6抗体、CyclinD1抗体、CyclinE1抗体(Alexa Fluor 647)、Anti-CDK1抗体(FITC)均购自美国Abcam公司,CDK4抗体和CDK2抗体(PE Conjugate)、CDC25A抗体、IgG抗体(H+L) (Alexa Fluor 488 Conjugate)、WEE1抗体(PE Conjugate)均购自美国CST公司,FxCycle PI/RNase染液购自美国Life公司。
4.流式细胞术检测外周血淋巴细胞周期:乙二胺四乙酸二钠(EDTA)抗凝真空采血管收集肘部外周静脉血,并分离得到淋巴细胞,70%的预冷乙醇固定淋巴细胞4℃过夜,洗涤去除固定液后加入FxCycle PI/RNase染液重悬细胞室温避光孵育30 min,经尼龙网过滤上机检测。ModFIT3.0检测细胞周期进程中各时相所占比例情况。
5.流式细胞术检测外周血淋巴细胞周期调控蛋白:同方法4收集到淋巴细胞,4%多聚甲醛固定淋巴细胞4℃保存。洗涤去除固定液后,用破膜固定液重悬细胞,室温避光20 min后,离心半径147 mm, 1 500 r/min离心10 min,弃上清,1×透化/洗液重悬细胞,室温避光10 min后,离心半径147 mm, 1 500 r/min离心10 min,弃上清,加入0.5 μl抗体,4℃避光孵育30 min,1×透化/洗液洗涤后,经尼龙网过滤上机检测。DIVA 6.0软件检测分析周期调控蛋白表达水平。
6.统计学处理:采用SPSS 21.0统计分析软件,计量资料用x±s表示。采用独立样本资料t检验比较氡温泉组和对照组淋巴细胞中细胞周期各时相的差异,以及周期调控蛋白表达的差异,采用多重线性回归分析周期调控蛋白的差异性表达和居民氡暴露因素的关系。P < 0.05为差异有统计学意义。
结果1.氡温泉组和对照组细胞周期各时相变化情况:比较淋巴细胞在细胞周期各时相差异情况,结果列于表 1。在G0/G1期和S期,两组淋巴细胞所占比例的差异有统计学意义(t=2.250、-2.382,P <0.05),氡温泉组G0/G1期平均减少0.38%,而S期比例平均增加了0.39%。在G2/M期,氡温泉组淋巴细胞所占比例有所增加,但差异无统计学意义(P>0.05)。
|
|
表 1 对照组和氡温泉组不同细胞周期时相的比例(%,x±s) Table 1 Cell cycle distribution of the lymphocytes in the radon hot spring group and its control (%, x ±s) |
2.氡温泉组和对照组细胞周期调控蛋白的表达差异:细胞周期调控蛋白表达分析结果见图 1。CDK1、CDK6和CyclinE1在氡温泉组居民外周血淋巴细胞中的表达水平下调,且差异有统计学意义(t=4.770、11.419、5.238,P < 0.05),分别是对照组的67%、49%和80%。而CDK2、CDK4、CyclinD1、WEE1和CDC25A在氡温泉组表达均上调,但是与对照组相比,差异无统计学意义(P>0.05)。
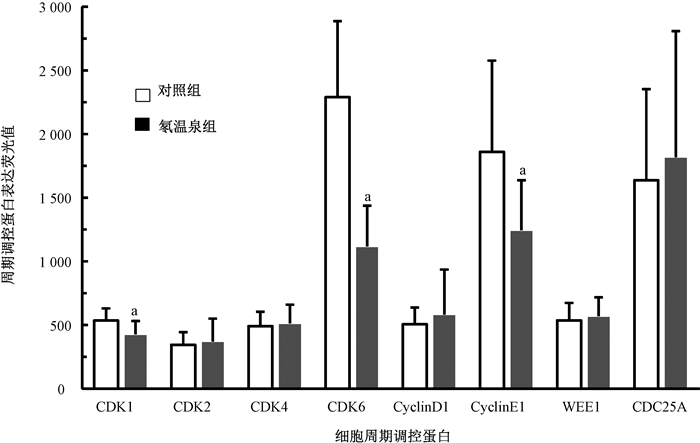
|
图 1 氡温泉组和对照组细胞周期调控蛋白的表达情况 注:a与对照组相比,t=4.770、11.419、5.238,P < 0.05 Figure 1 Expressions of cell cycle-related regulatory proteins in the lymphocytes of the radon hot spring group and its control |
3.淋巴细胞中周期调控蛋白表达相关因素的多重线性回归分析:选择氡暴露、年龄、性别、体质量指数(BMI)、血压、抽烟、饮酒等变量引入到多重线性回归方程,采用逐步筛选法进行回归分析,结果列于表 2。CDK1、CDK6和CyclinE1的差异性表达与居民氡暴露因素呈负相关(t=-5.097、-11.128、-5.117,P < 0.05),而且不受年龄、性别、BMI、血压、抽烟、饮酒等因素的影响(P>0.05)。
|
|
表 2 居民外周血淋巴细胞中周期调控蛋白表达相关因素的多重线性回归分析 Table 2 Multiple linear regression analysis of the factors related to the expressions of cell cycle regulatory proteins |
讨论
氡及其子体对人体健康的危害主要来自于其衰变产生的高能量α粒子,吸入体内后可对支气管和肺细胞形成高传能线密度(LET)照射,以电离的方式将大量的能量沉积在细胞中,破坏细胞内生物大分子的化学键[3],尤其是作用于细胞中的染色体后产生损伤,使细胞不能正常的增殖分裂。研究表明,氡温泉对周边居民外周血淋巴细胞和血浆中miRNAs表达有影响[4-5],miRNAs参与辐射诱导DNA损伤,尤其在调节细胞周期蛋白表达的过程中发挥重要作用,进而影响细胞周期的进程。本研究为了进一步探索氡暴露对健康影响及其可能的机制,对氡温泉周边居民外周血淋巴细胞周期及其相关调控蛋白CDK1、CDK2、CDK4、CDK6、CyclinD1、CyclinE1、WEE1、CDC25A表达水平进行检测分析。
本研究发现,氡温泉组的淋巴细胞在G0/G1期和S期所占比例与对照组不一致。结果显示,处于G0/G1期细胞所占比例明显减少,处于S期的细胞所占比例显著增加。然而作为对电离辐射最敏感的细胞,淋巴细胞属于高度分化和不增殖细胞,大部分处于G0/G1期。尽管本研究中G0/G1期和S期所占比例的变化具有统计学意义,但是变化量所占比例还很低,尚不能认为氡温泉组外周血淋巴细胞出现了S相延迟。S期是DNA合成期,除了合成DNA外,同时还要合成组蛋白以及DNA复制所需要的酶。S期细胞数量的增加提示在长期氡暴露条件下,DNA损伤可能已经出现并在一定程度上限制了DNA合成的进程。可能是通过机体的调节和修复机制,使机体在一定的暴露剂量范围内产生反应并形成了新的平衡,但这需要进一步的实验予以验证。温泉氡属于低剂量高LET辐射,Chauhan等[6-7]认为高LET辐射可能激活与低LET辐射不同的生物效应途径,通路分析显示α粒子辐射可影响细胞周期阻滞、DNA复制与损伤修复等功能。
电离辐射引起的细胞周期进程的变化是一个复杂的调节过程,针对DNA不同的损伤类型会激活不同的调控通路。microRNA在细胞周期进程中通过调节周期相关蛋白的表达发挥作用。研究表明,miR-449a和miR-34b可负调控CDK6的表达[8-9]。本研究发现,CDK6在氡温泉组淋巴细胞中的表达水平显著下调,而刘春旭等[4]在同一地区氡温泉研究发现miR-449a在氡温泉组的表达水平明显上调;秦宏冉等[10]对降扎温泉的研究发现高氡暴露引起了miR-34b表达明显升高。也就是说,氡暴露引起的miR-449a和miR-34b的上调降低了CDK6的表达水平,与Lizé等[8]和Yang等[9]的研究结果一致。
研究表明,miR-16可负调控CDK1的表达[11],同时还调节细胞周期相关基因CyclinD1和CyclinE1表达[12]。本研究发现,CyclinE1、CDK1在氡温泉组淋巴细胞中的表达水平显著下调,而且刘春旭等[6]对该地区氡温泉研究发现,miR-16在氡温泉组血浆中的表达水平显著上调。氡暴露引起的miR-16的上调降低了CyclinE1和CDK1的表达水平,与Takeshita等[11]和Pothof等[12]研究结果一致。
WEE1、CDK2和CyclinD1的表达在两组中没有差异,但有研究认为miR-16可以负调控WEE1[13]和CDK2[11]的表达,并且对CyclinD1[14]的表达起调节作用。调节细胞周期进程中相关调控蛋白的表达是一个多通路多步骤复杂的生物学过程,是否有调控WEE1、CDK2和CyclinD1表达的其他通路共同参与有待进一步研究。
将氡暴露、年龄、性别、BMI、血压、抽烟、饮酒等因素引入多重线性回归分析发现,CDK1、CDK6和CyclinE1的差异性表达与居民氡暴露因素呈负相关,而与年龄、性别、BMI、血压、抽烟、饮酒等因素并不存在显著的相关关系。氡暴露是CDK1、CDK6和CyclinE1差异性表达最主要的影响因素。
综上所述,氡温泉组居民外周血淋巴细胞周期进程中G0/G1期和S期所占比例发生了变化,细胞周期调控蛋白CDK1、CDK6和CyclinE1的表达水平显著下调,且与其上游调控因子miRNAs受到辐射损伤时表达机制相协调。该地区的氡暴露可能引起机体的辐射损伤效应,但是其影响程度及具体的效应机制还有待于进一步的研究。
利益冲突 无作者贡献声明 高延晓负责现场样本采集、实验室样本处理、数据整理分析和论文撰写;田梅和高刚负责研究思路、研究方案、实验技术指导和指导论文修改;阮健磊、朴春南和吴丽娜负责现场调查、样本采集和实验操作指导;刘建香负责提出研究思路和指导论文写作
| [1] |
赵孟奇, 崔宏星, 尚兵, 等. 河北平山温泉氡水平与剂量贡献[J]. 中国辐射卫生, 2012, 21(1): 30-32. Zhao MQ, Cui HX, Shang B, et al. Radon levels and dose contributions in Pingshan hot springs, Hebei province[J]. Chin J Radiol Health, 2012, 21(1): 30-32. DOI:10.13491/j.cnki.issn.1004-714x.2012.01.004 |
| [2] |
周开建, 赵智慧, 张京战, 等. 石家庄地区居室内氡浓度调查及影响因素分析[J]. 辐射防护, 2010, 30(5): 312-315. Zhou KJ, Zhao ZH, Zhang JZ, et al. Indoor radon concentration survey and influencing factors in Shijiazhuang area[J]. Radiat Prot, 2010, 30(5): 312-315. |
| [3] |
白玉书, 陈德清, 刘建香, 等. 人类辐射细胞遗传学[M]. 北京: 人民卫生出版社, 2006. Bai YS, Chen DQ, Liu JX, et al. Human radiation cytogenetics[M]. Beijing: People's Medical Publishing House, 2006. |
| [4] |
刘春旭, 李小亮, 潘艳, 等. 某氡温泉周边居民外周血淋巴细胞中miRNAs的表达[J]. 癌变·畸变·突变, 2015, 27(6): 446-449. Liu CX, Li XL, Pan Y, et al. Expression of miRNAs in peripheral blood lymphocytes of the residents around hot springs with radon[J]. Carcin Teratogen Mut, 2015, 27(6): 446-449. DOI:10.3969/j.issn.1004-616x.2015.06.008 |
| [5] |
刘春旭, 田梅, 潘艳, 等. 某氡温泉周边居民外周血血浆中miRNAs的表达[J]. 中华放射医学与防护杂志, 2015, 35(3): 187-190. Liu CX, Tian M, Pan Y, et al. Expression of miRNAs in peripheral blood plasma of the residents surrounding hot springs with radon[J]. Chin J Radiol Med Prot, 2015, 35(3): 187-190. DOI:10.3760/cma.j.issn.0254-5098.2015.03.006 |
| [6] |
Chauhan V, Howland M, Wilkins R. Effects of α-particle radiation on microRNA responses in human cell-lines[J]. Open Biochem J, 2012, 6: 16-22. DOI:10.2174/1874091X01206010016 |
| [7] |
Chauhan V, Howland M, Mendenhall A, et al. Effects of alpha particle radiation on gene expression in human pulmonary epithelial cells[J]. Int J Hyg Environ Health, 2012, 215(5): 522-535. DOI:10.1016/j.ijheh.2012.04.004 |
| [8] |
Lizé M, Pilarski S, Dobbelstein M. E2F1-inducible microRNA 449a/b suppresses cell proliferation and promotes apoptosis[J]. Cell Death Differ, 2010, 17(3): 452-458. DOI:10.1038/cdd.2009.188 |
| [9] |
Yang F, Li H, Du Y, et al. Downregulation of microRNA-34b is responsible for the elevation of blood pressure in spontaneously hypertensive rats[J]. Mol Med Rep, 2017, 15(3): 1031-1036. DOI:10.3892/mmr.2017.6122 |
| [10] |
秦宏冉, 田梅, 高刚, 等. 异常高氡温泉周围居民外周血中肺癌相关基因和miRNA的表达[J]. 中华放射医学与防护杂志, 2012, 32(1): 31-34. Qin HR, Tian M, Gao G, et al. Expressions of lung cancer related genes and miRNA in peripheral blood of the residents surrounding hot springs with extremely high radon[J]. Chin J Radiol Med Prot, 2012, 32(1): 31-34. DOI:10.3760/cma.j.issn.0254-5098.2012.01.007 |
| [11] |
Takeshita F, Patrawala L, Osaki M, et al. Systemic delivery of synthetic microRNA-16 inhibits the growth of metastatic prostate tumors via downregulation of multiple cell-cycle genes[J]. Mol Ther, 2010, 18(1): 181-187. DOI:10.1038/mt.2009.207 |
| [12] |
Pothof J, Verkaik NS, van IJcken W, et al. MicroRNA-mediated gene silencing modulates the UV-induced DNA-damage response[J]. EMBO J, 2009, 28(14): 2090-2099. DOI:10.1038/emboj.2009.156 |
| [13] |
Lezina L, Purmessur N, Antonov AV, et al. miR-16 and miR-26a target checkpoint kinases Wee1 and Chk1 in response to p53 activation by genotoxic stress[J]. Cell Death Dis, 2013, 4(12). DOI:10.1038/cddis.2013.483 |
| [14] |
Liu Q, Fu H, Sun F, et al. miR-16 family induces cell cycle arrest by regulating multiple cell cycle genes[J]. Nucleic Acids Res, 2008, 36(16): 5391-5404. DOI:10.1093/nar/gkn522 |
 2018, Vol. 38
2018, Vol. 38


