2. 450052 郑州大学第一附属医院放疗科
2. Department of Radiotherapy, The First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China
手术治疗、放射治疗和化疗是目前子宫内膜癌的主要治疗方法,临床中放疗常易引起放射性直肠炎、膀胱炎和盆腔纤维化等不良反应,给患者增加了不同程度的损伤,提高子宫内膜癌细胞放射敏感性是目前研究的热点[1]。吴茱萸碱是石虎、吴茱萸等芸香科植物的果实,有保护肝胃、止痛等作用[2-4]。近年来研究表明,吴茱萸碱能够杀伤前列腺癌细胞、乳腺癌细胞、卵巢癌细胞,对肿瘤细胞的生长具有抑制作用[5-6]。de Boer等[7]研究表明,8 Gy的照射剂量能够有效地抑制子宫内膜癌细胞的生长。本研究通过体外细胞实验,探讨吴茱萸碱对子宫内膜癌细胞放射敏感性的影响,以期为治疗子宫内膜癌提供新思路。
材料与方法1.材料:人子宫内膜癌细胞Ishikawa、HEC-1A、AN3CA购自中国科学院细胞库;全细胞蛋白提取试剂盒购自美国Epigentek公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度检测试剂盒、活性氧(reactive oxygen species, ROS)检测试剂盒均购自美国Sigma公司;RPMI 1640培养基购自于美国GIBCO公司;Cleaved Caspase-3单克隆抗体、p38单克隆抗体、p-p38单克隆抗体均购自美国Peprotech公司;胎牛血清(FBS)购自于美国Hyclone公司;SAF-680T酶标仪购自于上海巴玖实业有限公司。
2.细胞培养:取出冻存在液氮灌中的子宫内膜癌细胞Ishikawa、HEC-1A、AN3CA,置于37℃的环境下融化细胞。在细胞中加入含有10% FBS的RPMI 1640细胞培养液,混合均匀后,离心半径5 cm,1 000 r/min离心10 min。弃上清液,加入5 ml的细胞培养液悬浮细胞,接种于细胞培养瓶中,置于37℃、5%CO2培养箱中培养48 h后,观察细胞融合度超过90%时,弃掉细胞培养液,加入0.25%的胰蛋白酶在37℃消化2 min,离心半径5 cm,1 000 r/min离心10 min,弃上清液,加入磷酸盐缓冲液(PBS)重悬洗涤细胞,用适量细胞培养液悬浮细胞,根据实验要求按照不同比例接种到细胞培养瓶中继续培养。
3.实验分组:细胞分为4组,分别为对照组、吴茱萸碱组、射线照射组和联合射线照射组。其中吴茱萸碱组和联合射线照射组用半数抑制浓度(IC50)的吴茱萸碱培养液培养HEC-1A细胞;射线照射组和联合射线照射组在培养至24 h后,将细胞照射8 Gy后继续培养24 h,照射条件:美国Varian直线加速器,置于室温下照射,源靶距为100 cm,12.5 cm×8.5 cm的照射面积;对照组和吴茱萸碱组不进行照射处理,对照组和射线照射组中不加入吴茱萸碱。各组细胞培养48 h后,加入四甲基偶氮唑盐(MTT)溶液10 μl(5 mg/ml),37℃培养4 h,加入10%FBS培养液100 μl振荡,置于酶标仪测定吸光度(A)值。计算细胞存活率,分析细胞增殖情况。
4. MTT检测吴茱萸碱对细胞增殖影响:收集处于对数生长期的HEC-1A细胞,调整细胞浓度为1×103/ml,接种于96孔细胞培养板中过夜培养,将细胞培养液更换为含有1、2、4、8 μmol/L的吴茱萸碱细胞培养液培养24、48、72、96 h,每组设置5个复孔,实验重复3次,同时设置0 μmol/L的吴茱萸碱细胞培养液为对照,不加入细胞的组为空白组。加入MTT溶液10 μl(5 mg/ml),37℃培养4 h,加入10%FBS培养液100 μl振荡,待沉淀完全溶解后置于酶标仪测定吸光度(A)值,计算细胞存活率。82798-IC50软件计算半数抑制浓度。实验重复3次,取均值。细胞存活率=100 %×(实验组A值-空白组A值)/(对照组A值-空白组A值)。
5.流式细胞术检测细胞凋亡:取对照组、吴茱萸碱组、射线照射组和联合射线照射组细胞,按照上述方法处理48 h后,用胰蛋白酶消化各组细胞后,收集106个细胞,加入200 μl缓冲液重悬细胞,并加入碘化丙啶(PI)和膜联蛋白V-FITC(Annexin V-FITC)各5 μl,放在避光条件下孵育反应20 min后,加入结合缓冲液400 μl,流式细胞仪检测细胞凋亡。实验重复3次,提高实验准确性。同时在吴茱萸碱组细胞中添加15 μmol/L的p38MAPK特异性抑制剂SB203580作为吴茱萸碱+p38抑制剂组,测定细胞凋亡情况。实验重复3次,取均值。
6.细胞克隆实验检测细胞放射敏感性:取对数生长期的HEC-1A细胞,并将细胞浓度调整为1×106/孔,将其接种到6孔培养板中过夜培养。随后将细胞分别照射0、2、4、6、8、10 Gy。将细胞放在含有10%FBS的培养皿中进行培养,12 d后用冷甲醇固定,姬姆萨溶液染色30 min。计数所形成的细胞集落>50个时为有效菌落。根据单击多靶模型拟合细胞存活曲线,计算放射增敏比。实验重复3次,取均值。克隆形成率(PE)=100%×克隆数/接种细胞数;存活分数(SF)=100%×受照射细胞克隆形成率/对照细胞克隆形成率。
7.细胞内ROS水平检测:取对照组、吴茱萸碱组、射线照射组和联合射线照射组培养48 h后,按照ROS水平检测试剂盒检测细胞内的ROS水平。实验重复3次,取均值。
8. Western blot检测细胞中Cleaved Caspase-3、p38、p-p38水平:取对照组、吴茱萸碱组、射线照射组和联合射线照射组培养48 h后,收集各组细胞,按照细胞蛋白提取试剂盒说明书提取细胞中的总蛋白,按照BCA蛋白含量测定试剂盒说明书操作测定蛋白含量。以4 :1的比例将蛋白样品与5×上样缓冲液充分混合,100℃煮沸5 min,用12%分离胶和5%的浓缩胶进行电泳检测。初始电压用40 V,待溴酚蓝进入分离胶后,将电压调整到90 V,观察Marker迁移至分离胶底部时终止电泳。取出凝胶洗涤,在4℃环境中转膜90 min,用5%脱脂奶粉封闭2 h后,加入500倍稀释的一抗4℃孵育过夜,与2 000倍稀释的二抗室温孵育1 h。滴加显色液,自动电泳凝胶成像系统采集图像,以GAPDH为内参,Image J分析条带灰度值,用目的蛋白灰度值与GAPDH灰度值的比值表示蛋白表达水平。实验重复3次,取均值。
9.统计学处理:数据采用SPSS 21.0软件进行分析,计量资料用 x±s表示,所有数据符合正态分布,方差齐性,多组差异比较采用单因素方差分析,组间比较采用LSD-t检验。P < 0.05为差异有统计学意义。
结果1.吴茱萸碱对细胞增殖影响结果:细胞增殖结果列于表 1,吴茱萸碱能够抑制人子宫内膜癌细胞的增殖。计算48 h吴茱萸碱对人子宫内膜癌细胞Ishikawa、HEC-1A、AN3CA半数抑制浓度IC50依次为(8.32±0.95)、(3.98±0.84)、(4.78±0.64)μmol/L,吴茱萸碱对HEC-1A细胞抑制生长作用最强,后续实验选用4 μmol/L的吴茱萸碱作用于HEC-1A细胞。
|
|
表 1 吴茱萸碱作用后人子宫内膜癌细胞的存活率(%,x±s) Table 1 Survival rate of human endometrial carcinoma cells after administration with evodiamine(%, x±s) |
2.吴茱萸碱联合射线照射对细胞增殖及凋亡影响结果:流式细胞术检测各组细胞凋亡情况,MTT检测各组细胞存活情况,结果如图 1和表 2所示,吴茱萸碱作用后和射线照射处理后的细胞凋亡增多,细胞存活率下降;而吴茱萸碱联合射线照射作用后的细胞总凋亡率较单纯射线照射后细胞总凋亡率更高,细胞存活率更低。提示吴茱萸碱能够协同射线照射促进HEC-1A细胞凋亡,抑制HEC-1A细胞增殖。
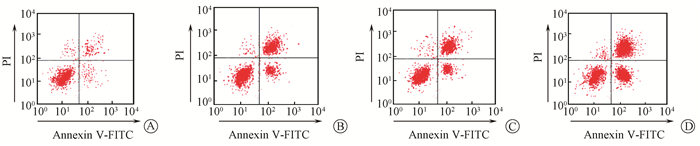
|
图 1 4 μmol/L的吴茱萸碱联合8 Gy X射线照射对细胞凋亡影响结果 A.对照组;B.吴茱萸碱组;C.射线照射组;D.联合射线照射组 Figure 1 Cellular apoptosis induced by 4 μmol/L evodiamine and 8 Gy X-ray irradiation A. Control group; B. Evodiamine group; C. Irradiation group; D. Combination group of radiation and evodiamine |
|
|
表 2 吴茱萸碱联合8 Gy X射线照射后细胞存活率及细胞总凋亡率(%,x±s) Table 2 Cell survival rate and total apoptosis rate after 8 Gy X-ray irradiation(%, x±s) |
3.放射敏感性检测:细胞克隆实验检测细胞存活分数,绘制细胞存活曲线,如图 2所示,吴茱萸碱联合放射处理后的HEC-1A细胞存活分数降低,从表 3可以看出,吴茱萸碱能够增加HEC-1A细胞的放射敏感性,增敏比为1.628。
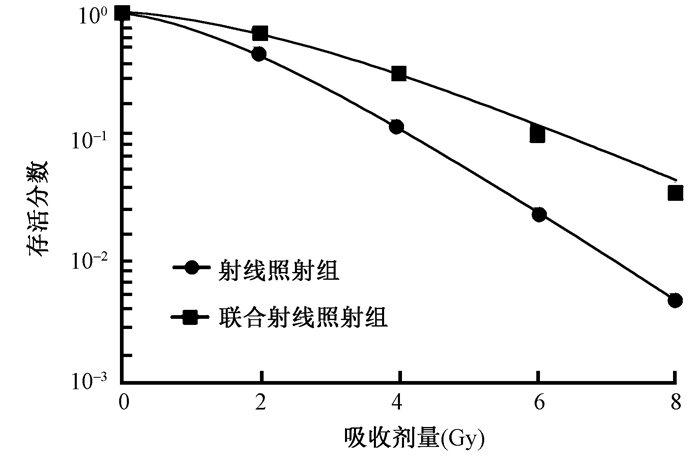
|
图 2 吴茱萸碱对HEC-1A细胞存活曲线的影响 Figure 2 Effect of evodiamine on HEC-1A cell survival |
|
|
表 3 单击多靶模型参数值 Table 3 The parameter values of cell survival curve fitted by the multi-target model |
4.吴茱萸碱联合射线照射对细胞中ROS的影响:荧光强度越高表示细胞中ROS水平越高。对照组、吴茱萸碱组、射线照射组、联合射线照射组细胞荧光强度分别为:25.34±3.24、40.61±4.61、49.84±4.54、63.54±5.29(F=38.476,P < 0.05)。吴茱萸碱组、射线照射组、联合射线照射组细胞中荧光强度高于对照组(t=4.173、6.695、10.439,P < 0.05),吴茱萸碱和射线照射共同作用后的HEC-1A细胞较单纯射线照射作用后细胞中ROS水平升高(t=3.744、6.266,P < 0.05)。说明吴茱萸碱能够促进射线照射诱导的HEC-1A细胞中ROS水平升高。
5.细胞中Cleaved Caspase-3、p38、p-p38水平检测结果:Western blot检测各组细胞中Cleaved Caspase-3、p38、p-p38表达水平。结果如图 3和表 4所示,吴茱萸碱组、射线照射组、联合射线照射组细胞中Cleaved Caspase-3、p-p38表达水平升高,并且吴茱萸碱联合射线照射后细胞中Cleaved Caspase-3、p-p38表达水平高于单纯射线照射作用后的细胞。
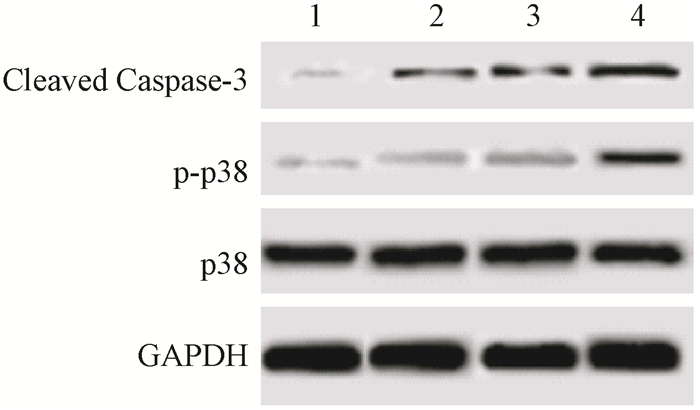
|
图 3 4 μmol/L吴茱萸碱联合8 Gy X射线照射对细胞中Cleaved Caspase-3、p38、p-p38水平的影响 1.对照组;2.吴茱萸碱组;3.射线照射组;4.联合射线照射组 Figure 3 Effect of 4 μmol/L evodiamine and 8 Gy X-ray irradiation on the expressions of Cleaved Caspase-3, p38, and p-p38 in HEC-1A cells |
|
|
表 4 4 μmol/L吴茱萸碱联合8 Gy X射线照射后细胞中Cleaved Caspase-3、p38、p-p38相对表达水平(x±s) Table 4 The relative expression levels of Cleaved Caspase-3, p38 and p-p38 in the cells administrated with 4 μmol/L evodiamine and 8 Gy X-ray irradiation(x±s) |
6.抑制p38后对细胞凋亡的影响:吴茱萸碱组、吴茱萸碱+p38抑制剂组细胞凋亡率分别为(35.25±2.47)%和(18.62±1.73)%。p38抑制剂和吴茱萸碱共同处理后的细胞凋亡率用流式细胞仪检测。结果如图 4所示,吴茱萸碱+p38抑制剂组细胞凋亡率明显低于吴茱萸碱组(t=9.552,P < 0.05)。抑制p38可以降低吴茱萸碱诱导的子宫内膜癌细胞凋亡。
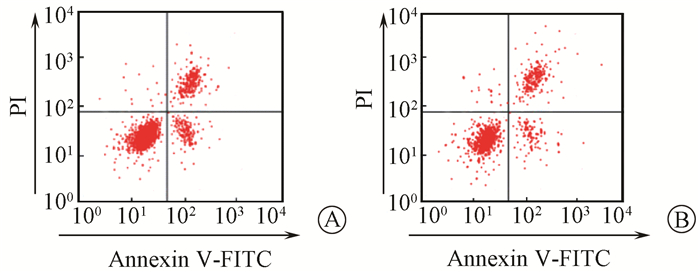
|
图 4 流式细胞术检测p38抑制剂对细胞凋亡影响 A.吴茱萸碱组;B.吴茱萸碱+p38抑制剂组 Figure 4 Effect of apoptosis with p38 inhibitor by flow cytometry A. Evodiamine group; B. Evodiamine+p38 inhibitor group |
讨论
吴茱萸碱是一种生物碱,具有抗炎、减肥、调节血压、镇痛、调节免疫力等作用。吴茱萸碱对肺癌等多种肿瘤细胞的增殖具有抑制作用[8]。研究显示,吴茱萸碱可以通过作用于Caspase凋亡蛋白促进肿瘤细胞凋亡,后续研究还发现,吴茱萸碱还能够影响肿瘤细胞周期和肿瘤血管生成,具有广泛的抗肿瘤作用[9]。有研究表明,吴茱萸碱呈浓度依赖的抑制卵巢癌细胞HO-8910的生长,影响癌细胞的增殖活性[10-11]。本研究结果发现,吴茱萸碱作用后的子宫内膜癌细胞Ishikawa、HEC-1A、AN3CA增殖能力均明显下降,提示吴茱萸碱能够抑制子宫内膜癌细胞增殖,在子宫内膜癌中发挥抗肿瘤作用,这与上述实验报道相符合。后续选用吴茱萸碱抑制增殖能力最强的HEC-1A细胞为研究对象,以其半数抑制浓度4 μmol/L继续研究。
细胞凋亡是癌细胞的重要生物学现象,癌症的治疗与癌细胞的凋亡密切相关,提高癌细胞凋亡率是重中之重[12-13]。本研究结果显示,吴茱萸碱不仅能够促进子宫内膜癌细胞凋亡,而且能够提高射线照射处理后的细胞凋亡率,降低射线照射处理后的细胞存活率。本研究还发现,吴茱萸碱可增加子宫内膜癌细胞的放射敏感性,增敏比为1.628。
癌细胞内的ROS水平与细胞凋亡有关,细胞内ROS过度升高能够促进癌细胞的凋亡[14-16]。Caspase-3是Caspase蛋白家族的成员之一,在细胞凋亡过程中发挥执行因子的作用[17]。研究表明,吴茱萸碱可以通过诱导Caspase-3的活化,促进细胞中ROS水平升高诱导胰腺癌等肿瘤细胞凋亡[18]。本研究结果发现,吴茱萸碱不仅能够促进HEC-1A细胞内ROS水平的升高,促进Caspase-3的活化,而且能够增强射线照射处理后的HEC-1A细胞中ROS水平及Caspase-3的活化水平。提示吴茱萸碱诱导细胞凋亡作用机制及增强细胞放射敏感性可能与细胞内ROS水平及细胞内Caspase-3的活化水平有关。
p38信号通路参与肿瘤细胞的生长过程,在多种肿瘤组织中处于抑制状态[19]。促进p38磷酸化后,癌细胞的增殖受到抑制,凋亡增多[20-21]。Yang等[22]的研究表明,p38信号通路参与吴茱萸碱对黑色素瘤A375-S2细胞凋亡的影响过程,阻断p38信号通路后吴茱萸碱促黑色素瘤凋亡作用明显降低[22]。Hu等[23]在体内和体外研究发现吴茱萸碱能够增加胃癌放射敏感性,并且能够调控Akt磷酸化水平。本研究探讨了p38信号通路与吴茱萸碱对子宫内膜癌细胞放射敏感性的作用发现,吴茱萸碱能够促进子宫内膜癌细胞中p38的磷酸化水平,并且对射线照射处理后的子宫内膜癌细胞中p38的磷酸化水平升高有协同作用, 提示吴茱萸碱对子宫内膜癌细胞增殖、凋亡及放射敏感性的影响可能与p38信号通路有关。本研究还用p38抑制剂处理子宫内膜癌细胞,结果发现,p38抑制剂可以降低吴茱萸碱诱导的细胞凋亡,吴茱萸碱通过激活p38信号通路促进子宫内膜癌细胞凋亡。
综上所述,吴茱萸碱能够抑制子宫内膜癌细胞增殖,促进子宫内膜癌细胞凋亡,增强子宫内膜癌细胞放射敏感性,作用机制可能与增加细胞内ROS水平,以及激活p38信号通路有关。此外,还有研究发现,吴茱萸碱对癌细胞的作用机制与NF-κB信号通路也有密切关系,这为后续深入研究吴茱萸碱的抗肿瘤作用提供了基础,为癌症的治疗提供了新思路。
利益冲突 所有作者均于投稿前阅读并认可本研究内容,不存在任何潜在利益冲突,承诺无一稿多投作者贡献声明 刘明珠负责项研究设计、撰写、修改及统计学分析;樊锐太负责实验验收;顾浩负责文稿审校;王新杰负责实验实施及操作
| [1] |
Plante M, Touhami O, Trinh XB, et al. Sentinel node mapping with indocyanine green and endoscopic near-infrared fluorescence imaging in endometrial cancer[J]. Gynecol Oncol, 2015, 137(3): 443-447. DOI:10.1016/j.ygyno.2015.03.004 |
| [2] |
Zou Y, Qin X, Xiong H, et al. Apoptosis of human non-small-cell lung cancer A549 cells triggered by evodiamine through MTDH-dependent signaling pathway[J]. Tumour Biol, 2015, 36(7): 5187-5193. DOI:10.1007/s13277-015-3174-z |
| [3] |
Han S, Woo JK, Jung Y, et al. Evodiamine selectively targets cancer stem-like cells through the p53-p21-Rb pathway[J]. Biochem Biophys Res Commun, 2016, 469(4): 1153-1158. DOI:10.1016/j.bbrc.2015.12.066 |
| [4] |
Chen TC, Chien CC, Wu MS, et al. Evodiamine from evodia rutaecarpa induces apoptosis via activation of JNK and PERK in human ovarian cancer cells[J]. Phytomedicine, 2016, 23(1): 68-78. DOI:10.1016/j.phymed.2015.12.003 |
| [5] |
Meng ZJ, Wu N, Liu Y, et al. Evodiamine inhibits the proliferation of human osteosarcoma cells by blocking PI3K/Akt signaling[J]. Oncol Rep, 2015, 34(3): 1388-1396. DOI:10.3892/or.2015.4084 |
| [6] |
Khan M, Bi Y, Qazi JI, et al. Evodiamine sensitizes U87 glioblastoma cells to TRAIL via the death receptor pathway[J]. Mol Med Rep, 2015, 11(1): 257-262. DOI:10.3892/mmr.2014.2705 |
| [7] |
de Boer SM, Powell ME, Mileshkin L, et al. Toxicity and quality of life after adjuvant chemoradiotherapy versus radiotherapy alone for women with high-risk endometrial cancer (PORTEC-3):an open-label, multicentre, randomised, phase 3 trial[J]. Lancet Oncol, 2016, 17(8): 1114-1126. DOI:10.1016/S1470-2045(16)30120-6 |
| [8] |
Mohan V, Agarwal R, Singh RP. A novel alkaloid, evodiamine causes nuclear localization of cytochrome-c and induces apoptosis independent of p53 in human lung cancer cells[J]. Biochem Biophys Res Commun, 2016, 477(4): 1065-1071. DOI:10.1016/j.bbrc.2016.07.037 |
| [9] |
刘利琼, 任伟, 谢丽, 等. 吴茱萸碱诱导肿瘤细胞凋亡的分子机制研究进展[J]. 现代肿瘤医学, 2015, 23(10): 1471-1474. Liu LQ, Ren W, Xie L, et al. Molecular mechanism of tumor cell apoptosis induced by evodiamine[J]. J Modern Oncol, 2015, 23(10): 1471-1474. DOI:10.3969/j.issn.1672-4992.2015.10.44 |
| [10] |
Spinella F, Rosanò L, Di CV, et al. Green tea polyphenol epigallocatechin-3-gallate inhibits the endothelin axis and downstream signaling pathways in ovarian carcinoma[J]. Mol Cancer Ther, 2006, 5(6): 1483-1492. DOI:10.1158/1535-7163.MCT-06-0053 |
| [11] |
Ganta S, Singh A, Rawal Y, et al. Formulation development of a novel targeted theranostic nanoemulsion of docetaxel to overcome multidrug resistance in ovarian cancer[J]. Drug Deliv, 2016, 23(3): 968-980. DOI:10.3109/10717544.2014.923068 |
| [12] |
Brünker P, Wartha K, Friess T, et al. RG7386, a novel tetravalent FAP-DR5 antibody, effectively triggers FAP-dependent, avidity-driven DR5 hyperclustering and tumor cell apoptosis[J]. Mol Cancer Ther, 2016, 15(5): 946-957. DOI:10.1158/1535-7163.MCT-15-0647 |
| [13] |
Fiala M. Curcumin and omega-3 fatty acids enhance NK cell-induced apoptosis of pancreatic cancer cells but curcumin inhibits interferon-γproduction:benefits of omega-3 with curcumin against cancer[J]. Molecules, 2015, 20(2): 3020-3026. DOI:10.3390/molecules20023020 |
| [14] |
Xiang T, Du L, Pham P, et al. Nelfinavir, an HIV protease inhibitor, induces apoptosis and cell cycle arrest in human cervical cancer cells via the ROS-dependent mitochondrial pathway[J]. Cancer Lett, 2015, 364(1): 79-88. DOI:10.1016/j.canlet.2015.04.027 |
| [15] |
Che M, Wang R, Li X, et al. Expanding roles of superoxide dismutases in cell regulation and cancer[J]. Drug Discov Today, 2016, 21(1): 143-149. DOI:10.1016/j.drudis.2015.10.001 |
| [16] |
Siddiqui S, Ahmad E, Gupta M, et al. Cissus quadrangularis Linn exerts dose-dependent biphasic effects:osteogenic and anti-proliferative, through modulating ROS, cell cycle and Runx2 gene expression in primary rat osteoblasts[J]. Cell Prolif, 2015, 48(4): 443-454. DOI:10.1111/cpr.12195 |
| [17] |
Lin MT, Lin CL, Lin TY, et al. Synergistic effect of fisetin combined with sorafenib in human cervical cancer HeLa cells through activation of death receptor-5 mediated caspase-8/caspase-3 and the mitochondria-dependent apoptotic pathway[J]. Tumour Biol, 2016, 37(5): 6987-6996. DOI:10.1007/s13277-015-4526-4 |
| [18] |
陈辉, 王兆洪, 陈龙, 等. 吴茱萸碱对人胰腺癌SW1990细胞株体内外增殖及凋亡的影响[J]. 温州医科大学学报, 2017, 47(6): 431-434, 440. Chen H, Wang ZH, Chen L, et al. The effects of evodiamine on the proliferation and apoptosis of pancreatic cancer SW1990 cells in vivo and in vitro[J]. J Wenzhou Med Univ, 2017, 47(6): 431-434, 440. DOI:10.3969/j.issn.2095-9400.2017.06.009 |
| [19] |
Kang N, Jian JF, Cao SJ, et al. Physalin a induces G2/M phase cell cycle arrest in human non-small cell lung cancer cells:involvement of the p38 MAPK/ROS pathway[J]. Mol Cell Biochem, 2016, 415(1-2): 145-155. DOI:10.1007/s11010-016-2686-1 |
| [20] |
Taniuchi K, Furihata M, Hanazaki K, et al. Peroxiredoxin 1 promotes pancreatic cancer cell invasion by modulating p38 MAPK activity[J]. Pancreas, 2015, 44(2): 331-340. DOI:10.1097/MPA.0000000000000270 |
| [21] |
张亚宏, 甘莹, 郭子华, 等. 紫草素通过ROS/p38信号通路诱导人宫颈癌HeLa细胞凋亡[J]. 中国药理学通报, 2011, 27(6): 864-867. Zhang YH, Gan Y, Guo ZH, et al. Involvement of ROS/p38 signal pathway in shikonin-induced apoptosis in HeLa cells[J]. Chin Pharm Bull, 2011, 27(6): 864-867. DOI:10.3969/j.issn.1001-1978.2011.06.029 |
| [22] |
Yang J, Wu LJ, Tashiro SI, et al. Nitric oxide activated by p38 and NF-κB facilitates apoptosis and cell cycle arrest under oxidative stress in evodiamine-treated human melanoma A375-S2 cells[J]. Free Radic Res, 2008, 42(1): 1-11. DOI:10.1080/10715760701762407 |
| [23] |
Hu C, Gao X, Han Y, et al. Evodiamine sensitizes BGC-823 gastric cancer cells to radiotherapy in vitro and in vivo[J]. Mol Med Rep, 2016, 14(1): 413-419. DOI:10.3892/mmr.2016.5237 |
 2018, Vol. 38
2018, Vol. 38


